磷脂酰肌醇蛋白聚糖-3(GPC3),是硫酸乙酰肝素(HS)蛋白聚糖家族的成员。它通过磷脂酰肌醇锚定在细胞膜上,是细胞表面多功能的共同受体,在介导信号传递中发挥重要作用。它也可通过结合胞外基质、生长因子和蛋白酶等影响信号传递,在调节肿瘤的细胞增殖、分化、黏附和转移等过程中发挥重要作用。它在肝细胞癌(HCC)中表达,但在正常或良性肝病的肝细胞中检测不到,它用作肝细胞癌(HCC)的标记物。
GPC3的表达分布
GPC3主要表达在成纤维细胞、合胞滋养层细胞、平滑肌细胞、胞外滋养层细胞、Muller胶质细胞、细胞滋养层细胞中。
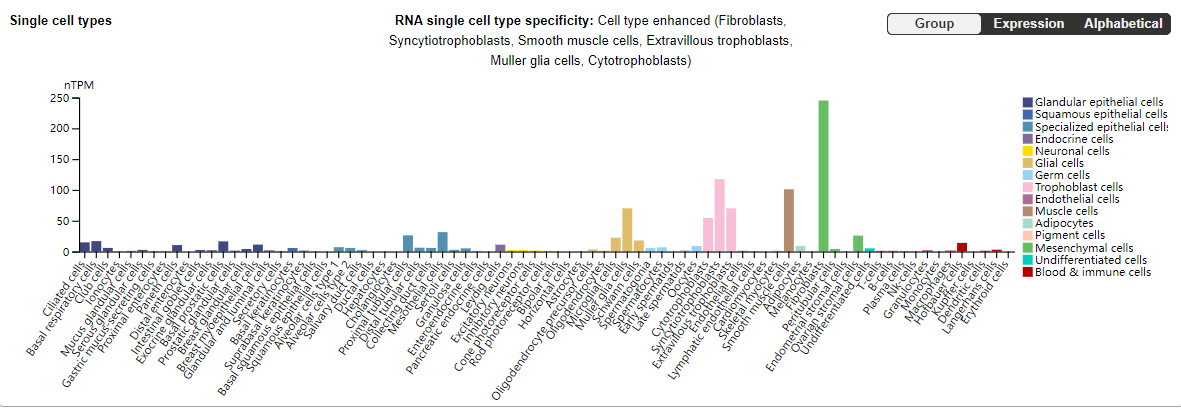
在胚胎阶段,GPC3以阶段和组织特异性的方式广泛表达。可在胎盘和其他胚胎组织(包括卵巢、乳腺,肝脏和肾)中检测到GPC3表达,但在大多数成人组织中,除了胎盘中表达,其他组织GPC3不存在或表达较低。
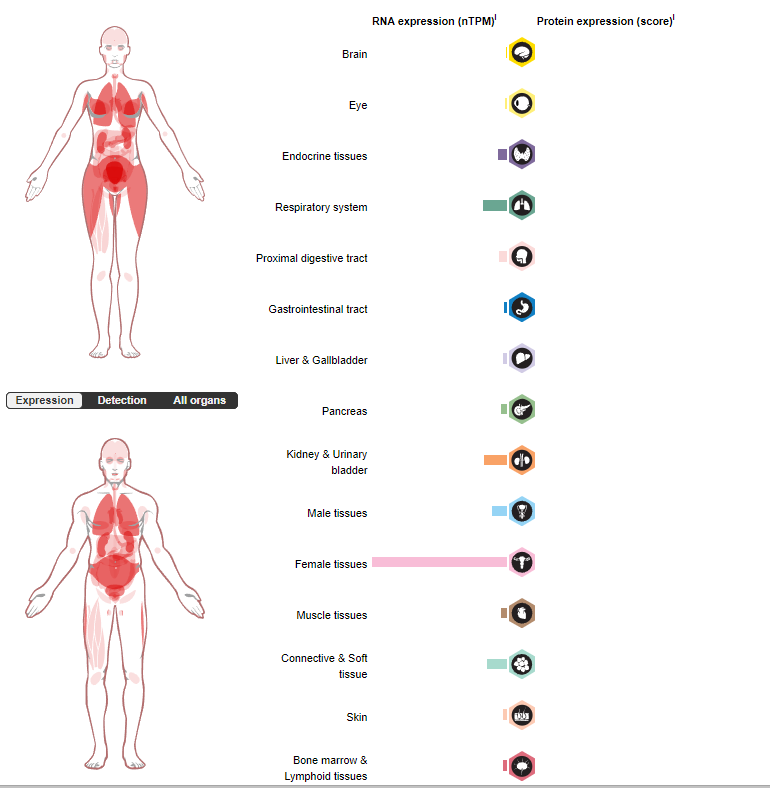
(数据来源 uniprot)
GPC3的结构
GPC3是一种膜蛋白,位于X染色体(Xq26)上,该蛋白分子量为70kDa,由580个氨基酸组成,在成熟过程中被裂解成2个亚基,这些亚基仍通过二硫键连接。Arg358和Ser359之间的弗林样转化酶会裂解形成40kDa的N端亚基和30kDa的C端亚基,其特征是在Ser495和Ser509位点有2个HS链。它有三个N-糖基化位点,分别位于Asn124、Asn241和Asn418。与其他磷脂酰肌醇蛋白聚糖成员一样,GPC3在其C端也具有COOH端疏水性GPI锚定结构域,用于与细胞膜结合。
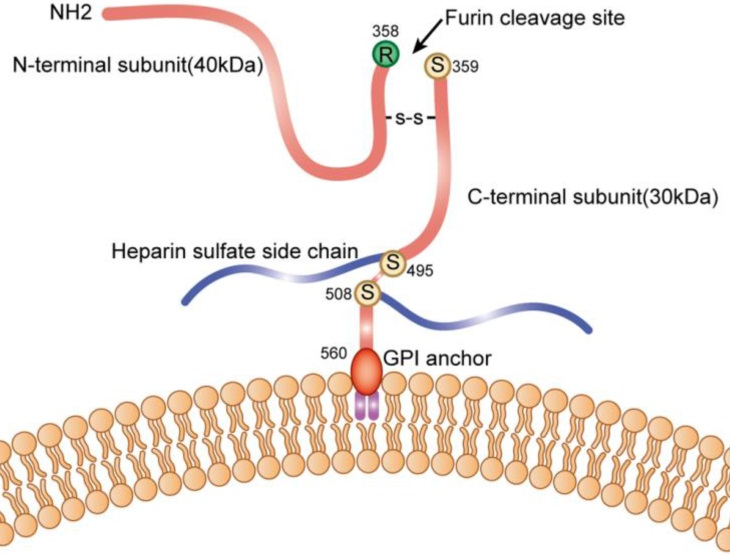
(数据来源GuoM, etal. JCancer. 2020)
GPC3在肝癌细胞中的信号通路
GPC3通过激活多种信号通路,如Wnt/β-catenin、Hedgehog和YAP/TAZ等,促进HCC细胞的生长、增殖和分化。在Hedgehog(Hh)信号通路,GPC3可与Hh结合,导致Hh失去与其受体Ptc的结合能力。Ptc会抑制Smo蛋白活性,从而抑制下游通路。Wnt信号通路中GPC3过表可上调c-Myc的表达。阻断GPC3与Wnt的相互作用会导致HCC细胞增殖下调。
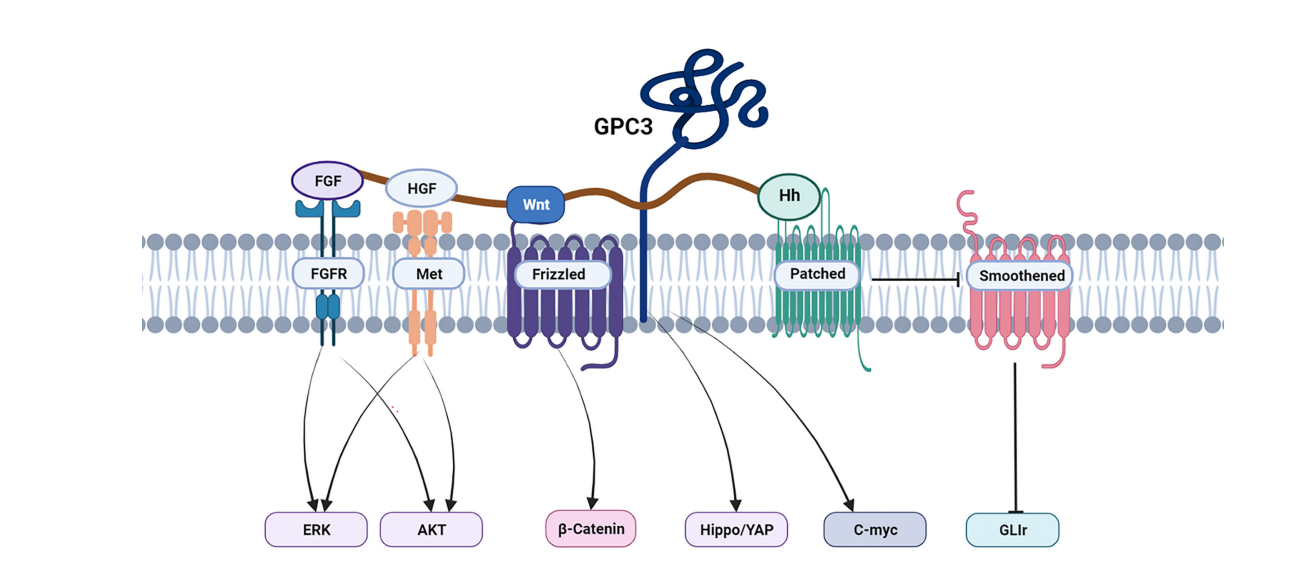
(数据来源Zheng X, et al. Front Oncol. 2022 )
GPC3靶向治疗
目前有多种GPC3靶向治疗方法,目前针对GPC3的药物研发主要集中在单克隆抗体,双特异性抗体,CAR-T细胞疗法,以及与其他治疗方案的联合疗法。

(数据来源Zheng X, et al. Front Oncol. 2022 )
Codrituzumab是由Chugai Pharmaceutica开发的首个针对GPC3特异性人源化单抗,在2016年的二期临床试验中,其在肝细胞癌(HCC)二线治疗中的效果并未达到预期。目前Codrituzumab重新进入临床l期阶段,用于治疗GPC3阳性肿瘤,实体瘤。
CM-350是一种由康诺亚生物医药科技开发的一种靶向GPC3和CD3双特异性抗体。CM350目前正处于l/ l l期临床试验阶段,主要针对晚期恶性实体瘤和其他一些实体瘤。
ERY-974是由Chugai Pharmaceutical在单抗GPC3的基础上开发的一种靶向GPC3和CD3的双特异性抗体。ERY974抗体可以识别GPC3和CD3双抗原,在T细胞和肿瘤细胞之间构成了免疫突触,介导T细胞杀伤GPC3过表达的肿瘤细胞。目前处于临床l期阶段用于治疗转移性肝癌。2022年9月Sano, Y等人在Nature Communications杂志发表了ERY974与化药联合用药的结果,研究发现ERY974联合化疗可相互增强对非炎症性肿瘤的疗效。
AZD-5851是由阿斯利康开发的基于转化生长因子-β受体II(TGFβRII)显性负装甲发现平台设计的新型GPC3靶向CAR-T技术的。处于临床l/ l l阶段,用于治疗GPC3阳性肝细胞癌。阿斯利康与中国生物技术公司AbelZeta合作开发的GPC3蛋白靶向疗法(C-CAR031)也是基于AZD-5851的新型“装甲”技术设计的。TGF-β(转化生长因子β)在肿瘤微环境中具有高度免疫抑制作用,会抑制免疫细胞的功能,帮助肿瘤逃避免疫系统的攻击。通过“装甲”技术,C-CAR031能够对抗这种抑制作用,从而提高疗效。
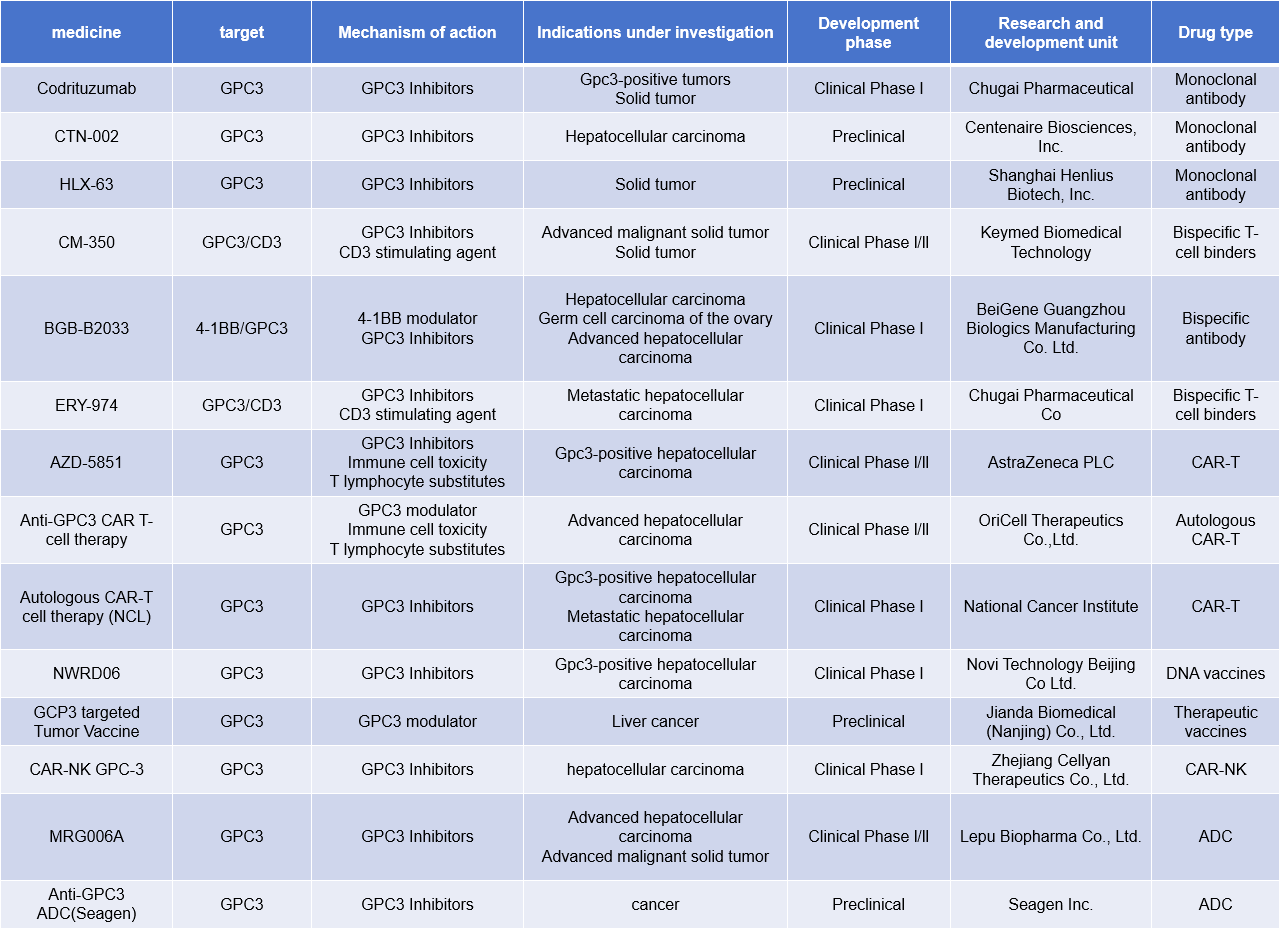
(数据来源 新药情报库)
我们收集整理一批GPC3相关抗体序列信息。文档可关注公众号“迈思生物”,号内回复“GPC3”下载。
