背景
消化系统癌症是全球癌症相关发病率和死亡率的主要因素,占每年癌症死亡病例的35%。这些癌症实体的病因、分子特征和治疗管理具有高度异质性和复杂性。在过去十年中,基因组和功能研究为消化道癌的生物学提供了前所未有的见解,确定了肿瘤进展的遗传驱动因素以及肿瘤细胞与免疫系统的关键相互作用点。这些知识不断转化为新的治疗概念和靶点,从而动态地重塑这些肿瘤的治疗格局。

2025年1月15日,海德堡大学Matthias P. Ebert在Signal transduction and targeted therapy发表了一篇综述“Digestive cancers: mechanisms, therapeutics and management”。在这篇综述中,概述了六种最常见的消化系统癌症的病因和分子病理学,包括食管癌、胃癌、胆道癌、胰腺癌、肝细胞癌和结直肠癌。全面描述了这些恶性肿瘤的当前阶段依赖性药物治疗,包括化疗、靶向和免疫治疗。对于每种癌症实体,提供了近期治疗进展和研究进展的概述。最后,描述了对肿瘤异质性和免疫逃逸的新见解如何加深对治疗耐药性的理解,并对将塑造消化系统癌症未来管理的创新治疗策略进行了展望,包括CAR-T细胞疗法、新型抗体药物偶联物和靶向疗法。
食管鳞状细胞癌
食管鳞状细胞癌(ESCC)的影响因素是吸烟和饮酒,除此它还与遗传因素有关。在ESCC中会出现受体酪氨酸激酶和下游信号介质的改变,TGF-β通路的失调和染色质重塑的改变,和其他信号通路的改变。早期以及局部晚期,可切除ESCC通常通过手术切除和放化疗的方式治疗。晚期不可切除或转移性ESCC的治疗仅限于预后不良的化疗。最近发现免疫检查点抑制剂,可通过阻断
癌细胞介导的免疫逃逸可以下调并促进抗肿瘤免疫反应。免疫检查点抑制剂治疗ESCC显示出生存益处,显着改变了当前的治疗方法。虽然抑制剂通常比传统化疗耐受性更好,但它们仍然表现出自己的毒性特征以及耐药性。

胃和食管交界处腺癌
胃癌(GC)通常由环境因素,包括幽门螺杆菌感染等传染性和非传染性引起,癌症基因组图谱研究网络提出了将GC分为4个分子亚组的分类:MSI、EBV、GS和CIN。
转移性GC和GEJ腺癌的一线和二线治疗基于化疗和抗体治疗的结合。治疗方案的选择在很大程度上取决于患者的体能状态、既往治疗和预测生物标志物的表达,包括HER2、MSI、PD-L1和最近的CLDN18.2。将化疗与免疫检查点抑制剂联合治疗可以提高患者的生存期和缓解率。随着 CLDN18.1和FGFR2b等新靶点的出现以及改进的HER2和免疫检查点靶向抗体,主要挑战将是优化GC的分子分层并确定靶向药物的协同组合。

胆道癌
胆道癌或胆管细胞癌(CCA)包括一组异质性恶性肿瘤,CCA的致癌作用是一个复杂的过程,涉及基因组和表观遗传改变,这些改变调节DNA修复、受体酪氨酸激酶信号传导和表观遗传调控等过程。尽管最近在诊断方法和治疗方面取得了进展,但CCA总体预后较差。化疗与免疫疗法的联合治疗已成为CCA一线治疗的标准护理。免疫联合疗法或免疫疗法与其他药物联合的作用迄今仍未取得显著成功。更好地了解致癌和癌症进展的潜在机制对于扩大可以从定制治疗方法中受益的患者群体是必要的。

肝细胞癌
肝细胞癌(HCC)是原发性肝癌,最重要的风险因素是慢性病毒性肝炎感染,特别是HBV和HCV,它们会导致慢性炎症和肝细胞损伤,促进基因突变和异常细胞生长。HBV和HCV感染通过病毒复制、免疫细胞激活和促炎细胞因子的产生导致这种炎症。这些信号激活通路和关键的肿瘤驱动因素,如TGF-β、Wnt/β-catenin、Notch、EGF、HGF、VEGF、SHH和YAP/TAZ等,最终增强细胞存活、增殖和逃避细胞凋亡。
早期的HCC通常采用手术切除的方式治疗,中期HCC通常采用TACE,包括将化疗药物注射到供应肿瘤的肝动脉中,然后栓塞以诱导缺血性肿瘤坏死。全身靶向治疗彻底改变了晚期HCC的治疗,免疫检查点抑制剂开启HCC全身治疗新篇章,提高总生存率。免疫检查点抑制剂和TKI的另一种组合并未显示出生存获益。

胰腺癌
胰腺癌是全球第五大癌症相关死亡原因,其中胰腺导管腺癌(PDAC)是最常见的类型。KRAS突变是胰腺癌中最常见的基因改变,超过90%的患者存在KRAS突变。KRAS激活后通过RAF/MEK/ERK和PI3K/AKT信号通路促进细胞周期进展和细胞存活。
对于转移性PDAC,全身治疗适用于缓解肿瘤相关症状和延长生存期。EGFR抑制剂厄洛替尼联合吉西他滨在显示优于吉西他滨单药治疗的生存获益后,也被批准用于PDAC的一线治疗。随着此后更有效的联合疗法被批准,这种方案在当今的临床实践中只发挥了很小的作用,而FOLFIRINOX可能会继续作为体能状态良好的患者的一线治疗最频繁地使用。
针对KRAS G12C突变的特异性抑制剂(如sotorasib和adagrasib)在早期临床试验中显示出一定的疗效,但目前仅适用于少数患者。合理设计有效的联合疗法仍然具有挑战性,需要进行广泛的临床测试。

结直肠癌
结直肠癌(CRC)是全世界的第三种常见癌症,早期或者局部进展期患者通常采用手术切除的方式治疗,对于III期患者,手术后通常需要辅助化疗。
免疫检查点抑制剂极大地改善了癌症治疗。在CRC中,它们是MSI/dMMR转移性或不可切除疾病的标准治疗。由于大量的临床和转化研究工作,CRC的治疗前景正在不断发展,因此预计未来几年会出现许多新的发展,尤其是在精准医学、免疫疗法和微生物组研究领域。

消化道癌的治疗-当前的挑战
肿瘤异质性和可塑性:肿瘤异质性和可塑性使得消化道癌对治疗反应复杂,其异质性可发生在遗传、表观遗传和环境等多个层面,影响治疗效果,而可塑性则让癌症细胞能在不改变遗传背景的情况下适应环境扰动,如抗肿瘤治疗,导致治疗难度增加。
胃肠道癌症的免疫逃避:肿瘤内在机制包括基因改变导致诱导免疫规避的致癌信号途径激活,如Wnt信号通路激活等导致T细胞排斥,导致免疫脱逃的肿瘤外部机制主要包括自体和旁分泌信号,如生长因子和影响先天和适应性免疫反应的化学因子。例如,在CRC肝转移的肿瘤微环境中,高TGF-β水平可产生免疫抑制状态,而阻断TGF-β可增加肿瘤对免疫检查点阻断的敏感性。
对于根据肿瘤的阶段,可能需要不同的免疫肿瘤治疗策略。
将癌症基因组学数据转化为可操作的靶标:将癌症基因组数据转化为可操作靶点面临挑战,精准肿瘤学在消化道癌症管理中的广泛实施需要多层面努力,包括更公平地获取遗传服务以及分析和解释基因组数据的基础设施和资源。
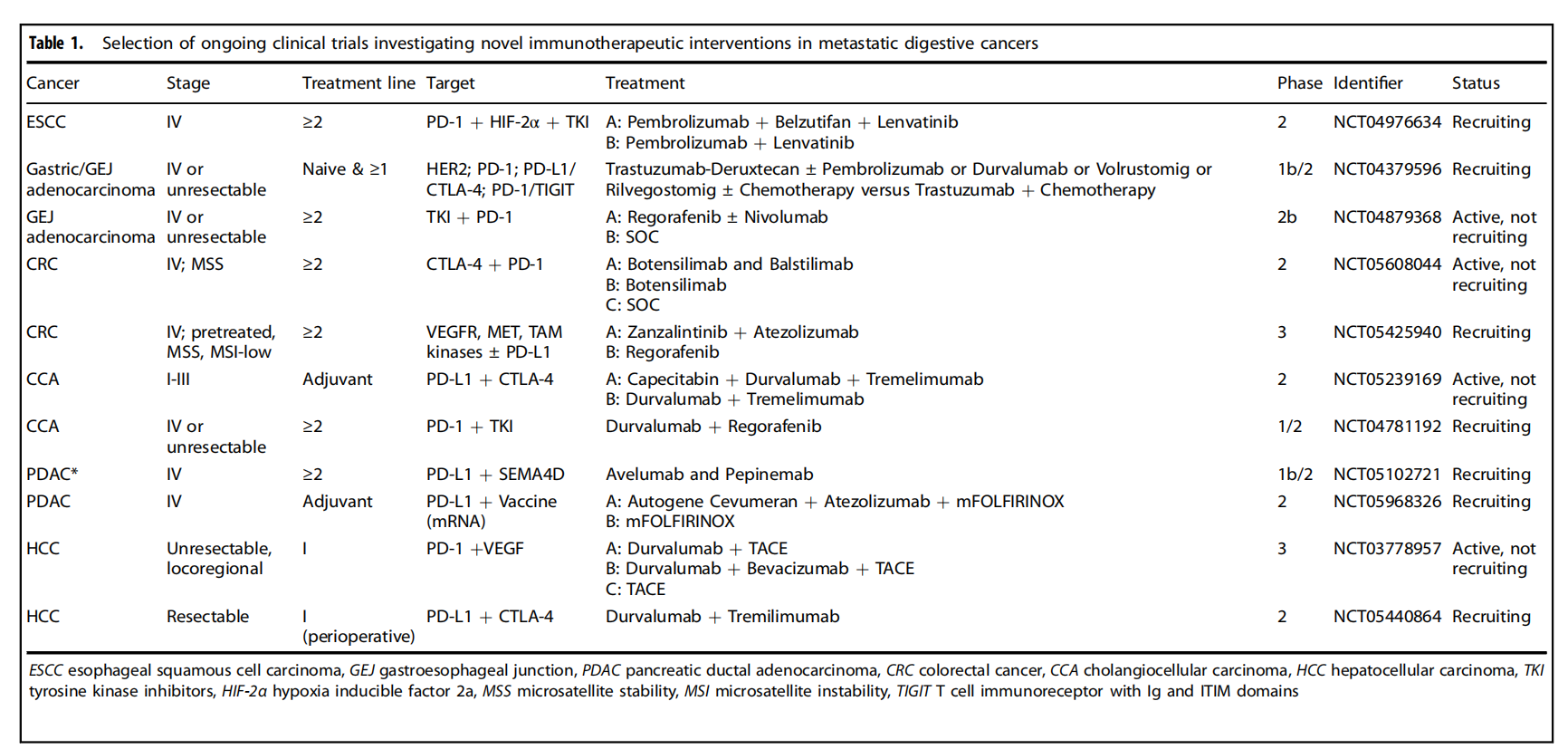
消化道癌的治疗-未来方向
未来消化道癌的治疗将聚焦于精准医学和免疫治疗的深化与拓展,包括开发针对KRAS等关键基因突变的新型抑制剂、CAR-T细胞疗法的优化以及靶向肿瘤微环境的创新策略。此外,研究将致力于探索免疫逃逸机制,开发联合治疗方案以克服耐药性,并通过多组学技术进一步解析肿瘤生物学特征,以实现更个性化和有效的治疗策略。
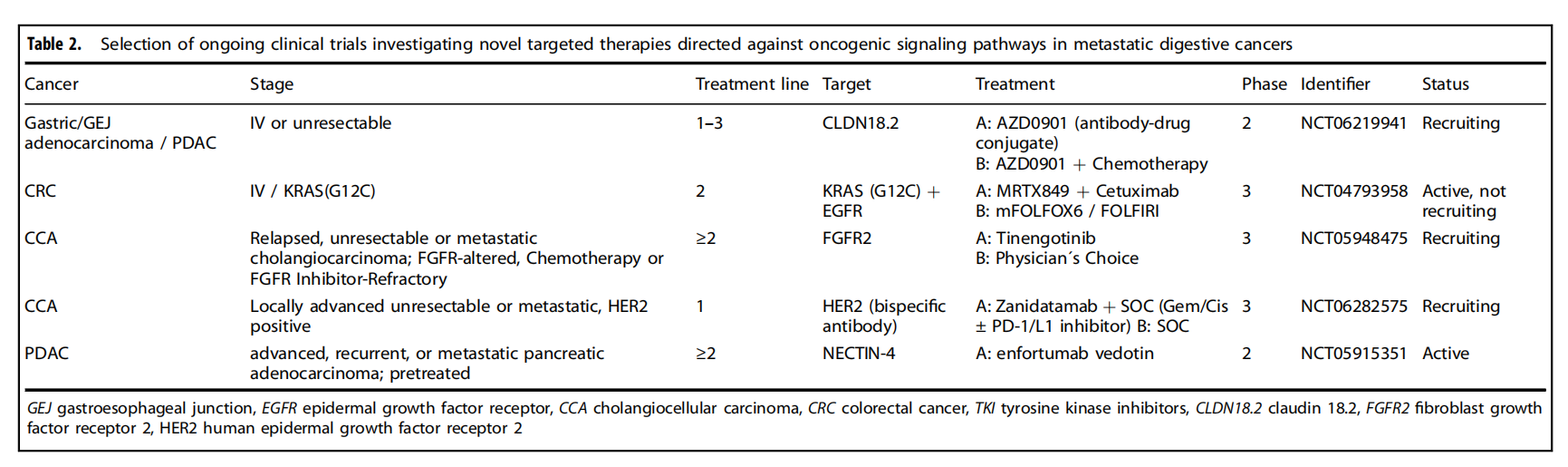

总结
消化系统肿瘤是主要的疾病负担,随着基因型特异性KRAS抑制剂和泛KRAS抑制剂的问世,预计更多消化系统肿瘤患者将从靶向治疗中获益。这种精准肿瘤学方法将得到新型抗体(如双特异性抗体和靶向特异性细胞表面蛋白(如CLD18.2)大量表达的肿瘤的抗体-药物偶联物)的补充。对消化系统癌症的进一步分子表征将在未来产生更多的细胞表面靶点,从而扩大抗体的治疗谱。随着不同药物治疗领域的进步,确定免疫、靶向和化疗的最佳组合,并发现预测这些组合疗效的生物标志物将是一个重大挑战。最后,癌症管理的其他领域的进步,如放射治疗和手术,也将重塑消化系统癌症的治疗。综上所述,这些进展将导致消化系统肿瘤更加复杂和多学科的管理,从而在未来获得更好的肿瘤学结局。
