TL1A是肿瘤坏死因子配体超家族成员15(TNFSF15),也称为TL1,VEGI。DcR3是TL1A的功能性配体,他们在调节先天性免疫和适应性免疫中发挥重要作用。它是炎症性肠病(IBD),过敏性疾病,自身免疫性疾病的治疗靶点。
TL1A的表达分布
TL1A主要表达在腺上皮细胞,鳞状上皮细胞,特化上皮细胞中,在免疫细胞,例如巨噬细胞,树突细胞,朗格汉斯细胞中也有表达。
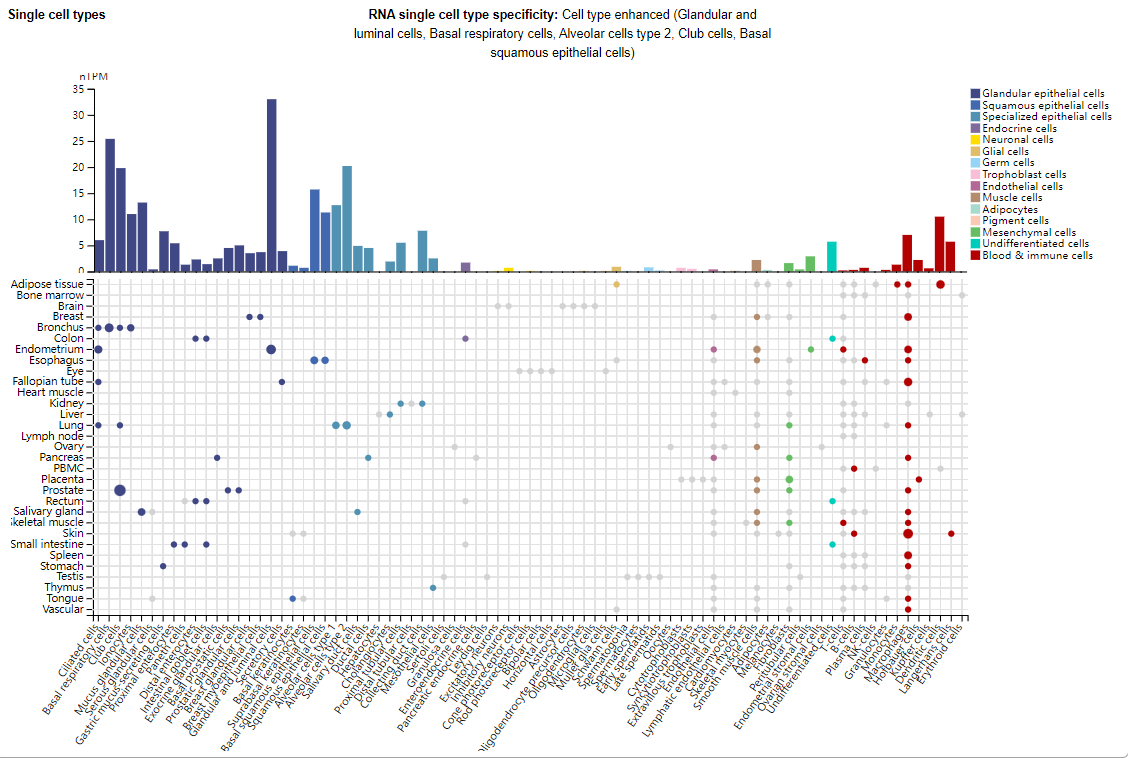
(数据来源 uniprot)
TL1A的结构和其受体
TL1A是一种II型跨膜蛋白,包含胞质、跨膜和胞外结构域。C端胞外结构域,包含典型的TNF同源结构域(THD),由反向平行的β折叠片层构成,形成三聚体结构。与其他TNF家族成员一样,TL1A作为稳定的三聚体和膜结合(mTL1A)亚型存在于细胞表面。sTL1A是由基质金属蛋白酶(TACE)催化mTL1A产生的可溶性全功能异构体。TL1A的功能受体是DR3,TNFR超家族成员(TNFRSF25)。DR3是一种具有胞外、跨膜和胞质结构域的I型蛋白。TL1A以三聚体形式结合DR3三聚体,形成3:3复合物。
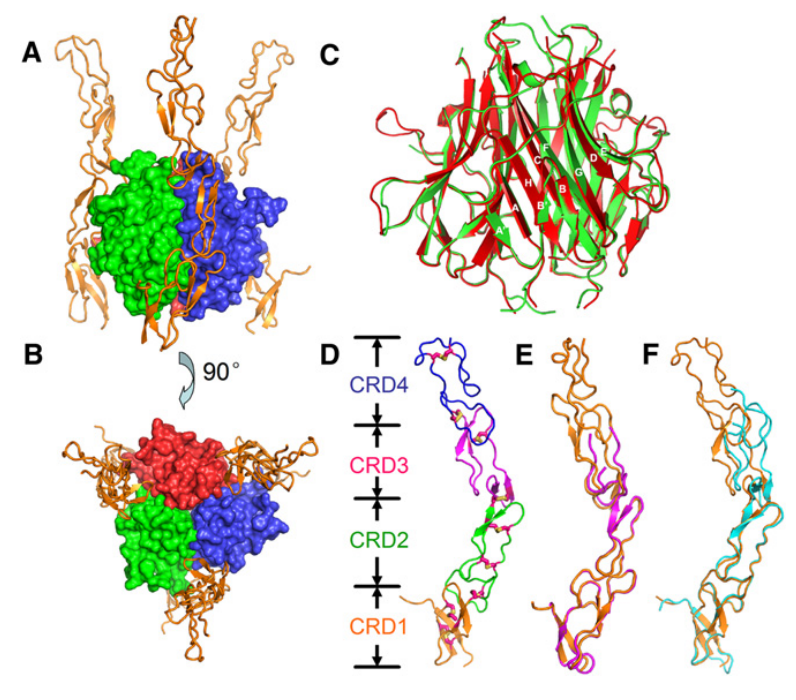
(数据来源 Zhan C, Patskovsky Y, Yan Q, et al. Structure. 2011)
TL1A的信号通路和调控
DR3的细胞内区域包含一个死亡结构域的特征配置,该死亡结构域通过TRADD发出信号。在与TL1A结合时,下游信号传导可能采取两种不同的途径之一,这取决于配体结合的细胞和分子环境。第一种情况是TL1A与DR3结合后,可能激活NF-κB、MAPK、PI3K等信号通路,促进炎症反应。第二种情况是TRADD从DR3的死亡结构域解离,并在细胞质中与FADD结合,导致caspase-8和caspase-3的活化。这种情况下的结果是程序性细胞死亡诱导细胞凋亡。
TL1A还能够与诱骗受体DcR3(TNFRSF6B)结合,后者与DR3竞争配体结合,从而抑制TL1A的功能效应。
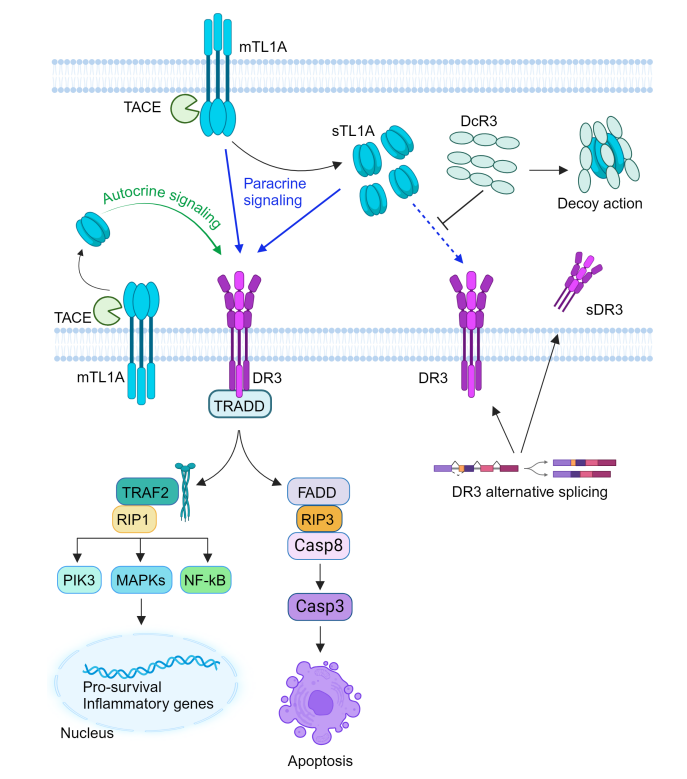
(数据来源 Bamias G, et al. Gut. 2024)
TL1A在免疫调节中的作用
作为共刺激分子:TL1A:DR3是一个有效的共刺激系统,可有效放大各种免疫表型的适应性免疫应答。
调节T细胞亚群:包括Th1、Th17和Th9细胞,同时也能激活调节性T细胞(Tregs),在维持免疫稳态中发挥重要作用。
调节天然免疫反应:TL1A能够通过DR3信号通路调节ILCs的功能,促进IL-22等细胞因子的分泌,从而维持肠道黏膜的稳态。
参与炎症反应和肠道黏膜屏障功能的调节:促进炎症细胞的招募和激活,维持肠道黏膜的完整性。TL1A的异常表达与炎症性肠病、过敏性疾病和自身免疫性疾病的发生和发展密切相关。
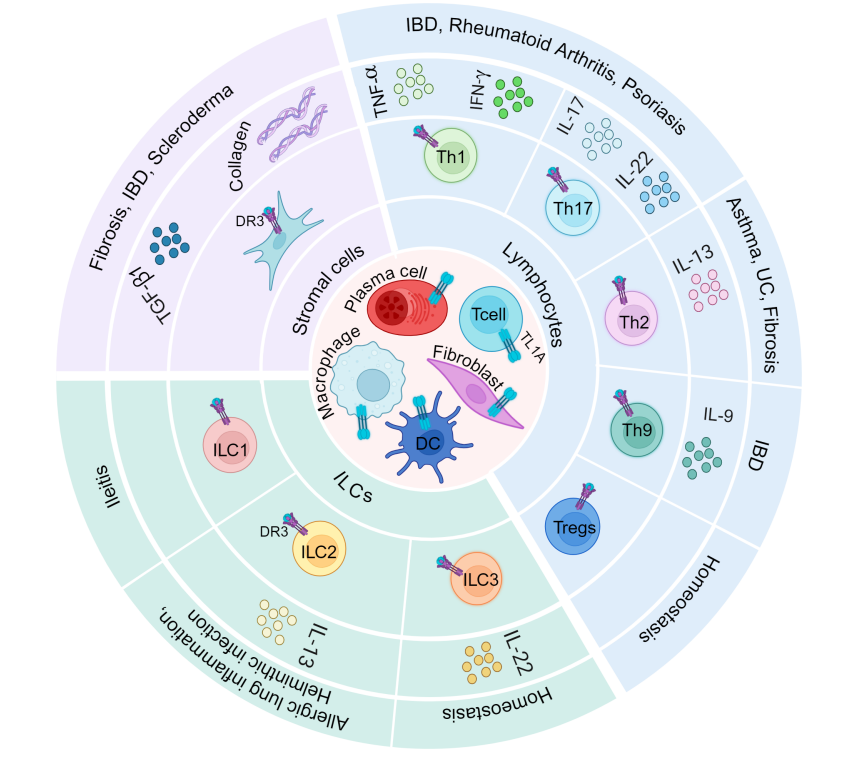
(数据来源 Bamias G, et al. Gut. 2024)
参与纤维化过程:TL1A在肠道纤维化中发挥重要作用,能够通过DR3信号通路促进成纤维细胞的增殖和胶原蛋白的合成,从而加剧纤维化过程。在IBD患者中,TL1A的高表达与肠道纤维化密切相关。

(数据来源 Bamias G, et al. Gut. 2024)
TL1A的靶向治疗
针对TLIA的靶向治疗方式目前主要是单克隆抗体,目前有许多抗体在临床研究中。Afimkibart(PF-06480605)是由辉瑞制药开发的一款靶向TL1A的全人源化IgG1单克隆抗体,一项NCT02840721(TUSCANY)2a期研究,评估PF-06480605在50例中重度UC患者诱导治疗的疗效、安全性、耐受性和药代动力学。这些患者接受了500 mg PF-06480605静脉注射,每2周1次,共7剂,随访期为3个月。研究结果显示,出现治疗相关不良事件共18起,最常见的为UC加重和关节痛,以及4起严重不良事件。PF-06480605与第14周时内镜和组织学结局的统计学显著改善相关。目前PF-06480605正在进行临床3期研究。
一项评估PRA023(现名为Tulisokibart)治疗中度至重度活动性UC疗效和安全性的3期、随机、双盲、安慰剂对照、诱导和维持研究目前正在进行中(NCT06052059)。研究结果显示,它在12周时出现了临床缓解。
Duvakitug(TEV 48574)是由瓦特制药开发的一款靶向TL1A的单克隆抗体,试验性药物TEV-48574可能具有双重抗纤维化和抗炎症作用,目前正在溃疡性结肠炎(UC)和克罗恩病(CD)患者中进行2期研究。
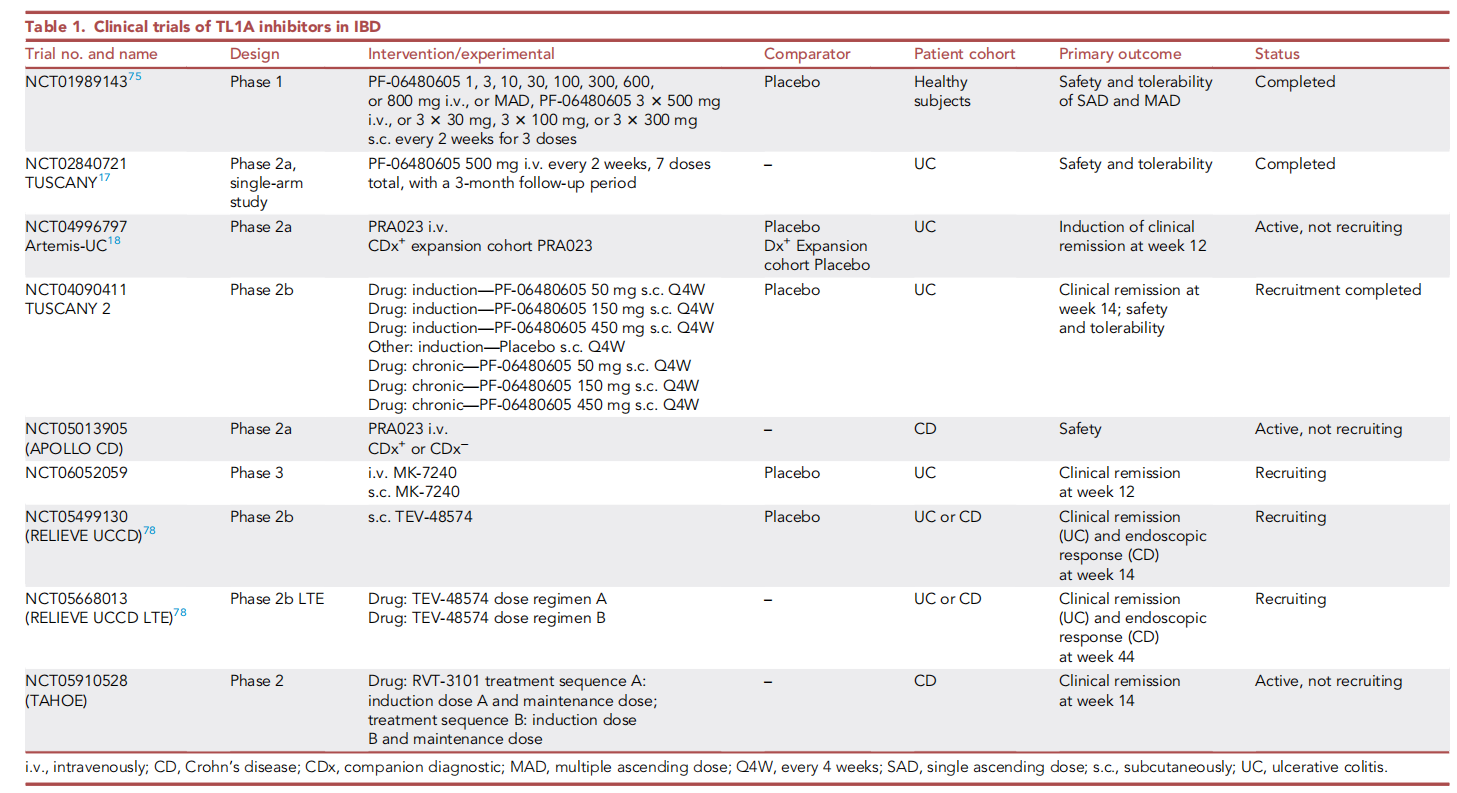
(数据来源 Solitano V, et al. Med. 2024)
PF-07261271是辉瑞制药开发的一款靶向TNFSF15(TL1A)和IL-12的p40亚基两个靶点的双特异性抗体,用于治疗炎症性肠病,目前处于临床1期研究阶段。
近日,三生国健研发的抗TL1A单抗SSGJ-627注射液的临床试验申请(IND)已获得国家药品监督管理局药品审评中心(CDE)正式受理。这标志着该靶点在国内的临床研究迈出了第一步,SSGJ-627成为国内首个获得IND受理的TL1A靶点药物。
我们收集整理一批TL1A相关抗体序列信息。文档可关注公众号“迈思生物”,号内回复“TL1A”下载。

