背景
自从FAD批准的首个治疗抗体以来,抗体产品在药物市场上发展迅速,在单克隆抗体成功的基础上,最近的研究利用了抗体良好的特异性和药代动力学特性来创造新的抗体融合蛋白,能够靶向传递治疗有效载荷。
2021年10月25日,Aliyah B Silver团队在Trends Pharmacol Sci上发表了一篇名为“Engineered antibody fusion proteins for targeted disease therapy”的文章,该文章总结了抗体与疾病相关的载荷基因融合的治疗方法的最新工程化和转化进展,包括细胞因子、毒素、酶、神经保护剂和可溶性因子陷阱。目前有许多抗体融合蛋白处于临床试验阶段,还有其他创新分子也即将跟进,这些强效的多功能药物候选有望在未来几年成为治疗开发领域的主要参与者。

有效载荷免疫细胞因子的临床前和临床进展
有效载荷免疫细胞因子是包含与疾病相关抗原或其他细胞标记特异性抗体或抗体片段融合的细胞因子的治疗性融合蛋白。抗体融合蛋白已经多样化,通过将各种有效载荷与不同的抗体成分联系起来,包括全长免疫球蛋白、FC域、单链可变片段、单域抗体和抗原结合片段。

癌症中的有效载荷免疫细胞因子
作为癌症疗法,免疫细胞因子载荷的研究最为广泛。在最近的制剂中,抗体已与细胞因子载荷融合,包括白细胞介素IL-4、IL-15、TNFα、IL-2、IL-12、IL-21、IFN-α和IFN-β。这些细胞因子可能在稳态中发挥免疫刺激、免疫抑制或多效作用。
将细胞因子有效载荷传递到肿瘤微环境(TME),通过将细胞因子融合到重组的F8单克隆抗体片段,F8的几种细胞因子融合蛋白已在癌症的临床前和临床上取得了成功。例如,一个含有IL-4的基于SCFV的融合分子,F8-IL4-F8,研究发现可定位至肿瘤,并可抑制小鼠癌的生长。
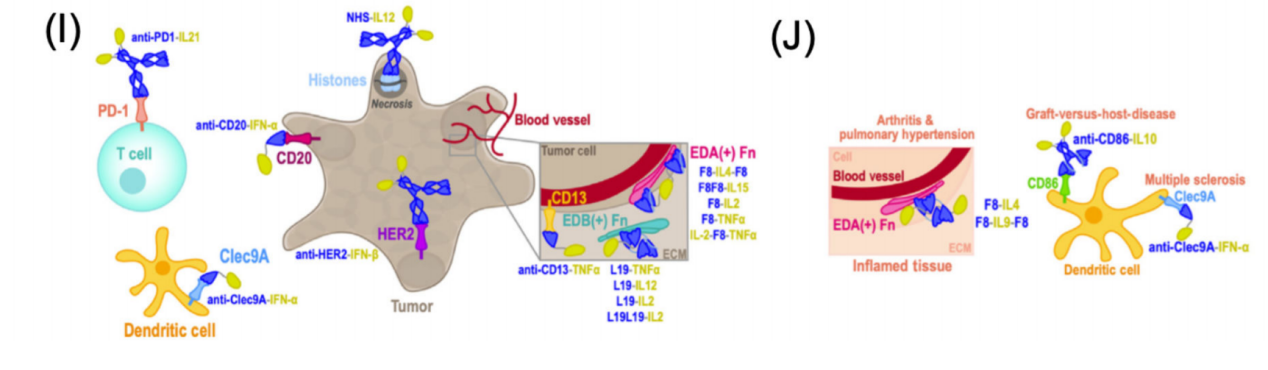
ECM靶向抗体L19已被纳入最近开发的免疫细胞因子中,它与纤维连接蛋白的选择性剪接EDB结合,从而能够选择性定位到肿瘤相关血管。L19 scFv与TNFα、IL-12或IL-2的融合蛋白被证明具有抗肿瘤作用。他们目前正处于人体临床试验的各个阶段,作为单药疗法和/或与其他免疫细胞因子和已建立的癌症疗法联合使用。
另一种肿瘤靶向策略利用了在坏死肿瘤区域发现的游离DNA片段。具体而言,与组蛋白结合的人lgG1抗体NHS76已与IL-12异源二聚体(IL-12p70)偶联,以增强肿瘤定位(NHS-IL12)。与全长抗体的融合增加了IL-12的血浆半衰期和抗肿瘤效果。
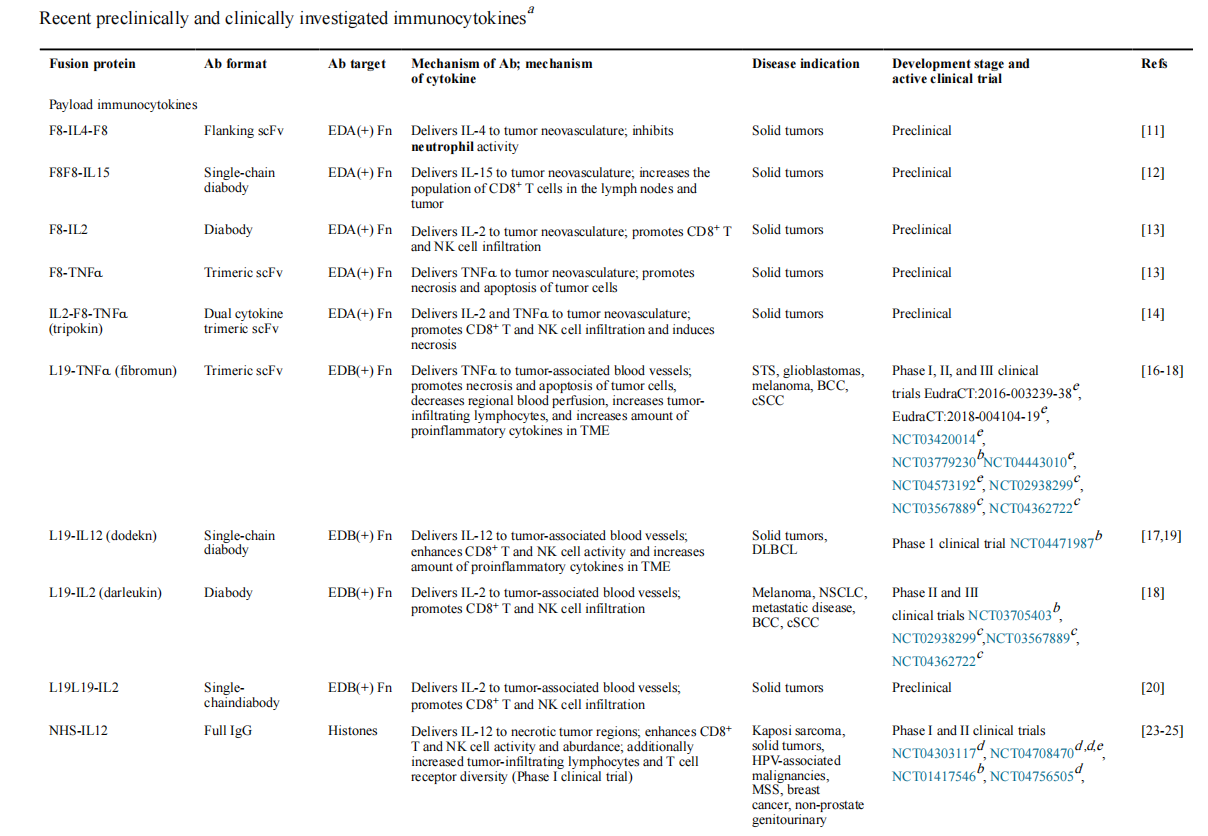
除此之外可以使用亲和力受损的细胞因子来确保由抗体靶向结构域(而不是细胞因子有效载荷)指导融合蛋白的定位。将PD-1特异性全IgG抗体与亲和力受损的IL-21变异体融合,从而将IL-21递送至表达PD-1的T细胞,同时增加IL-21的血清半衰期,并最大限度地减少对局部抗原呈递细胞的脱靶效应。由此产生的抗PD-1-IL-21免疫细胞因子在抗PD-1难治性人源化黑色素瘤小鼠模型中提供了保护作用。

慢性炎症和自身免疫性疾病中的有效免疫细胞因子
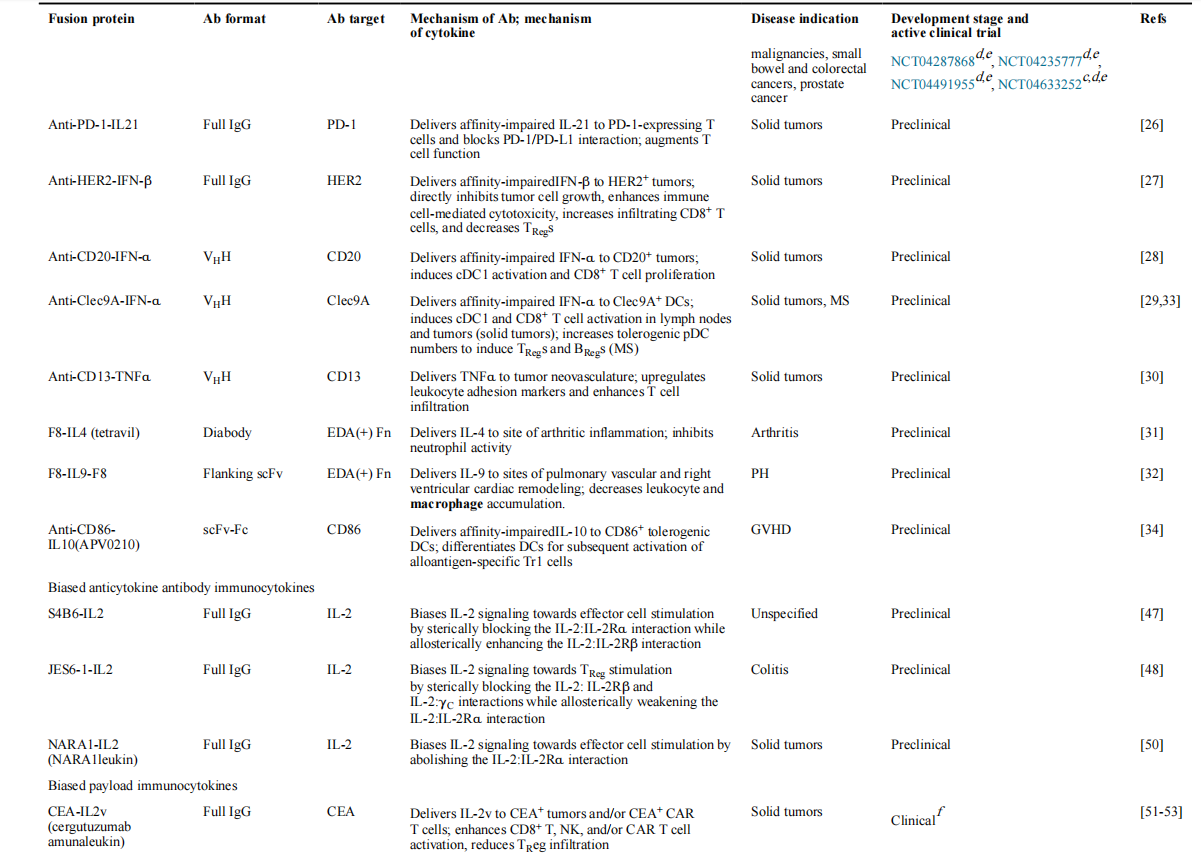
在慢性炎症和自身免疫性疾病中,靶向ECM的抗体也被用于将抗炎细胞因子活性导向炎症部位。通过结合F8、L19和其他抗体来抑制炎症的免疫细胞因子已在关节炎中显示出临床前前景。已经探索了结合IL-4、IL-9、IFN-α和IL-10的新型免疫细胞因子,用于治疗慢性炎症和自身免疫性疾病。小鼠模型中,F8-IL4与地塞米松联合使用,诱导了对胶原蛋白诱导的关节炎的完全治愈。在另外一项研究中,一种融合蛋白由融合到Fc结构域的抗CD86 scFv和受损亲和力单体IL-10组成,可诱导CD86+耐受性DC的分化,可用于治疗移植物抗宿主病(GVHD)。
信号偏向性免疫细胞因子的新兴方法
结构指导的分子工程的发展促进了有偏倚的有效载荷免疫细胞因子的设计,这些细胞因子可调节纳入的细胞因子的活性。其中IL-2是目前在免疫细胞因子发展方面研究最活跃和先进的细胞因子。
通过融合使细胞因子活性偏向抗细胞因子抗体:
IL-2的全身毒性、血清半衰期短以及对免疫刺激细胞的活化限制了其临床应用。IL-2通过与IL-2Rβ,γC链组成的异源二聚受体或者IL-2Rβ,γC,IL-2Rα组成的异源三聚受体传递信号。IL-2免疫细胞因子的设计使细胞因子活性偏向于特定的免疫细胞亚群,从而提高安全性,同时也增加了IL-2的半衰期。Boyman等首先提出的一种有前景的方法是开发抗IL-2抗体,该抗体可选择性地将IL-2活性导向效应细胞或Treg。S4B6抗体使IL-2的活性倾向于效应细胞的扩增,IL-2/S4B6复合物在小鼠体内产生了强大的抗肿瘤活性,而不会引起全身毒性。JES6-1抗体诱导TReg优先扩增,IL-2/JES6-1复合物预防小鼠糖尿病和其他自身免疫性疾病。S4B6和JES6-1都与IL-2进行了基因融合,从而产生分子内组装的免疫细胞因子,这些免疫细胞因子比各自的复合物更有效。
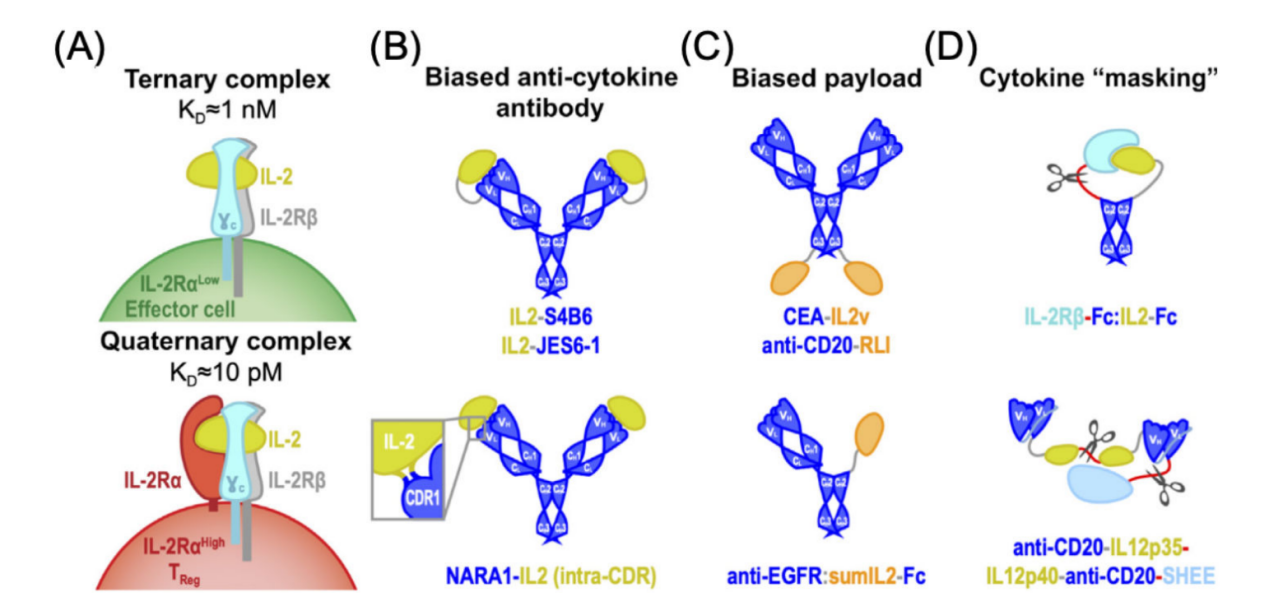
偏置载荷免疫细胞因子的设计:
有诱变偏倚的细胞因子(称为突变蛋白)可与靶向疾病抗原的抗体融合,从而产生有偏倚的有效载荷免疫细胞因子。IL-2突变体与抗癌胚抗原(CEA)抗体(CEA- IL2v)的融合抑制了肿瘤生长并提高了CEA+荷瘤小鼠的生存率。在表达CEA的乳腺癌和结肠癌小鼠模型中,CEA-IL2v还与其他抗体免疫疗法协同,以降低肿瘤负荷。另一种融合蛋白用超突变型IL-2(sumIL-2)取代了抗上皮生长因子受体(EGFR)抗体的一个Fab,后者降低了IL-2Rα的结合活性。由此产生的分子抑制了黑素瘤小鼠模型的肿瘤生长。
IL-5也可以作为偏倚的有效载荷免疫细胞因子,IL-15共享IL-2R的IL-2Rβ和γC链,同时也结合高亲和力IL-15Rα链,一种将IL-5受体连接子(RLI)与抗CD20抗体连接起来的融合蛋白延长了淋巴瘤小鼠模型的生存期,同时也显著延长了循环半衰期。
通过“掩蔽”方法对细胞因子信号传导进行偏倚:
效应细胞偏向的IL-2变体和IL-2Rβ胞外结构域(ECD)分别融合到Fc结构域,这样IL-2Rβ链结合并“掩盖”融合的IL-2,后者通过可裂解的连接子连接到各自的Fc结构域。在肿瘤相关基质金属蛋白酶存在的情况下,隐蔽的IL-2有效载荷被选择性地释放,使得该分子表现出优于IL-2的疗效,以及与检查点阻断疗法的强大协同作用。
创新抗体融合蛋白策略
涉及非细胞因子载荷的抗体融合正在不断开发中,例如重组免疫毒素(RIT)、抗体导向的酶前体药物治疗(ADEPT)、靶向酶替代融合蛋白、神经保护载荷融合蛋白和可溶性因子陷阱融合蛋白。
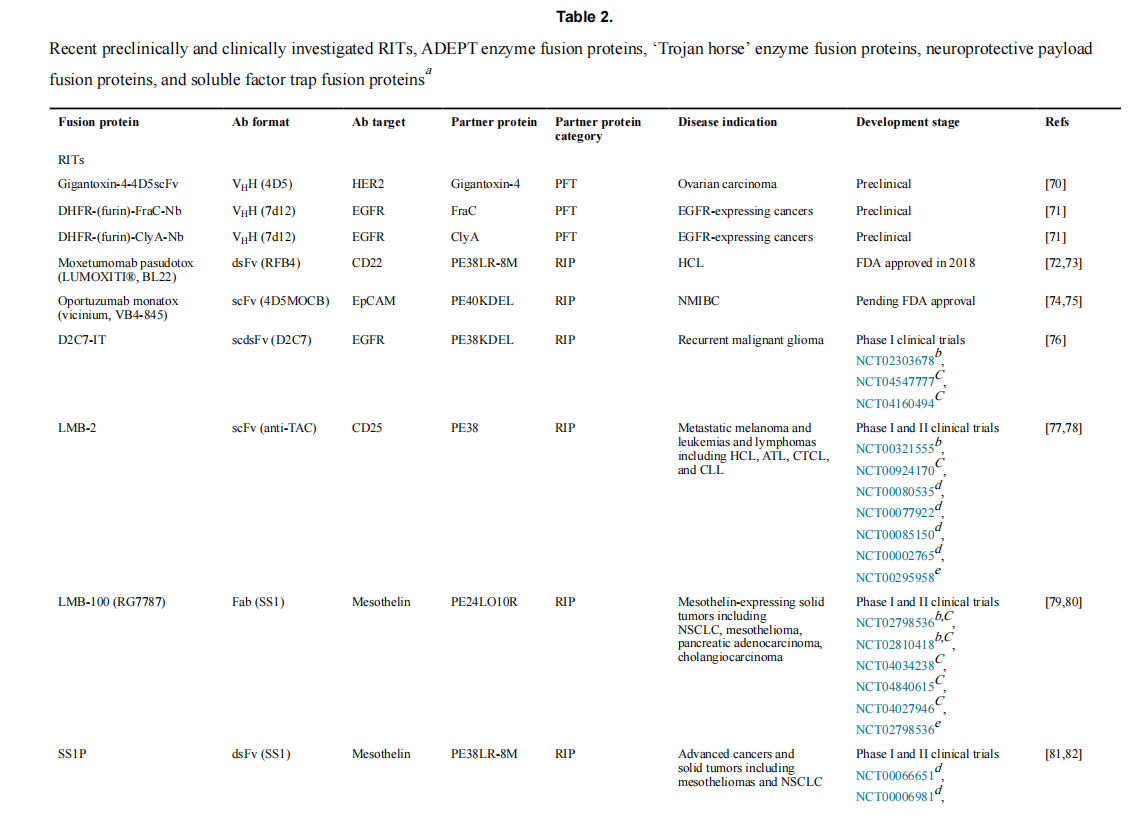
重组免疫毒素(RITs)
重组免疫毒素是将抗体片段和毒基团融合而成的,RITs主要用作癌症治疗手段,可以分为孔形成毒素(PFTs);核糖体失活蛋白(RIPs);以及微管破坏蛋白(MDPs),它们可以阻止有丝分裂和囊泡运输,从而引发凋亡。

RIPs是用于RIT的最多样化和最发达的毒素类别,而MDPs是最少的。这两个类别都需要RIT的抗体部分来促进内吞作用以实现细胞杀伤。而大多数PFTs直接整合到细胞膜中,因此不需要抗体介导的内吞作用来发挥细胞溶解功能。PFTs在细胞膜中的整合通常对某些肿瘤细胞合成的脂质过量敏感,这限制了毒性仅针对那些靶细胞。
目前处于临床试验或已获FDA批准的RITs使用了三种细菌源毒素中的一种,均为RIPs。PE已被广泛修饰用于RITs,以增加细胞毒性,降低免疫原性,并增加蛋白酶降解的抗性
RITs面临的主要挑战之一是许多患者会对有毒基团产生抗药抗体,这可能会加速清除和/或中和有毒基团,极大地阻碍治疗效果。免疫毒素的大小限制了其在肿瘤学中的临床应用,仅用于治疗血液系统癌症,因为大多数RITs无法充分穿透实体肿瘤。此外,RITs的低效胞质递送需要具有非凡效能的细胞毒性载荷。
目前的免疫毒素主要集中在外源毒素上,但最近已经在临床阶段开发了内源性RIP毒素,如颗粒酶B和颗粒酶素,因为它们没有免疫原性。另一种RIT方法靶向肿瘤的改良超抗原(SAg)和其他免疫毒素不一样,它在naptumomab estafenatox中使用的修饰葡萄球菌肠毒素A等SAg招募并激活T细胞以杀死靶细胞。

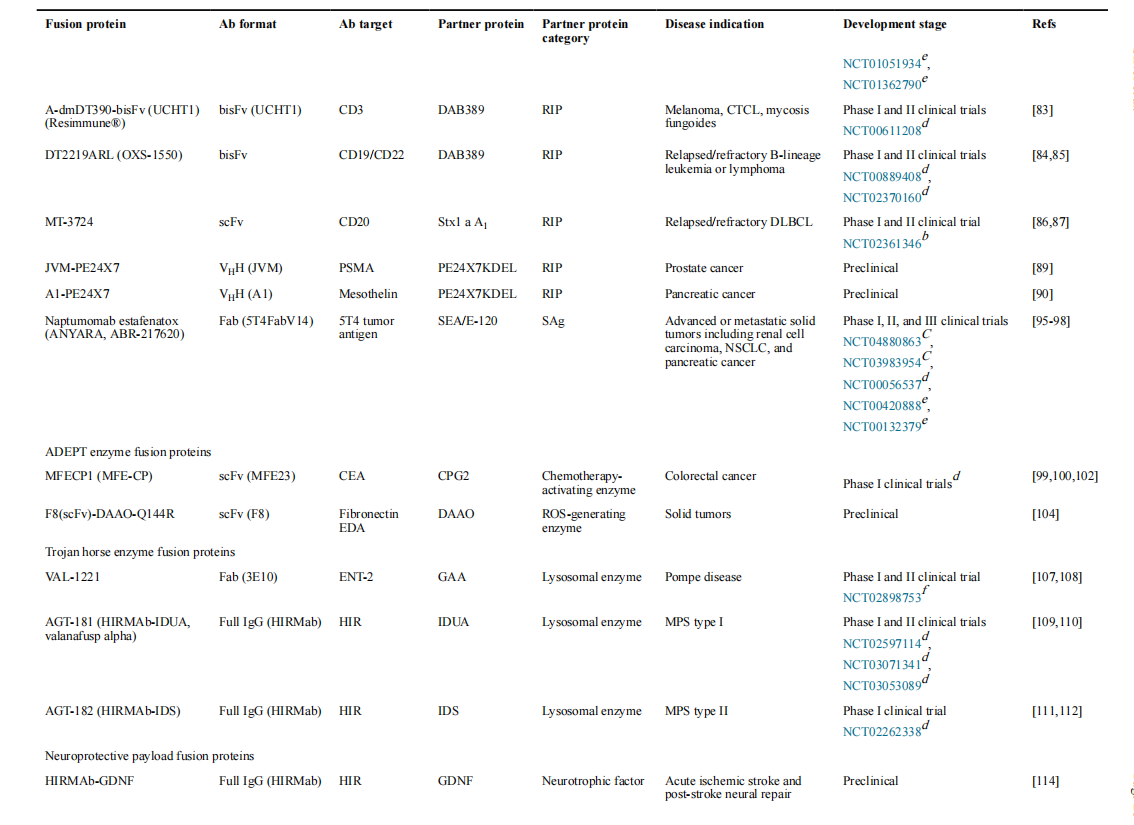
抗体-酶融合蛋白和其他新兴的治疗方法
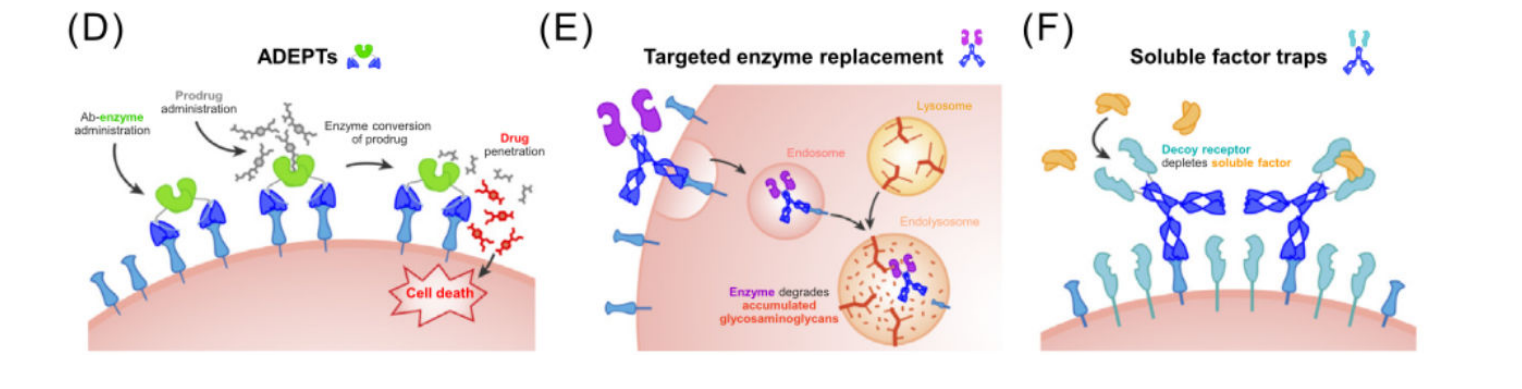
抗体导向的酶前体药物疗法(ADEPT)是连续施用靶向癌症的抗体-酶融合蛋白和酶激活的前药的一种策略。与大多数RITs不同,ADEPT融合蛋白中的抗体不应该触发受体介导的内吞作用,因为酶必须留在细胞外才能接触到前体药物。由CEA特异性抗体片段和细菌羧肽酶G2(CPG2)组成的融合蛋白MFECP1在早期临床试验中显示出良好的安全性,并局限于患者肿瘤,但受到免疫原性的限制。
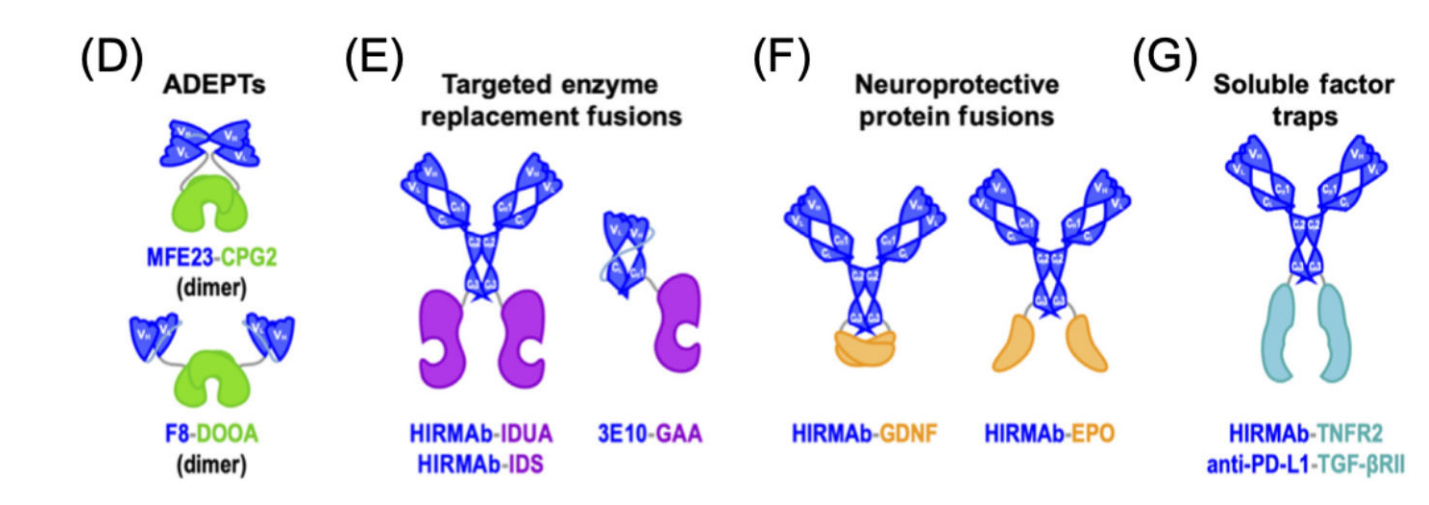
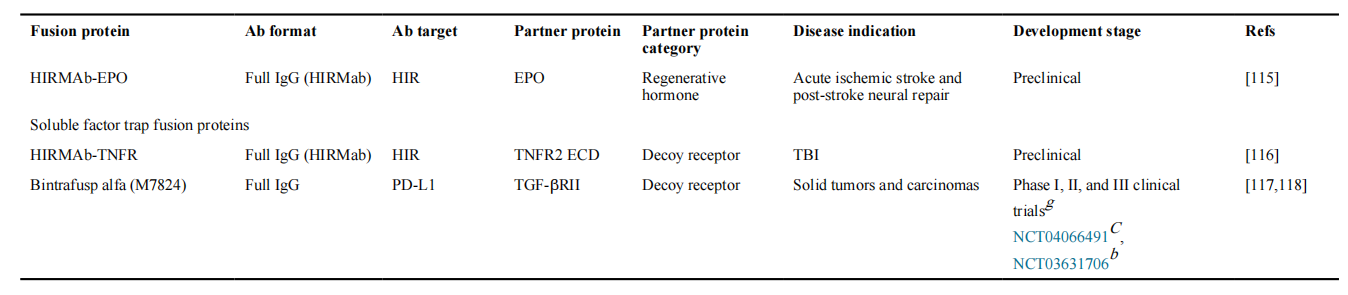
用于靶向酶替代疗法的抗体-酶融合蛋白代表了另一类已进入临床试验的分子。这些融合蛋白中的抗体有助于将酶载荷运输到溶酶体,从而取代突变酶的功能。HIRMAb-酶融合蛋白除了通过人类胰岛素受体(HIR)促进内吞作用外,还促进了血脑屏障的跨膜运输。HIRMAb融合蛋白也被扩展用于递送非酶制剂。例如,与神经保护载荷(如胶质细胞源性神经营养因子(GDNF)和促红细胞生成素(EPO))融合的HIRMAb已显示出作为急性缺血性卒中和创伤性脑损伤的潜在治疗的临床前前景。
总结
抗体融合蛋白在抗体药物发展具有重要作用,目前已经开发出了不同的格式类型,这些抗体融合蛋白整合了细胞因子、酶、毒素、神经保护剂和可溶性因子陷阱载荷。将载荷针对性地靶向特定细胞或组织的抗体可以显著提高载荷的效力,允许使用较低剂量并防止不良副作用。这些融合蛋白具有多功能性,可以应对广泛多样的疾病适应症。尽管面临免疫原性、递送和肿瘤渗透等挑战,抗体融合蛋白的开发前景广阔,预计将为多种疾病的治疗提供新的策略和方法。抗体融合蛋白的开发肯定会受益于并推进合并其他免疫治疗模式的联合治疗方法。