背景
肿瘤学中的抗体具有毒性物质和效应功能,可以在非常低的浓度下杀死细胞。一个关键的挑战是,癌细胞上的大多数靶点至少也存在于一些健康细胞上。共享靶点可导致肿瘤外结合,并危及候选治疗药物的安全性和潜力。针对癌症的治疗性抗体通常需要选择性的杀死癌细胞,同时保护健康组织。最初选择的是单克隆抗体,但是它会产生耐药性,后续也产生了许多新一代的抗体,例如抗体药物偶联物(ADC),双特异性抗体。但是由于ADC和双特异性抗体具有剂量限制性毒性,可能限制到达肿瘤的生物制剂数量及其治疗获益。提高对肿瘤的选择性对于使用这些高效治疗性抗体安全有效地治疗癌症以及促进其在联合治疗中的应用至关重要。

2024年11月27日,Vincent Blay在 Trends Pharmacol Sci上发表了一篇名为“Strategies to boost antibody selectivity in oncology”的文章,这篇综述探讨了有助于将生物制剂更有选择性地导向癌症部位的策略。由于分子设计和工程技术的进步,这些策略变得越来越可行。他们的目标是创造出利用癌症变化和利用人体基础设施的治疗方法,使治疗方法不仅能够区分自我和非自我,而且能够区分患病组织和健康组织。

选择性可以使肿瘤治疗中产生更安全、更有效的抗体
随着癌症生物学、分子工程和人工智能(AI)的最新进展,现在也出现了许多创新的方式去提高抗体的选择性。例如,利用癌细胞特点,肿瘤微环境(TME)的独特特征,以及外部干预的方式。其中外部干预可以选择性地增加肿瘤内的活性药物浓度或降低肿瘤外的药物浓度。
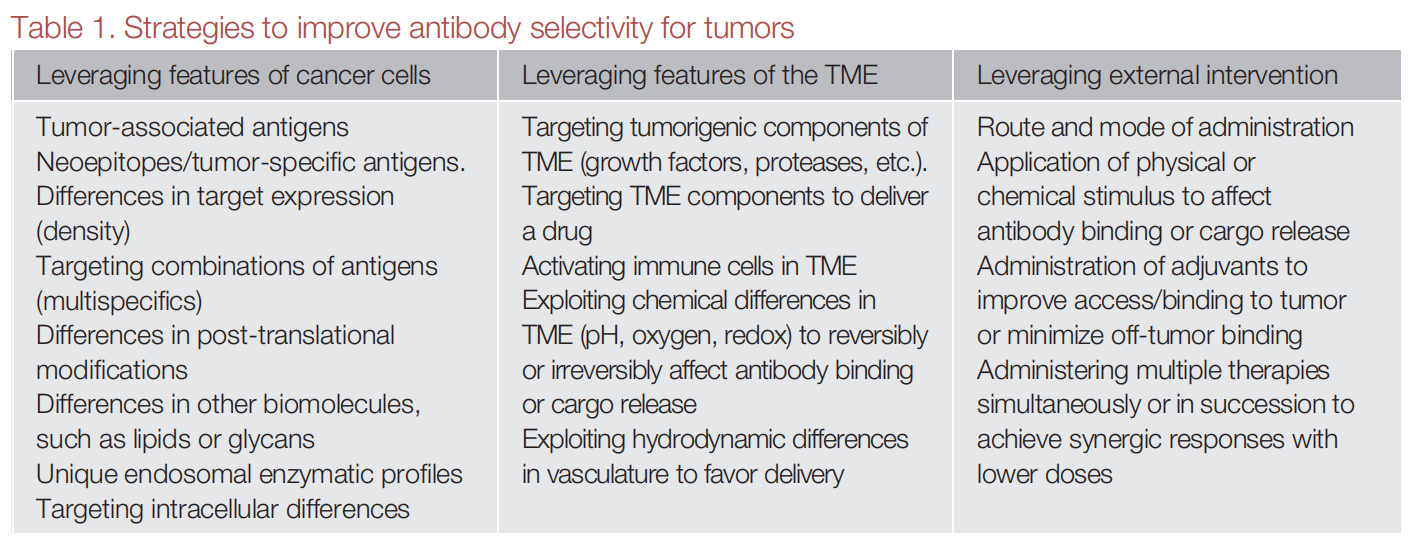
利用癌细胞特征的策略
根据癌细胞特征提高抗体选择性的策略主要包括选择性的针对肿瘤特异性抗原(TSA)以及肿瘤相关抗原(TAAs)。在健康成人细胞中沉默的基因,或含有由遗传改变(新抗原)引起的蛋白质变异,这些变异构成肿瘤特性抗原(TSA),TSA通常在细胞内,常规生物制剂通常不能被动地穿过脂质双分子层(包括细胞膜)与TSA结合。
利用组织相容性复合物(MHC):靶向细胞内TSA的一种选择是利用它们在细胞表面的主要组织相容性抗原复全体(MHC)上的呈现,治疗性抗体可以模拟T细胞受体(TCR)并与特异性肽- MHC复合物结合。以这种方式开发TSA需要确定将特定构象表位作为靶点(多肽- MHC)的生物制剂,包括确保特异性和安全性的足够背景。
细胞内表达生物制剂:通常使用单链抗体片段(scFv);核酸被递送至细胞,然后在细胞内表达生物蛋白并与细胞内靶点结合,因此也可将其视为一种基因疗法。
生物制剂递送到细胞内:生物的跨膜能力可以通过不同的方式实现,包括包封、掺入某些肽基序、与穿透细胞的肽(CPPs)或其他载体结合,或控制膜不稳定剂的释放。还可以利用细胞内循环的受体的结合,从而更好地暴露于细胞内靶点。
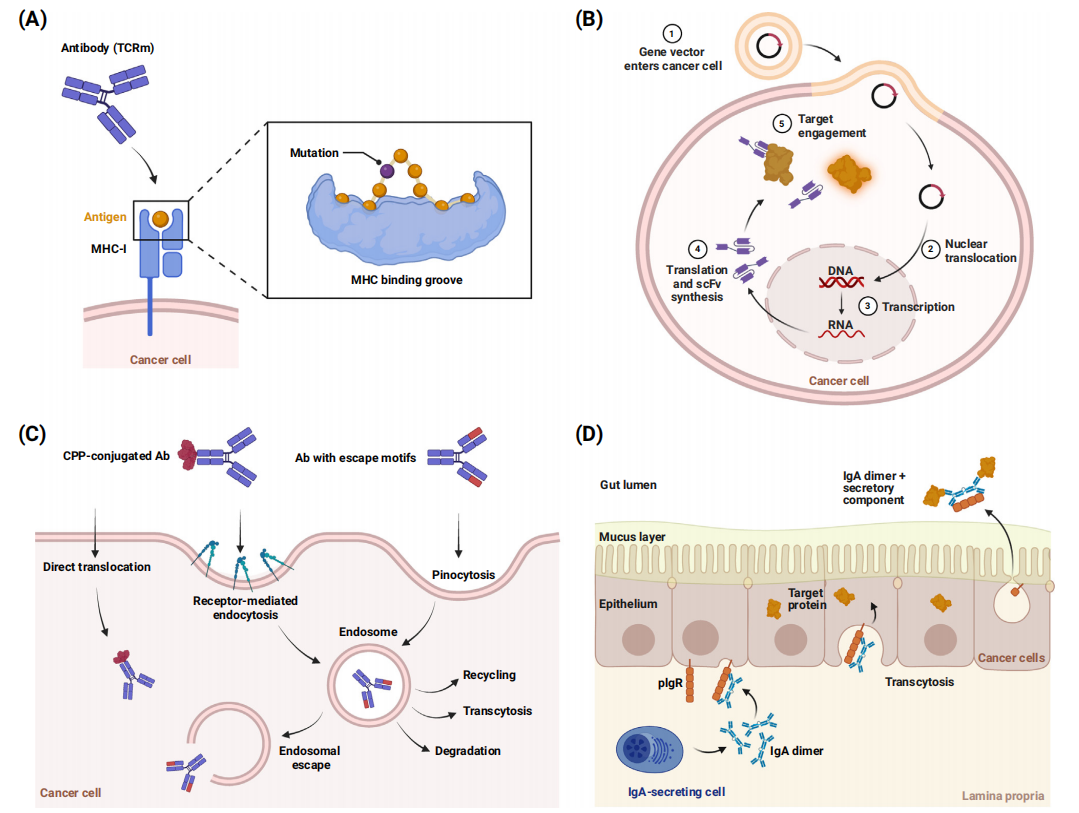
靶向肿瘤相关抗原(TAAs)
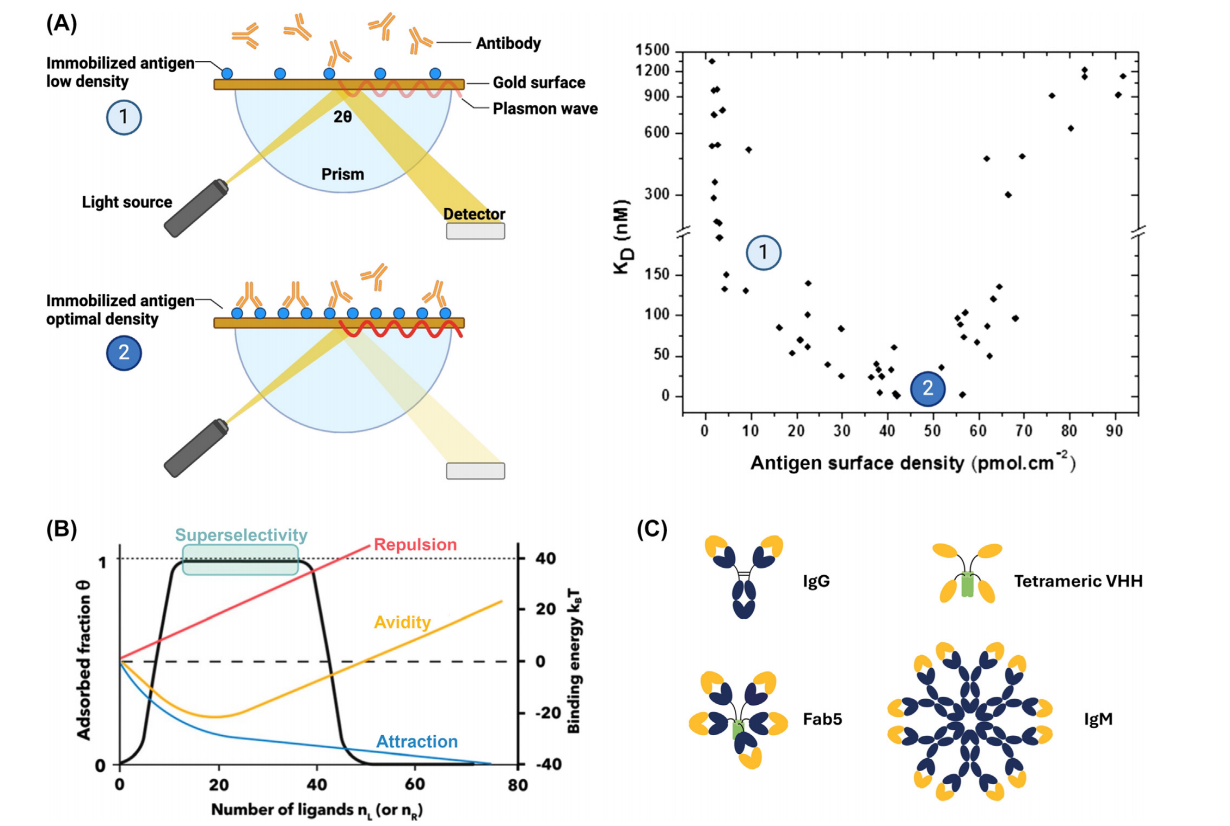
一般在肿瘤中富集的抗原也存在健康细胞中,这种抗原称为肿瘤相关抗原(TAAs),在提高对肿瘤细胞的选择性还需要利用其他特征,例如靶密度的差异或多个靶点共表达。多效价提供了一种利用靶密度差异并提高对富集在癌细胞上的单个TAA的结合选择性的方法。具有多个足够亲和力的结合位点可以使药物优先集中于表面抗原密度高的细胞,这种现象被称为“超选择性”。多价也可以引入抗体的恒定区,这可能允许调节其效应功能和药代动力学。
生物制剂对肿瘤细胞的选择性也可以通过靶向同一肿瘤细胞上的多个TAA的多特异性抗体来提高,顺式联合靶向多个抗原可以缩小生物聚集的位置,靶向多个细胞通路也可产生更强效的抗肿瘤反应。
最大化生物与靶点的结合亲和力并不总是最好的策略。如果抗体与健康细胞上少量存在的TAA强结合或增加毒性,则过度的结合亲和力可能导致体内性能较差。过高的结合亲和力还可能增加抗体的内化率,减少其从晚期核内体的再循环,加速其分解代谢,限制其半衰期和肿瘤穿透。高亲和力的另一个潜在问题与细胞内信号传导有关:与更弱、更短暂的相互作用相比,紧密结合可能减少受体聚集和信号传导。对T细胞衔接器的研究确定了在中间结合亲和力时的最佳效力和选择性。
利用肿瘤微环境的特征策略
TME标记物可作为选择性抗体的合适靶点
TME的标志是免疫细胞的存在,抗体可以减少TME中免疫抑制或加强免疫激活,例如,针对CLTA-4和PD-1/PD-L1的免疫检查点抑制剂可以重新激活一些效应细胞。
TME的另一个标志是存在癌症相关成纤维细胞(CAFs)。CAFs是TME的主要组成部分,在肿瘤的免疫调节和侵袭性中发挥关键作用。
异常血管化也常是实体瘤的标志。肿瘤部位具有高代谢需求,可以通过新生血管生成和血管生成来进化招募新生血管。因此,干扰患者的血管形成可优先影响肿瘤生长。
坏死龛是晚期实体瘤的另一个特征性标志。晚期实体瘤核心区可能存在营养物质、氧气和废物交换不良,导致细胞坏死。抗体可以针对坏死时暴露的分子设计,这种方法被称为肿瘤坏死疗法(TNT)。TNT不能与活细胞结合,它需要递送一种远距离扩散或杀伤的药物,如放射性核素、免疫调节剂和释放的化疗药物。
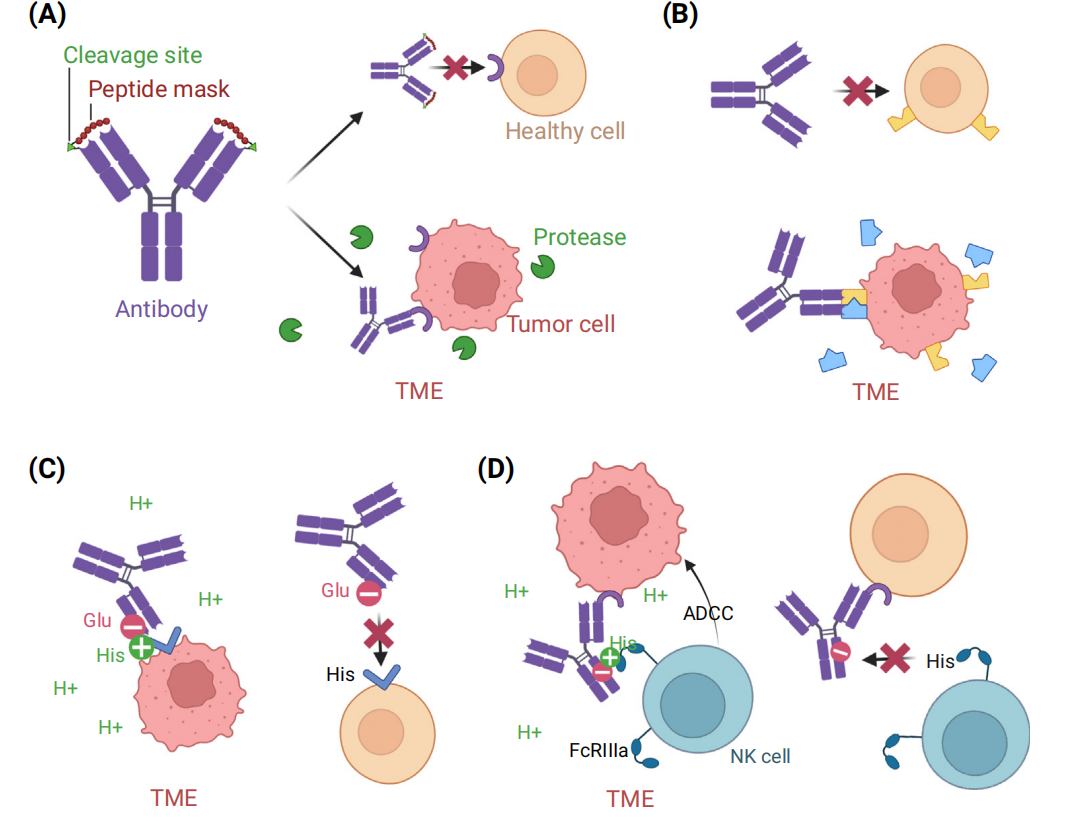
生物制剂可通过工程改造选择性地激活TME
选择性激活可以通过生物制剂与TME中丰富的分子发生反应,从而触发药物的局部释放或选择性揭开抗体CDRs来实现。
可对抗体进行优化以在特定pH下操作以提高其选择性。pH敏感的结合可以被引入Fc区域,从而有利于效应细胞募集到通常为酸性的TME,或者通过基于FcRn的抗体循环增加抗体半衰期。具有pH敏感结合的CDR也可以在肿瘤学中增加价值。
抗体也可被设计成依赖于TME的其他特征分子的存在,例如,在某些肿瘤中,TME中的细胞外ATP浓度显著增加。Chugai的研究人员巧妙地利用这种增加来识别需要ATP与CTLA-4和CD137结合的CDR。在这些情况下,ATP有效地充当了分子胶水,补充了抗原和CDR之间的界面。
设计选择性抗体的新策略
一般抗体工程传统上集中在抗体骨架上,现在出现了越来越多在蛋白质科学,结构生物学和人工智能方面的进展,可以通过优化多种属性来更好的区分肿瘤上的靶点和健康细胞上的靶点。
通过改造二硫键和非共价相互作用,可以改变IgG几何构象,抗体的非CDR区域可以通过工程改造来改善结合,包括抗体可变区中的第4环(DE环)和其他框架区域,这些区域可以影响蛋白质的折叠稳定性和CDR的刚性。
使用IgG抗体以外的生物制剂可能有助于克服实体瘤的穿透挑战,例如纳米抗体。结合不同免疫调节分子的结构域也有可能产生新的设计,如含Fc的抗体、抗体片段或Fc融合蛋白。来自不同来源的非抗体替代支架已被提出作为创建选择性生物制剂的平台。随着我们对分子设计原理理解的提高,我们将能够通过从头设计蛋白来创建更多样化的粘合剂和支架。

总结与展望
肿瘤学中的抗体治疗具有很高的细胞毒性潜能,则需要抗体有更好的选择性,利用肿瘤的独特特性和肿瘤微环境的分子工程学策略可以促进抗体的选择性。超选择性、双靶向、条件结合、逆靶向和分子组合等策略有助于提高生物制剂对肿瘤细胞的选择性。目前有的抗体在疾病治疗方面还受到一些限制,因此我们可以创造出性质显著优越的分子,包括一些新的性质,如穿透膜、局限于生理或细胞区室、避免不依赖靶点的摄取、反应性或在感兴趣位点的条件结合。在未来,人工智能还可以帮助设计具有越来越复杂行为的纳米设备和基于细胞的疗法,从而可以智能地移除癌细胞。
