背景
间日疟容易传播,且在肝脏中休眠,反复复发会增加临床负担,因此需要新的治疗方法来预防间日疟。抑制肝细胞和红细胞侵袭的靶向治疗对于减轻总体疾病负担和消除疟原虫(Pv)至关重要。子孢子和裂殖子使用的侵袭机制的一个重要部分是顶膜抗原1(AMA1)与冲绳颈蛋白2(RON2)C端部分的细胞外β发夹环之间的相互作用。通过抗体或肽阻断PfAMA1或PkAMA1与PfRON2或PkRON2的相互作用可抑制入侵,证实 AMA1-RON2的相互作用对于疟原虫生命周期很重要。利用针对子孢子抗原的人类单克隆抗体可能是预防疟疾感染和相关疾病的一种有前途的方法。
2024年12月4日,Nature Communications上发表了一篇名为“Potent AMA1-specific human monoclonal antibody against Plasmodium vivax Pre-erythrocytic and Blood Stages”的文章,该研究从Pv暴露个体的外周血单个核细胞中鉴定了12个Pv顶端膜抗原1(PvAMA1)特异性人单克隆抗体。它们已被证明可以阻止PvAMA1与PvRON2结合。PvAMA1是子孢子和裂殖子侵袭所必需的,使其成为一个独特的治疗靶点。研究发现了最有效的humAb(称为826827)在嵌合FRG-humHep小鼠模型中阻止Pv感染的效果,它可以阻止RON2环结合,并在体外多个临床分离株和体内持续预防血液阶段和子孢子感染。

单克隆抗体的分离和表达
研究人员从Pv暴露个体的外周血液中分离出12种人类PvAMA1特异性单克隆抗体,选择用于生成humAb的克隆是基于是否存在相应的免疫球蛋白轻链(IGL)、序列质量、体细胞超突变(SHM)程度以及从B细胞中选择一个IGH+IGL对。将12种抗体以多重免疫分析的方式测试了与重组AMA1的结合能力。humAbs 806807、826827、832833、838839亲和力最高。值得注意的是humAb 826827对PkAMA1的亲和力高于PvAMA1。使用SPR测定了humAbs对PvAMA1的亲和力范围为10.7×10-9 ~ 47.7×10-9M。
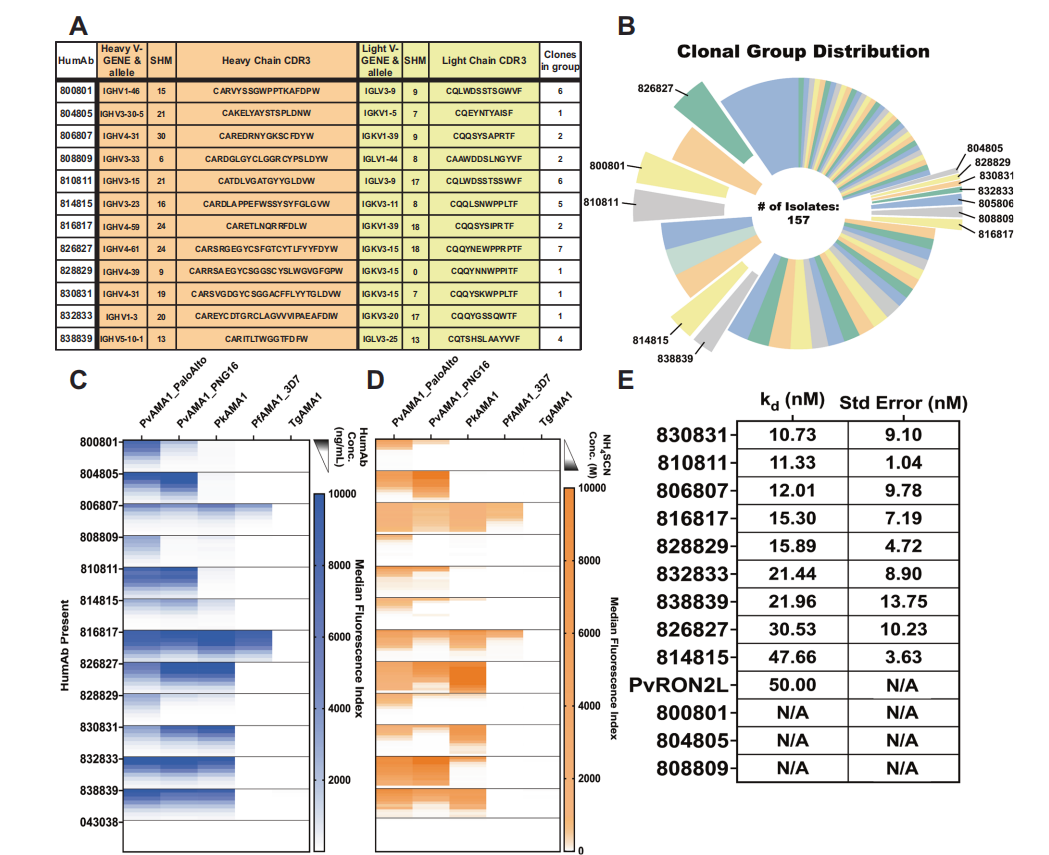
HumAb抑制血期感染
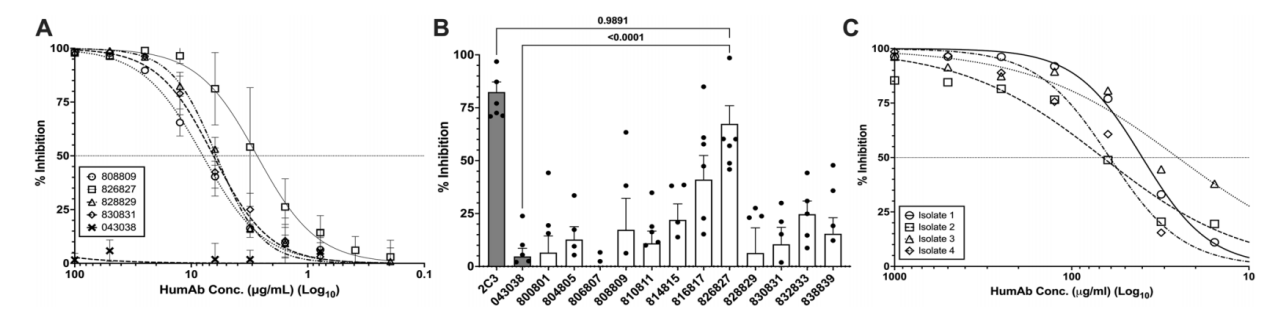
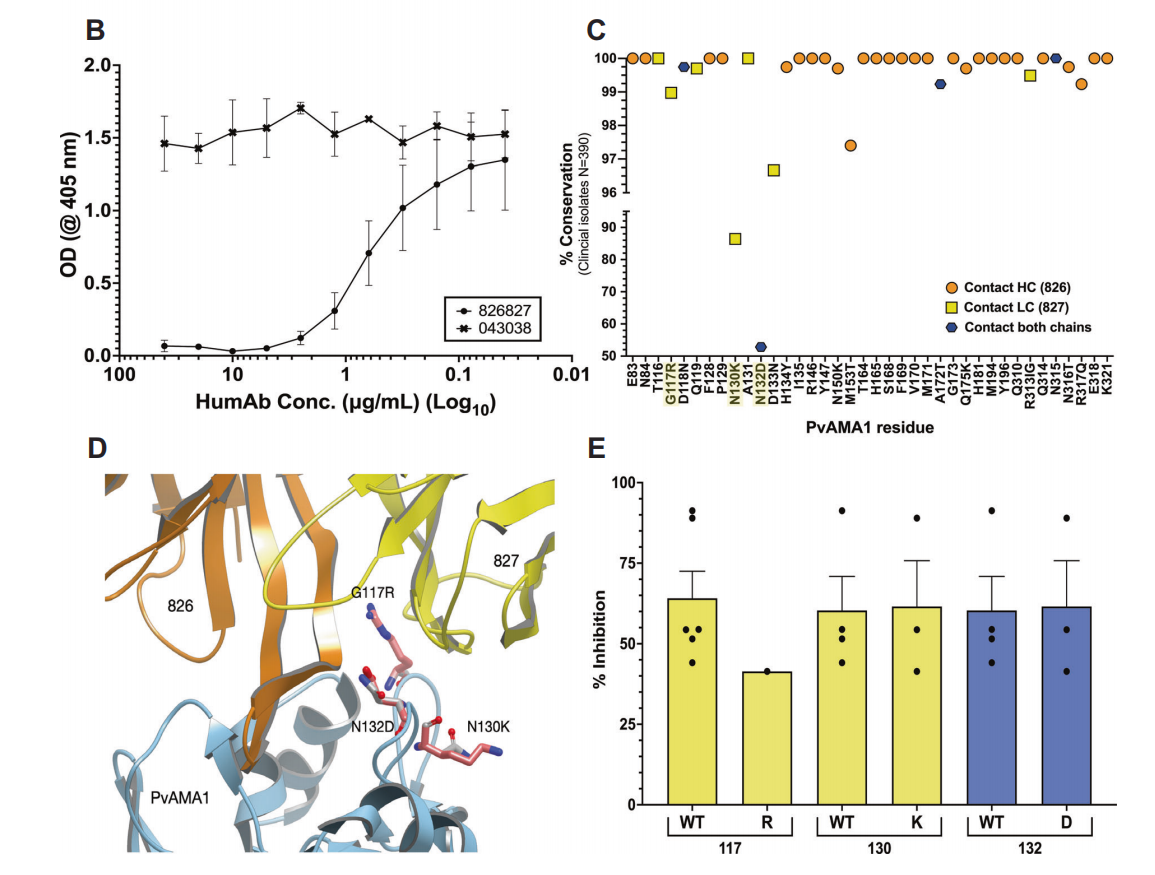
使用可表达PvAMA1的改良Pf寄生虫系作为模型,评估humAbs抑制裂殖子侵袭的能力。通过评估四种人源单克隆抗体808809、826827、828829和830831的IC50曲线,发现抗体826827的抑制率最高,IC50为2.6µg/ml。
与对照humAb 043038相比,仅humAb 826827显著抑制Pv对网织红细胞的侵袭。使用浓度为7.8 ~ 1000µg/mL的humAb 826827对另外4个Pv临床分离株进行了剂量-反应侵袭试验,以确定其IC50。从4株临床分离株中获得的平均IC50为48µg/mL(±6.6 SEM)。这些结果和体外Pf-PvAMA1转基因寄生虫实验表明,人826827在抑制AMA1依赖性红细胞侵袭方面非常有效。
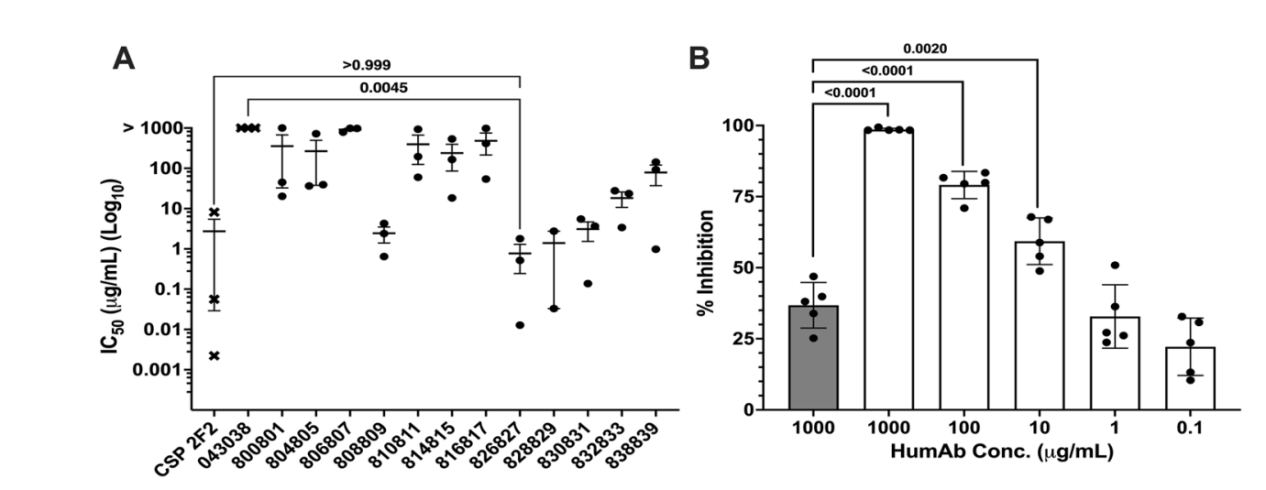
HumAb对人肝细胞内Pv子孢子的抑制作用
humAb 826827在体外实验中显示出对人类肝细胞的孢子体入侵具有抑制作用,IC50值为3.7 µg/mL。
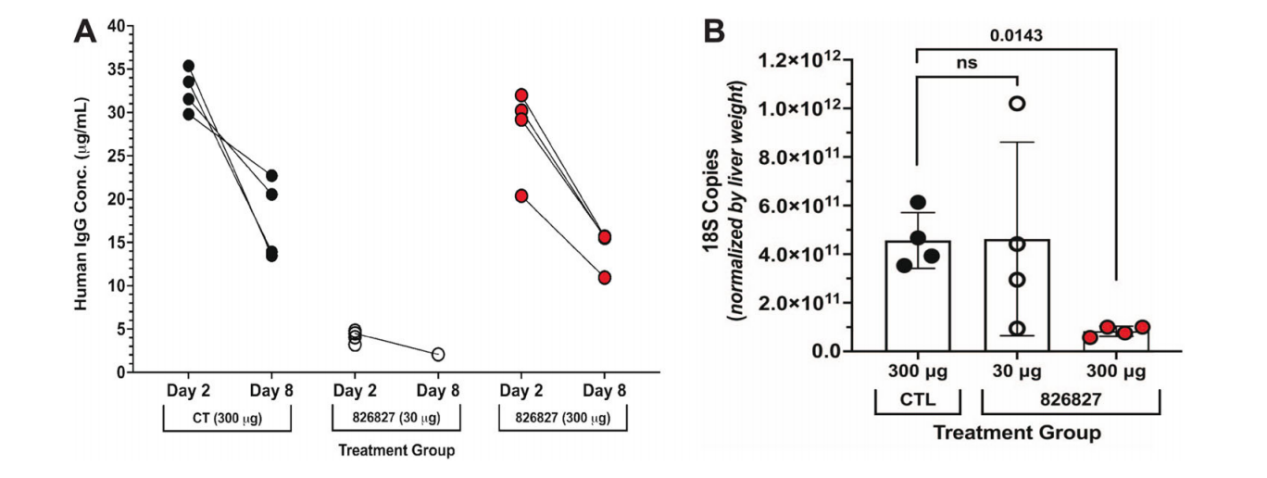
使用肝嵌合小鼠模型(FRG-humHep)进行体内实验验证,与对照humAb相比,通过18S定量RT qPCR评估,接受300μg humAb 826827给药的小鼠的肝期寄生虫显著减少。humAb 826827显著减少了体内肝细胞的子殖子侵袭。
humAb 826827与PvAMA1相互作用的结构研究
humAb 826827主要与PvAMA1的Domain 1和Domain 2的移动环部分相互作用,这些区域对于PvAMA1的功能至关重要。六个互补决定区中的五个(CDR,即:L1、L2、H1、H2和H3)与PvAMA1形成直接接触,CDR-H3 环贡献了70%的埋藏表面积。CDR-H3环形成了一个二硫键桥接的β-发夹结构,占据了PvAMA1 Domain 1的疏水沟槽,这是RON2环肽的结合位点。humAb 826827通过CDR-H3和CDR-H1与PvAMA1的Domain 2环相互作用,形成一个盐桥和多个氢键,从而稳定该环在Domain 1上的位置。humAb 826827的结合阻止了Domain 2环的位移,这是RON2与AMA1相互作用所必需的,因此humAb 826827有效地阻断了这一关键的寄生虫入侵步骤。


PvAMA1和RON2环之间的接触残基与接触humAb 826827 CDR-H3残基的PvAMA1的接触残基重叠。接触残基的序列和结构分析表明,humAb 826827的表位对PkAMA1和PcAMA1高度保守。

humAb 826827能够与PvRON2竞争PvAMA1上的相同表位,证实了其抑制机制。尽管PvAMA1存在多态性,但humAb 826827的表位在多个临床分离株中高度保守,表明humAb 826827对不同Pv株具有广泛的抑制潜力。
总结
该研究发现了一个高度保守的PvAMA1表位,可被humAb 826827靶向,在体外和体内防止AMA1依赖的子孢子侵入肝细胞和裂子孢子侵入网织红细胞。HumAb 826827可能会促使未来开发出对抗Pv感染、疾病和传播的新疗法。此外,确定了HumAb 826827有效靶向的PvAMA1保守抑制性表位,可指导基于结构的Pv疫苗设计。未来在非人灵长类动物模型中开展的研究可能获得有价值的数据,支持将humAb 826827开发为治疗或预防药物。
