背景
近年来,随着CLDN18.2(Claudin18.2)在胃癌和胰腺癌中的研究进展,CLDN18.2有望成为胃癌和胰腺癌的治疗靶点。CLDN18.2是一种紧密连接蛋白,选择性地在癌细胞中表达,而在正常组织中很少表达,这使其成为有吸引力的靶向治疗候选药物。单克隆抗体(如Zolbetuximab)、双特异性抗体和抗体-药物偶联物等疗法在改善临床结局方面显示出巨大潜力。早期临床试验显示了强大的抗肿瘤活性,特别是与化疗和免疫治疗方案的联合应用。然而,患者选择、耐药机制和毒性管理等挑战仍然至关重要。
2024年12月1日,Alireza Tojjari团队在Cancer Lett上发表了一篇名为“Emerging targets in gastric and pancreatic cancer: Focus on CLDN18.2”的文章,该文章就CLDN18.2在胃癌和胰腺癌治疗中的应用现状、临床进展及未来发展方向进行综述。

CLDN18.2的表达和功能
CLDN18.2蛋白是 Claudin家族蛋白,它只在胃上皮细胞的分化和干细胞中表达,它在各种原发性恶性肿瘤的发生和发展中异常过表达。研究发现,PMA,c-jun、表皮生长因子(EGF)和RAS可以上调CLDN18的表达,IL-1β、STE20/SPS1,SPAK可以抑制CLDN18表达。
在正常组织中,CLDN18.2作为紧密连接蛋白的一部分,其主要功能是维持胃上皮细胞间的屏障完整性和选择性通透性。组织粘附复合物的屏蔽作用保护CLDN18.2不被外界因素如消化酶等破坏,确保胃黏膜的正常功能。在恶性转化时,细胞粘附被破坏,并且CLDN18.2表位暴露在胃和GEJ(G/GEJ)腺癌细胞表面,使其成为一个有前途的靶点。CLDN18.2在约70%的胃癌和60%的胰腺癌中表达,使其称为治疗干预的有吸引力靶点。

(数据来源 Nakayama I, et al. Nat Rev Clin Oncol. 2024)
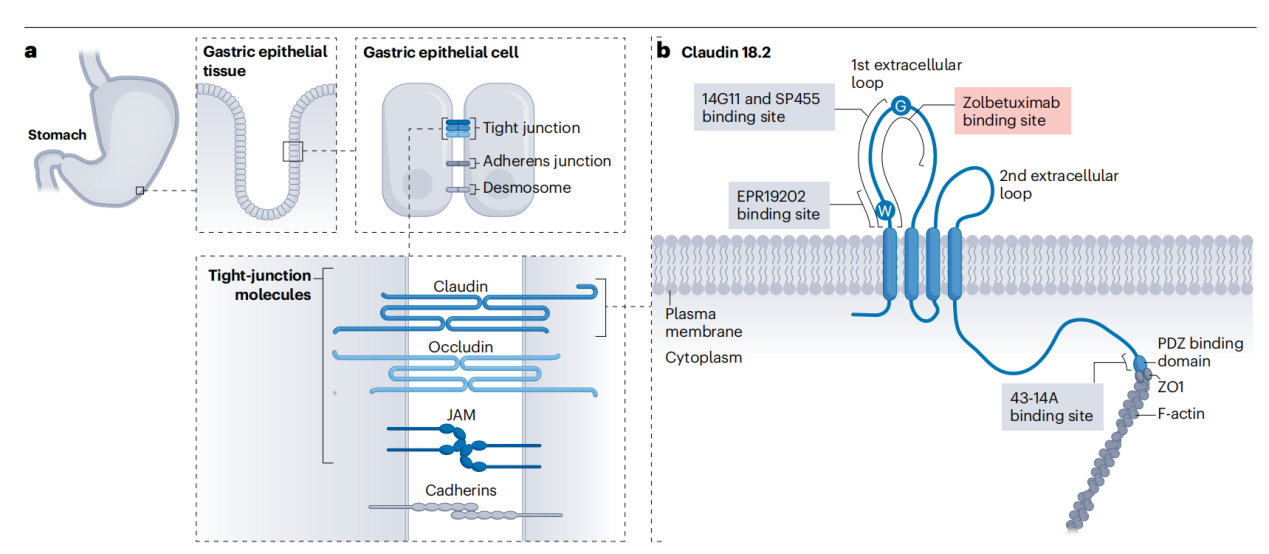
CLDN18.2的结构
CLDN18.2是一种编码长度为264个氨基酸的细胞表面蛋白,分子量约为27 kDa。它包括N端的一个短胞质段,由四个跨膜结构域形成的两个细胞外环和C端的胞质尾部。其中较大的细胞外环在调节离子跨细胞运动中发挥作用。较小的细胞外环与邻近细胞表面表达的CLDN18.2分子结合,形成选择性通透性屏障,使组织特异性通透性成为可能,从而支持胃上皮细胞的极性。
(数据来源 Nakayama I, et al. Nat Rev Clin Oncol. 2024)
CLDN18.2的靶向治疗
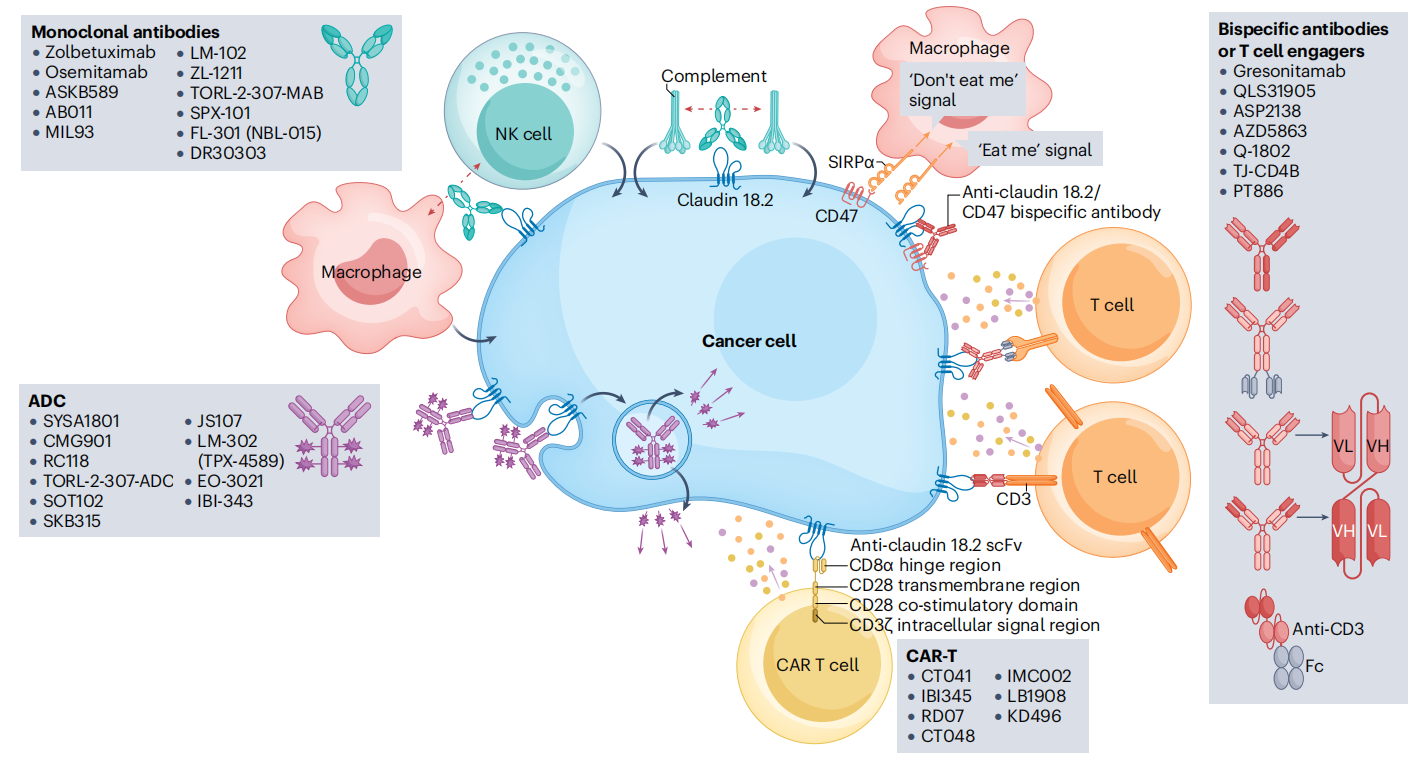
CLDN18.2因其在胃癌细胞中选择性表达,在正常组织中表达较少,使其称为靶向治疗的理想靶点,靶向治疗的主要方法有单克隆抗体,抗体药物偶联物,嵌合抗原受体(CAR)T细胞疗法,双特异性抗体,他们的机制各有不同。

单克隆抗体
靶向CLDN18.2的单克隆抗体(CLDN18.2)代表着胃癌和胰腺癌治疗的重大突破。在这些疗法中,Zolbetuximab仍然是临床上最先进的疗法,此外还有AB011、MIL93和Osemitamab等。
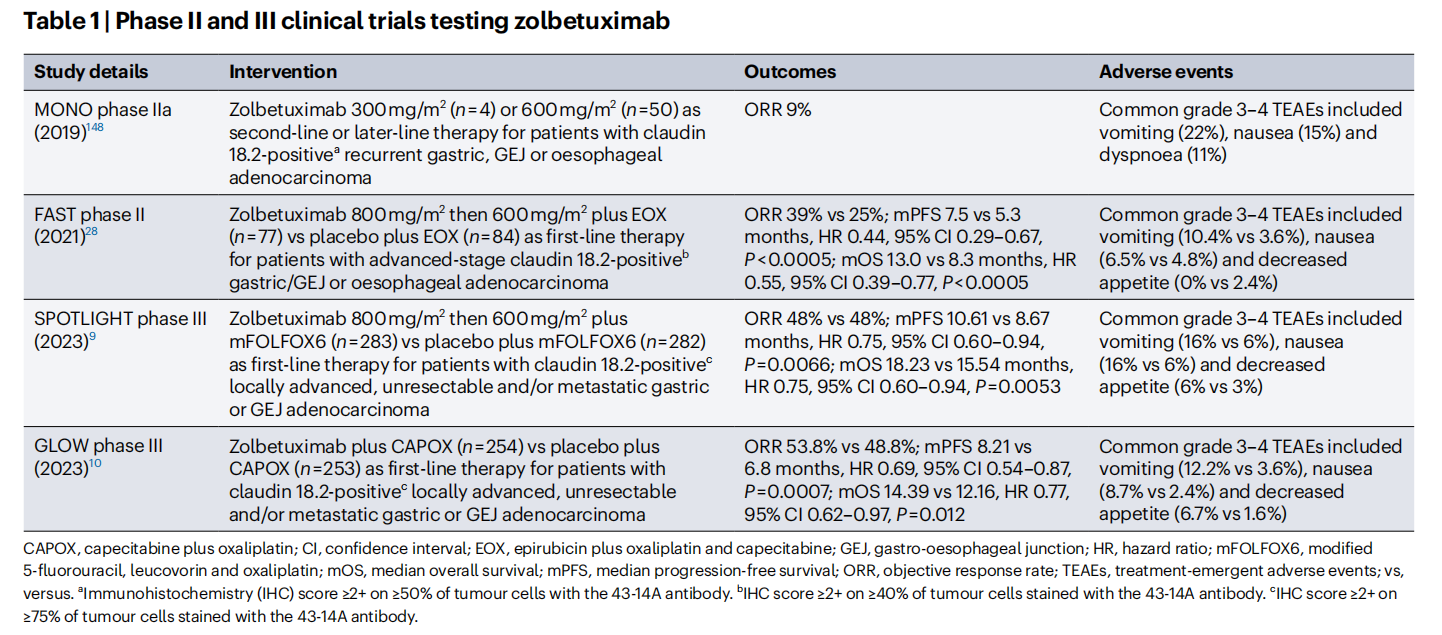
Zolbetuximab(IMAB362)是一种靶向CLDN18.2的嵌合单克隆抗体,在SPOTLIGHT试验中已证明其可延长无进展生存期(PFS)和总生存期(OS)。然而,它的一个显著局限性是在客观缓解率(ORR)方面缺乏改善,这提示其主要益处在于稳定疾病,而不是诱导肿瘤缩小。ORR改善不足的原因可能是某些肿瘤的免疫浸润较低,以及调节性T细胞(Tregs)和TGF-β等细胞因子的抑制作用。Zolbetuximab联合免疫检查点抑制剂可能增强肿瘤浸润并逆转免疫抑制。修改Fc区域以提高ADCC在低浸润肿瘤中的疗效可以进一步优化结果。
(数据来源 Nakayama I, et al. Nat Rev Clin Oncol. 2024)
抗体药物偶联物(ADC)
CMG901可将单MMAE递送至CLDN18.2阳性肿瘤细胞,通过抑制微管形成诱导细胞凋亡胃和
胃食管结合部(G/GEJ)癌的早期试验显示了有希望的抗肿瘤作用和持久的反应,尽管胃肠道副作用,如恶心和腹泻已被发现。
SYSA1801是另一种基于MMAE的靶向CLDN18.2的ADC,在临床前研究中显示出强大的抗肿瘤活性,特别是在耐药或难治性实体瘤中。目前正在进行的I期临床试验显示了其治疗胰腺癌的潜力,但仍需要进一步的临床数据。毒性似乎相对较轻,但尚未对其安全性进行全面评估。
RC118也利用MMAE有效载荷,靶向表达CLDN18.2的肿瘤,并在包括胰腺癌在内的多种实体瘤中显示出强大的抗肿瘤作用。
嵌合抗原受体(CAR)T细胞疗法
针对CLDN18.2的CAR-T细胞疗法在早期实验中显示出较高的客观缓解率(ORR),但是在胃癌和胰腺癌等实体瘤中难以实现长期的无进展生存期(PFS)和反应持续时间(DOR)。这可能是由于肿瘤微环境中的免疫抑制特性。将IL15纳入CAR-T细胞的构建中,IL15可以增强T细胞的存活和增殖,有助于CAR-T细胞在胰腺癌等实体瘤的免疫抑制性肿瘤微环境中更长时间的持续存在。
双特异性抗体
双特异性抗体(BsAbs)通过与免疫效应细胞或检查点分子一起靶向CLDN18.2,增强机体对肿瘤的免疫应答。
QLS31905靶向CLDN18.2和CD3,引导T细胞到肿瘤部位诱导细胞毒性。临床前研究显示,CLDN18.2在阳性肿瘤中,尤其是在胃癌模型中显示出良好的疗效,而早期安全性数据提示有轻微的副作用。
PT886是一种靶向CLDN18.2和CD47的双特异性抗体,它通过阻断CD47促进肿瘤细胞的吞噬,而CD47是癌细胞用来逃避免疫清除的“不要吃我”信号。临床前研究显示,即使在低剂量下,PT886也具有显著的抗肿瘤作用,并且在一些模型中具有完全清除肿瘤的潜力。
Q-1802同时靶向CLDN18.2和PD-L1,将免疫检查点抑制与直接靶向肿瘤相结合。早期试验显示Q-1802在胃腺癌和胰腺癌中具有良好的抗肿瘤活性,尤其是在复发或难治性肿瘤。
(数据来源 Nakayama I, et al. Nat Rev Clin Oncol. 2024)
针对CLDN18.2特异性T细胞免疫治疗的研究表明,CLDN18.2多肽扩增的T细胞在体外表现出强大的抗肿瘤活性和增强细胞因子分泌。这些发现强调了CLDN18.2在胃癌细胞中的选择性表达及其免疫原性的潜力,可作为个体化免疫治疗的理想靶点。
抗CLDN18.2的联合治疗在肿瘤研究中的应用
肿瘤研究的最新进展表明,将抗CLDN18.2治疗与免疫治疗(尤其是ICIs)联合可提供一种增强疗效的协同方法。靶向CLDN18.2的单克隆抗体(如唑贝妥昔单抗)可将免疫系统导向表达CLDN18.2的肿瘤细胞,从而产生抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性。另一方面,pembrolizumab和nivolumab等ICIs的工作机制是去除免疫细胞(尤其是T细胞)上的抑制信号,使其更有效地识别和攻击肿瘤细胞。这两种治疗模式(针对CLDN18.2的靶向治疗和免疫检查点阻断)的结合创造了有利的治疗环境。CLDN18.2抗体的靶向特异性增强了肿瘤杀伤作用,而ICI增加了免疫系统维持抗肿瘤应答的能力。
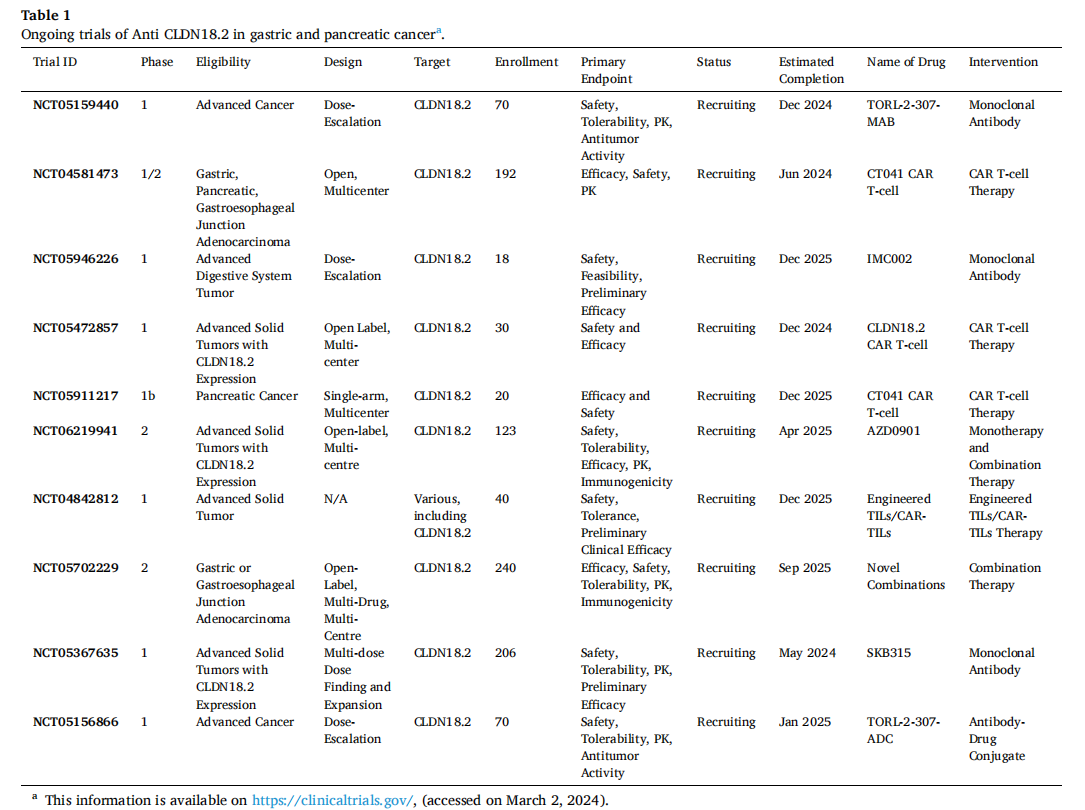
CLDN18.2靶向治疗的耐药机制
CLDN18.2靶向治疗耐药的主要机制包括抗原丢失或异质性、免疫抑制性肿瘤微环境、激活替代信号通路和肿瘤相关巨噬细胞与免疫逃逸。可以通过将CLDN18.2疗法与免疫检查点抑制剂相结合扩大免疫反应抵消抗原丢失以及逆转T细胞耗竭。将CLDN18.2靶向药物与通路抑制剂(如MEK或ERK抑制剂)相结合,以阻断下游信号级联。靶向CLDN18.2和其他对肿瘤生存至关重要的抗原的双重CAR-T方法。
总结与展望
针对CLDN18.2的靶向疗法主要有单克隆抗体,抗体药物偶联物,CAR-T细胞疗法,双特异性抗体,他们在治疗CLDN18.2阳性肿瘤中有很强的抗肿瘤活性。但是CLDN18.2疗法的耐药性仍然是一个重大的阻碍。通过联合疗法、耐药管理和精准医学方法的创新,CLDN18.2靶向疗法的未来将解决胃癌和胰腺癌治疗中的关键挑战。未来的研究应继续揭示CLDN18.2在癌症进展中的复杂作用,旨在提炼预测性生物标志物和优化治疗方案。这些靶向治疗在显著改善临床结局方面具有巨大潜力,标志着胃癌和胰腺癌治疗的新时代。
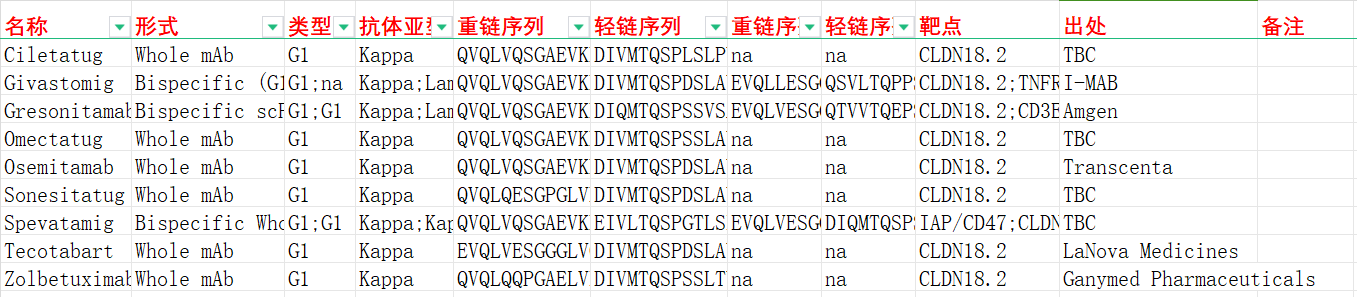
我们收集整理一批CLDN18.2相关抗体序列信息。文档可关注公众号“迈思生物”,号内回复“CLDN18.2”下载。