BTLA也称为CD272,它是一种B和T淋巴细胞衰减器,BTLA蛋白属于CD28免疫球蛋白超家族(IgSF)。BTLA可以识别配体HVEM/CD270,BTLA它是一种抑制性免疫检查点,BTLA在调节免疫反应中发挥双重作用。阻断BTLA的抑制作用可以增加对抗原刺激的免疫反应。BTLA/HVEM轴可以作为未来癌症免疫治疗靶点。
BTLA的表达和功能
BTLA主要在淋巴细胞和髓系细胞表面表达,包括CD4+和CD8+T细胞、NK细胞、B细胞、树突状细胞(DC)和巨噬细胞。组织分布显示淋巴结、胸腺和小肠中BTLA表达水平较高。
B细胞:BTLA-HVEM信号传导抑制B细胞的增殖和特定细胞因子(IL-6、IL-10和TNFα)的分泌,但不影响趋化因子(IL-8和MIP-1β)的分泌。
T细胞:BTLA不仅可以在T细胞激活的早期阶段起作用,还可以在T细胞介导的炎症过程中调节T细胞的存活。BTLA缺失的T细胞凋亡减少,因此可以介导持续的炎症。BTLA有助于诱导CD4+和CD8+T细胞的周围耐受性。
DC细胞:BTLA的过表达可以抑制DC的成熟并促进未成熟DC的免疫耐受。此外,BTLA-HVEM通路参与调节DC稳态。BTLA+DC通过上调CD5促进T细胞中的Foxp3表达,导致Treg细胞分化和周围Treg细胞耐受性的诱导。

(数据来源 Andrzejczak A, et al. Biomark Res. 2024)
BTLA的结构和配体
BTLA基因位于第3号染色体q13.2的反向位置,编码一个由289个氨基酸组成的一型跨膜糖蛋白(33kD)。BTLA蛋白在结构和功能上与PD-1和CTLA-4具有相似性。BTLA蛋白由信号肽、类似于IgC的外胞质域、跨膜结构域和胞内结构域组成。BTLA的细胞质区域包含三个高度保守的含酪氨酸基序;一个生长因子受体结合蛋白2(Grb2)结合位点,一个免疫受体酪氨酸抑制基序(ITIM)和一个免疫受体酪氨酸基开关基序(ITSM)。BTLA蛋白还通过选择性RNA剪接产生可溶性形式(sBTLA)。
BTLA的配体是HVEM,HVEM属于肿瘤坏死因子受体(TNFR)超家族。HVEM和BTLA按照1:1化学剂量相互作用,HVEM的N端富含半胱氨酸的结构域CRD1与BTLA中位于35-43位的N端延伸部分相互作用。

(数据来源 Wojciechowicz K, et al. Eur J Med Chem. 2024)
BTLA的信号通路和调控:
BTLA信号通过两个免疫受体酪氨酸抑制(ITIM)基序介导募集具有Src同源结构域的磷酸酶1和2(SHP-1和SHP-2)来负性调节免疫应答。BTLA与HVEM存在顺式和反式相互作用。
反式相互作用:BTLA和HVEM在不同细胞上表达。BTLA-HVEM反式相互作用为T细胞提供双向信号传导。BTLA的结合导致SHP-1和SHP-2的招募,从而下调TCR信号传导并提供抑制信号。相反,GRb-2蛋白的结合导致PI3K/Akt信号传导的激活,促进T细胞的存活。
顺式相互作用:BTLA和HVEM在同一细胞上表达。BTLA-HVEM顺式相互作用防止BTLA或HVEM与其他共信号分子以反式方式相互作用,并抑制T细胞中依赖HVEM的NF-κB激活,促进耐受性。

(数据来源 Andrzejczak A, et al. Biomark Res. 2024)
BTLA/HVEM轴在癌症中的作用
在癌症背景下,HVEM及其配体的免疫调节功能发生了改变,特别是BTLA由于其抑制特性,从而导致了抗肿瘤免疫失调。在癌症背景下,肿瘤浸润淋巴细胞上增强的BTLA表达增加了反式相互作用,并导致T细胞介导的抗肿瘤反应受到抑制。

(数据来源 Sordo-Bahamonde C, et al. Mol Cancer. 2023)
BTLA的靶向治疗
BTLA/HVEM轴作为肿瘤免疫治疗的靶点。目前正在临床前和临床水平开发多种方法,包括单克隆抗体(单药治疗或者与抗PD -1或化疗药物联合治疗),以及产生sHVEM的CAR-T细胞疗法。

(数据来源 Sordo-Bahamonde C, et al. Mol Cancer. 2023)
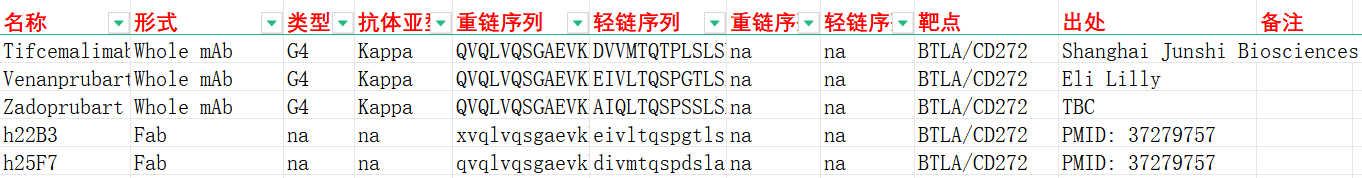
Tifcemalimab是由上海君实生物医药公司开发的一款靶向BTLA的单克隆抗体,目前处于临床3期研究阶段,用于治疗典型霍奇金淋巴瘤,难治性经典霍奇金淋巴瘤,小细胞肺癌等疾病。Tifcemalimab与抗PD-1单抗特瑞普利单抗具有联用潜力,目前正在多种恶性实体瘤和血液肿瘤中进行广泛探索。
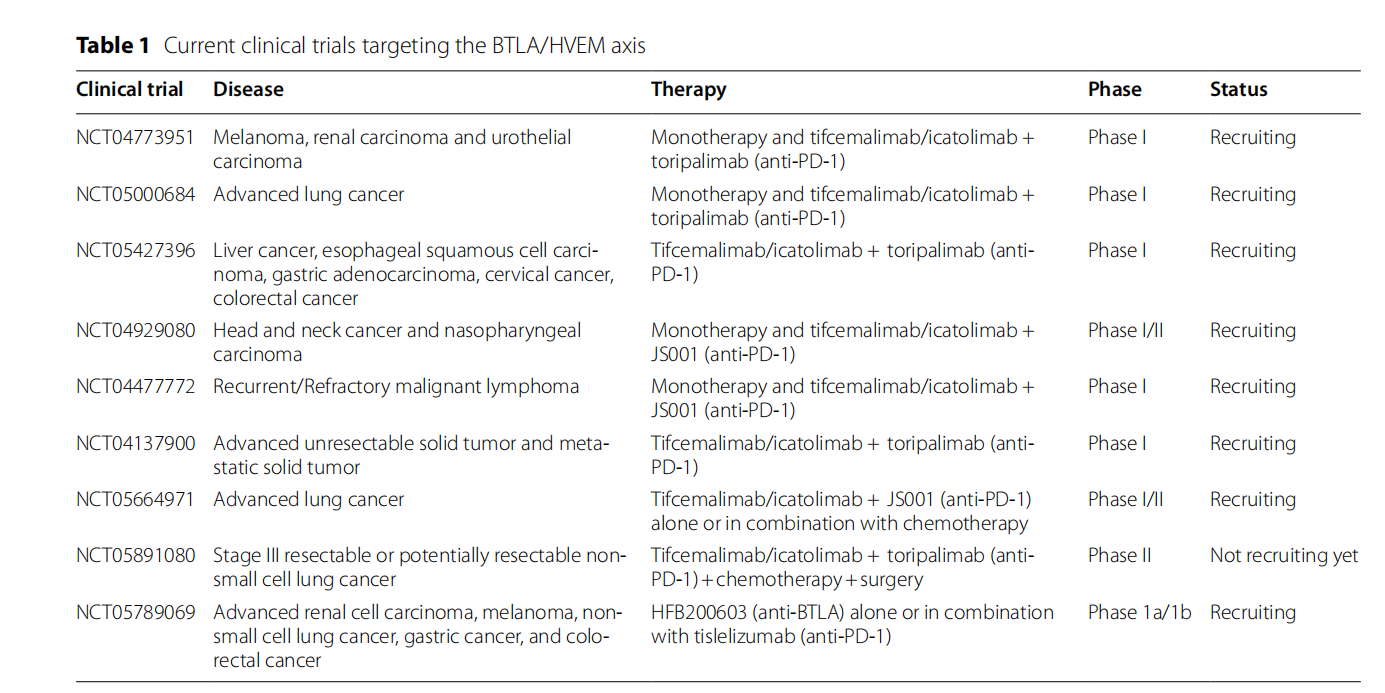
(数据来源 Sordo-Bahamonde C, et al. Mol Cancer. 2023)
我们收集整理一批BTLA相关抗体序列信息。文档可关注公众号“迈思生物”,号内回复“BTLA”下载。