滋养层细胞表面抗原(TROP2),也称为肿瘤相关钙信号传感器2(TACSTD2),TROP2在一系列实体瘤中过度表达,显着影响肿瘤生长、侵袭和转移。因此,TROP2已成为实体瘤有吸引力的预后标志物和治疗靶点。
TROP2的表达分布
TROP2主要表达在基底呼吸细胞,鳞状上皮细胞,基底上角质形成细胞,离子细胞,Club细胞,导管细胞,基底鳞状上皮细胞,基底角质形成细胞中。
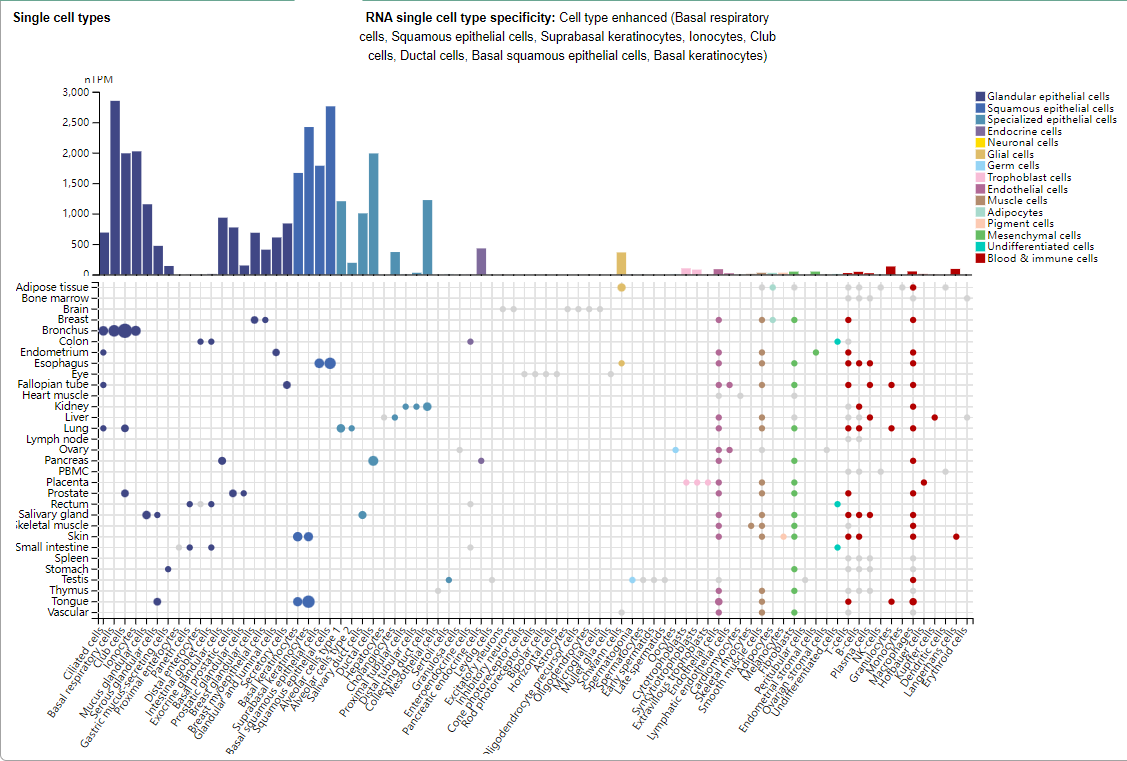
(数据来源 uniprot)
TROP2的结构
TROP2是一种 I型跨膜糖蛋白,由四个结构域组成,包括信号肽(SP)、胞外结构域(ECD)、单跨膜螺旋(TMD)和胞质尾(ICD)。TROP2-ECD(H27-T274)包含三个子结构域:富含半胱氨酸结构域(CRD)、甲状腺球蛋白1型结构域(TY)和半胱氨酸缺乏结构域(CPD)。
TROP2-ECD可以自组装成顺式或反式二聚体,甚至四聚体。在顺式二聚体的界面处,一个单体的TY环与另一个单体的βC片之间形成复杂的氢键相互作用网络。相反,在TROP2-ECD反式二聚体的情况下,相互作用主要由两个单体CPD的βC片层介导,其覆盖的表面积比顺式二聚体相对较小。
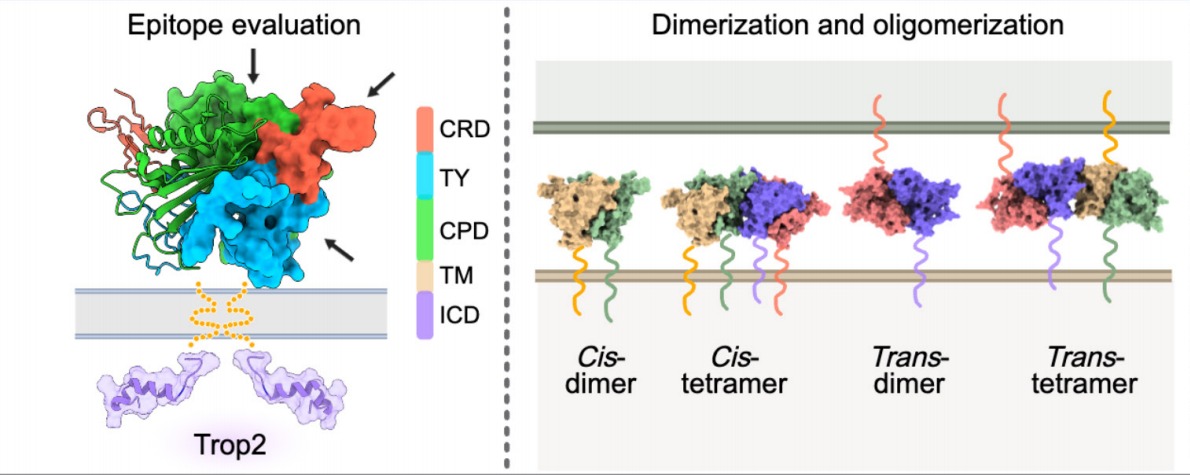
(数据来源 Liu X, et al. Theranostics. 2024)
TROP2在肿瘤中的信号通路
TROP2可以激活多种致癌信号,TROP2激活ERK1/2-MAPK轴,促进恶性转化并驱动肿瘤发生。此外,它还调节Notch通路,影响干细胞功能和潜在的肿瘤分化和层次。TROP2还直接与核β-连环蛋白相互作用,促进细胞增殖,这是癌症的一个标志。
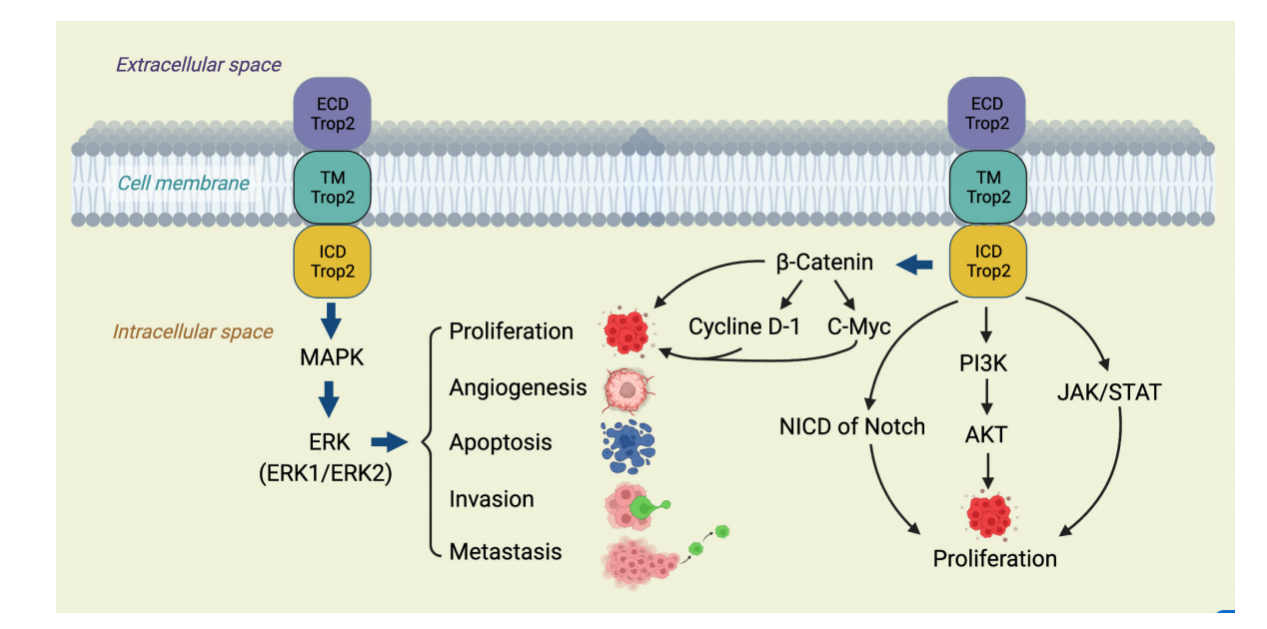
(数据来源 Yao L, et al. Front Oncol. 2023)
TROP2的靶向治疗
目前靶向TROP2的治疗方法主要有ADC、抗体、多特异性药物、免疫疗法、癌症疫苗和小分子抑制剂。

(数据来源 Liu X, et al. Theranostics. 2024)
抗体药物偶联物(ADC)
第一个TROP2靶向抗体药物偶联物(ADC)Trodelvy TM(sacituzumab govitecan),临床前研究表明,SG对各种TROP2阳性肿瘤类型均具有显著的特异性抗肿瘤作用。它可提高转移性乳腺癌(mBC)和转移性尿路上皮癌(mUC)的生存率。在双抗体药物偶联物(DAD)一期试验中,SG与nectin-4导向的ADC药物enfortumab vedotin(EV)联合使用在mUC患者中取得了令人印象深刻的客观缓解率(ORR)70%。
Datopotamab deruxtecan(Dato-DXd)。Dato-DXd是一种新型TROP2导向的ADC,由第一三共和阿斯利康开发。它由通过基于四肽的接头与拓扑异构酶I抑制剂(DXd)缀合的重组人源化抗TROP2 IgG1单克隆抗体(mAb)组成,该接头连接以减少datopotamab链间二硫键处的半胱氨酸残基。Dato-DXd在治疗各种TROP2阳性实体瘤方面表现出巨大的潜力和可控的安全性,尤其是在非小细胞肺癌(NSCLC)中表现出特别的前景。虽然Dato-DXd的临床潜力很有希望,但其副作用需要认真关注和管理。间质性肺疾病(ILD)是与Dato-DXd相关的一个显著风险,特别是对于NSCLC患者。

虽然ADC在TROP2阳性肿瘤中具有巨大的治疗前景,但要实现这一潜力需要克服几个关键挑战,包括肿瘤内和肿瘤内异质性、TRAE风险和耐药性。因此需要开发更安全、更有效的靶向药物来利用TROP2本身的生物学功能。
单克隆抗体
由于TROP2结构上独特的寡聚特性,对于旨在阻断TROP2致癌活性的靶向药物,大的细胞外结构域(ECD)使其成为理想的治疗靶点。
RS7-3G11(RS7)是SG的抗体成分,是早期研究中广泛研究的抗TROP2 mAb。能够识别TROP2细胞外区(ECD)中的一个线性多肽Q237-Q252,位于TROP2的胱氨酸缺乏区(CPD)。RS7本身表现出很强的内化活性,但缺乏治疗功效。研究表明RS7不太可能破坏TROP2的寡聚体组装。这可以解释为什么未结合形式的RS7对TROP2阳性肿瘤没有发挥抑制作用。
TROP2的CPD区可能包含多个免疫优势表位,很容易获得非功能性的TROP2抗体。但是这些表位在肿瘤细胞和正常细胞中都很容易获得,靶向这些表位的TROP2导向单克隆抗体可能导致难以控制的肿瘤外毒性。因此研究者发现靶向TROP2上肿瘤特异性表位的方法似乎更有前景。
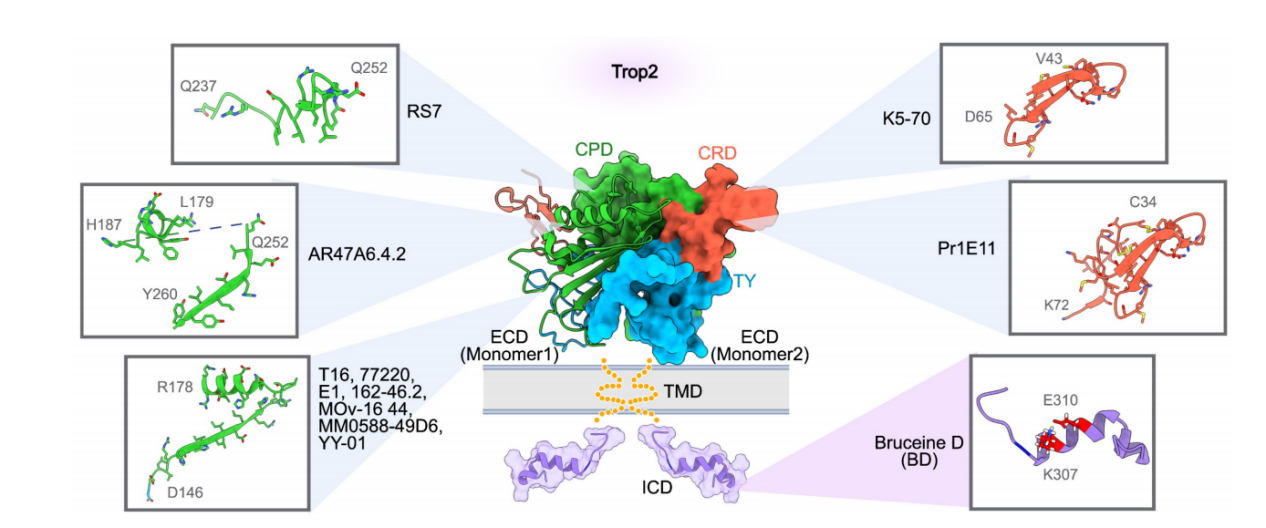
ARIUS Research利用FunctionFIRST平台生成了mAb AR47A6.4.2,其靶向TROP2-CPD内的两个线性表位(L179-H187和Q252-Y260)。AR47A6.4.2可以抑制TROP2信号传导并介导响应血清刺激的丝裂原激活蛋白激酶 (MAPK) 途径的下调。它还在人胰腺细胞中诱导补体依赖性细胞毒性(CDC)。双MOA使AR47A6.4.2能够抑制人类乳腺癌(90%,p<0.00001)、结肠癌(60%,p<0.001)和前列腺癌(60.9%,p<0.001)模型中的肿瘤生长。
Pr1E11靶向TROP2的胱氨酸富集区(CRD),这个区域对于TROP2的四聚体组装至关重要。
K5-70是开发的另一种CRD导向的单克隆抗体,K5-70的关键表位位于TROP2-CRD内的V43-D65 多肽上。该结合区域与TROP2的四聚化界面重叠,K5-70有可能破坏肿瘤细胞表面的TROP2簇,并随后干扰其致癌信号通路。表明CRD靶向的单克隆抗体在TROP2阳性肿瘤中具有重要潜力。

大多数报道的抗TROP2单抗主要靶向CRD和CPD结构域,较少靶向TY结构域。从结构上看,TY区域广泛参与TROP2的寡聚体组装,并包括对肿瘤特异性蛋白水解裂解至关重要的保守位点。因此,我们可以合理地推测,靶向TY可能会干扰TROP2介导的细胞内和细胞间通讯,从而可能阻碍TROP2阳性肿瘤的进展。
双特异性抗体
由于耐药性和肿瘤异质性会限制针对单一抗原的靶向治疗的临床结果,与TROP2相关的多种新出现的多特异性药物(如双特异性抗体、三特异性抗体和双特异性ADC)已在临床前研究中进行了评估。
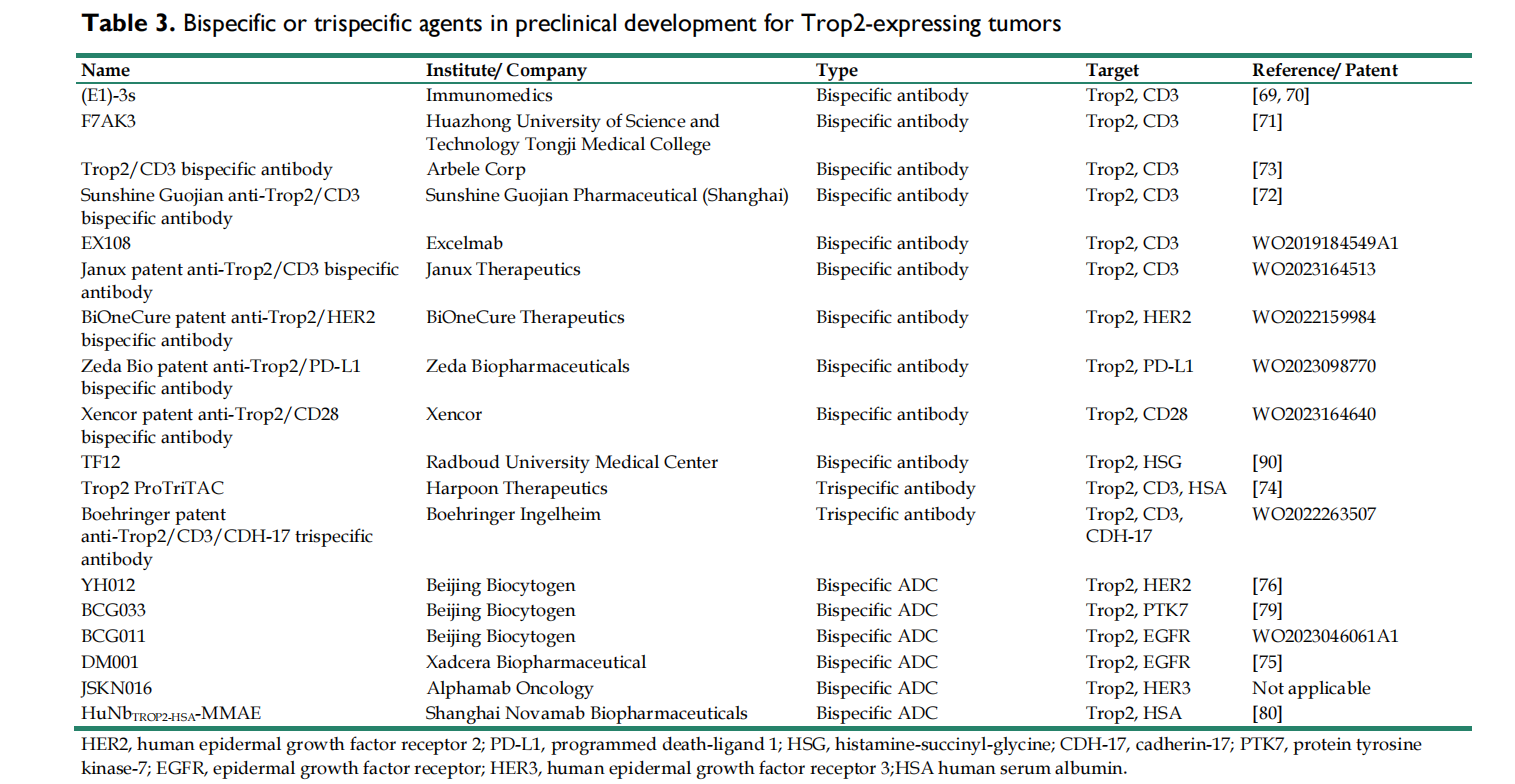
早期报道的抗TROP2双特异性抗体是双特异性T细胞接合器(BiTE),TROP2-CD3双特异性抗体与T细胞上的CD3和肿瘤细胞上的TROP2抗原结合。激活的T细胞释放细胞毒性细胞因子,导致TROP2阳性肿瘤细胞裂解。
F7AK3由与人抗TROP2 IgG4的Fc区融合的抗cd3 scFv组成。体外分析表明,F7AK3触发了T细胞介导的针对几种表达TROP2的肿瘤细胞类型的细胞毒性,其活化水平取决于TROP2抗原的表达。在TNBC异种移植模型中,F7AK3被证明通过多种MOAs抑制肿瘤生长。
CAR-T/CAR-NK疗法
目前许多TROP2特异性CAR-T/CAR-NK已在临床前或早期临床阶段显示出有前景的疗效。
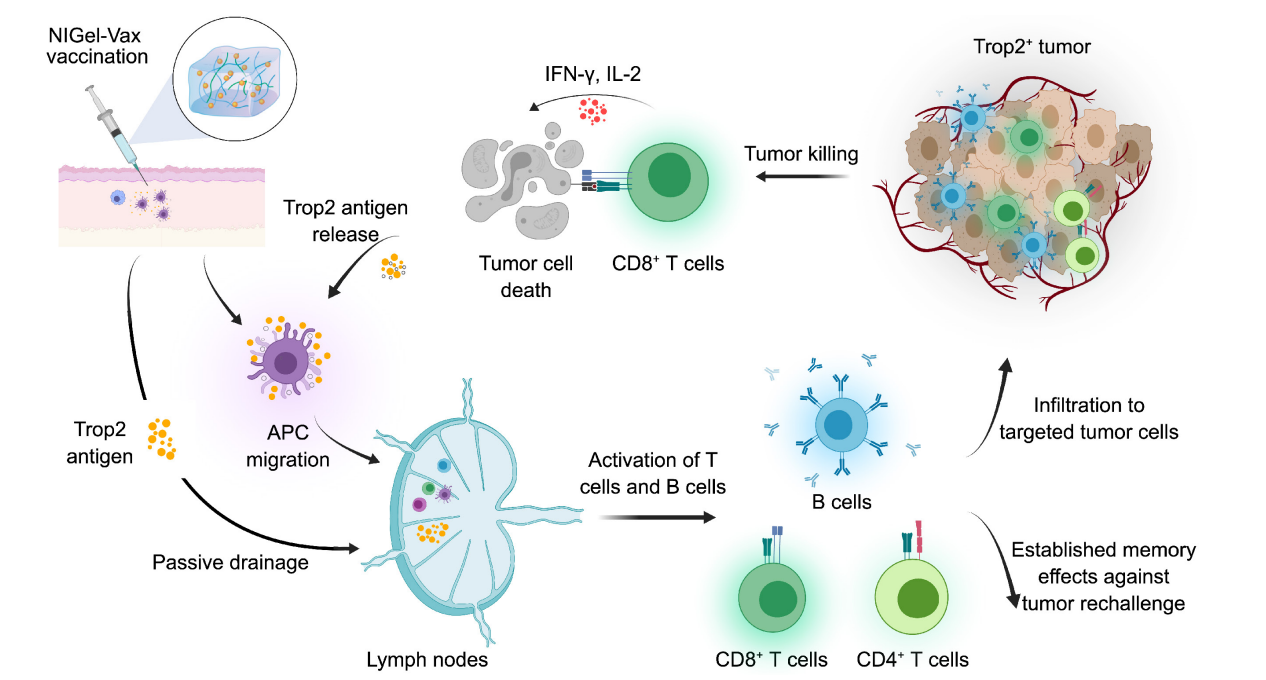
疫苗
癌症疫苗的目的是激活患者的免疫系统,使其能够通过诱导B细胞和激发针对肿瘤特异性抗原的CD8+/CD4+T细胞应答来检测和清除肿瘤细胞。几种TROP2特异性癌症疫苗目前正在使用不同平台进行临床前阶段的开发。TROP2靶向纳米凝胶疫苗(NIGel-Vax)是一种新型的癌症免疫治疗。
小结
TROP2在癌细胞中过度表达,TROP2已成为癌症治疗的一个有前景的靶点。基于ADC的抗TROP2 疗法的进展显着改变了TROP2阳性实体瘤患者的治疗格局。由于肿瘤的异质性和个体特异性,依靠单一药物或疗法通常足以获得更好的结果。临床前和早期临床研究的初步数据表明,TROP2靶向ADC与化疗药物、小分子抑制剂、免疫治疗或抗血管生成治疗联合使用时,可以在耐药肿瘤中产生协同抗肿瘤作用。药物间相互作用的叠加毒性可能会增加治疗失败的风险。因此,寻找具有良好反应和可控制毒性的最佳联合疗法仍然是一个重大挑战。
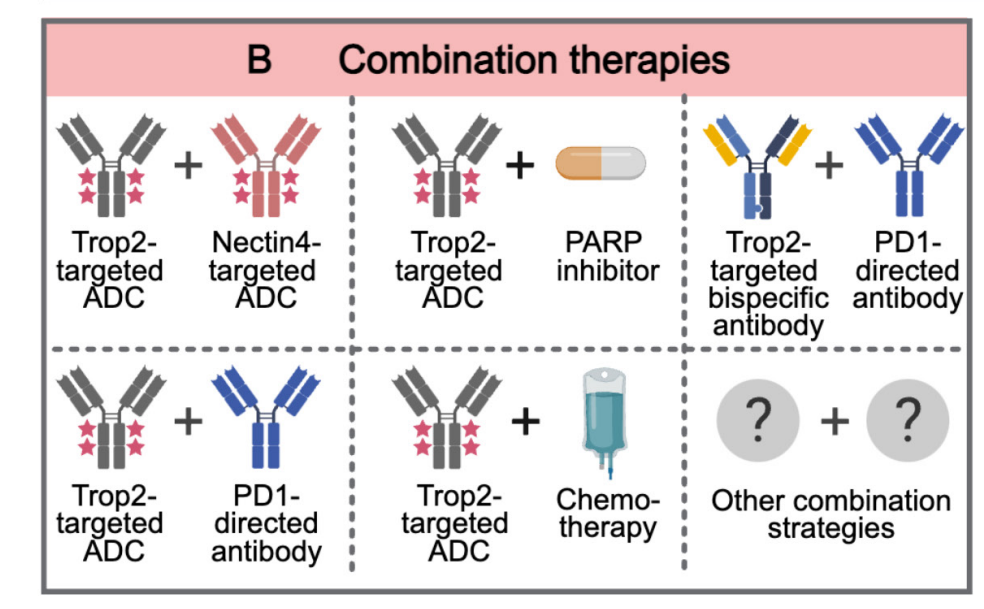
(数据来源 Liu X, et al. Theranostics. 2024)
我们收集整理一批TROP2相关抗体序列信息。文档可关注公众号“迈思生物”,号内回复“TROP2”下载。

