重组蛋白是应用基因重组克隆技术从而获得的蛋白质,重组蛋白表达技术已经广泛用于生物学的各个领域,目前,体外重组蛋白表达系统主要有以下几类:原核表达系统(大肠杆菌表达系统、枯草杆菌表达系统)、真核表达系统(酵母表达系统、昆虫细胞表达系统、哺乳动物细胞表达系统)。表达的一般实验包括载体构建-表达鉴定-蛋白纯化三大步骤。蛋白标签是指与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和纯化等。随着技术的不断发展,研究人员相继开发出了具有各种不同功能的蛋白标签,本文将对目前常见的一些蛋白标签以及如何选择标签做一个系统介绍。
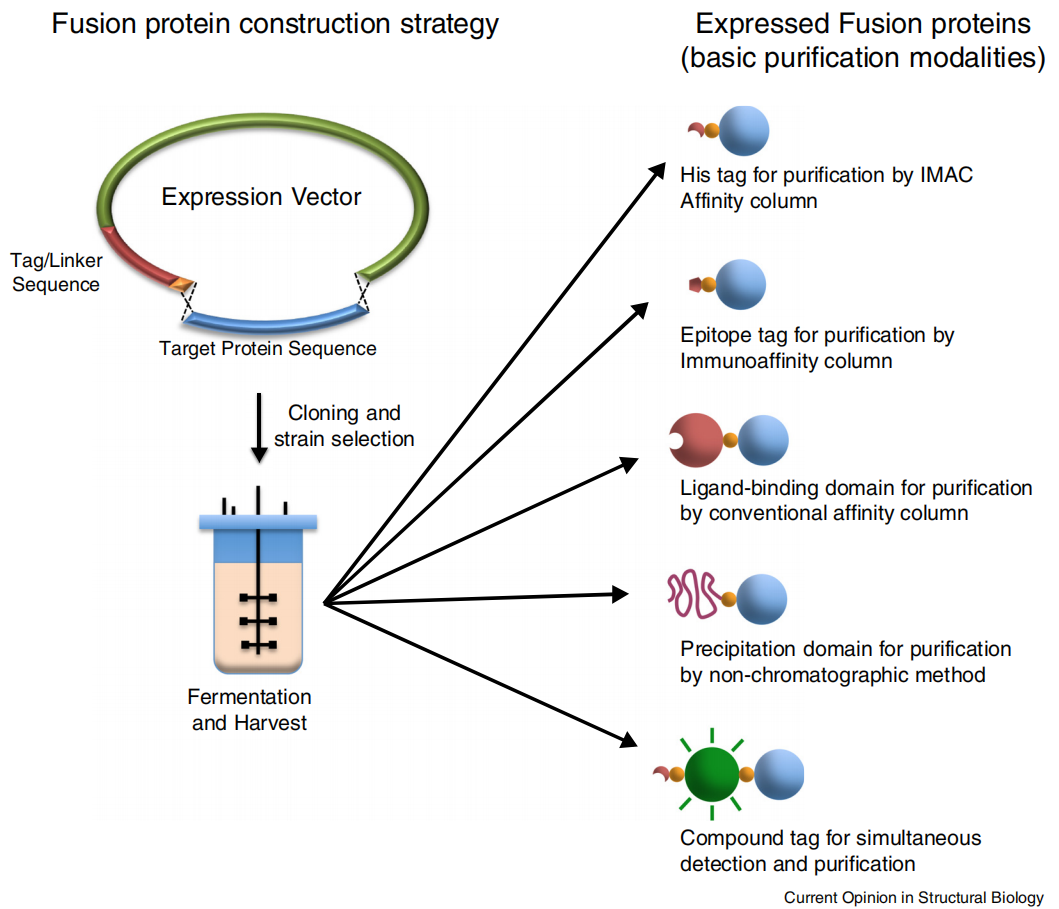
蛋白标签的类型
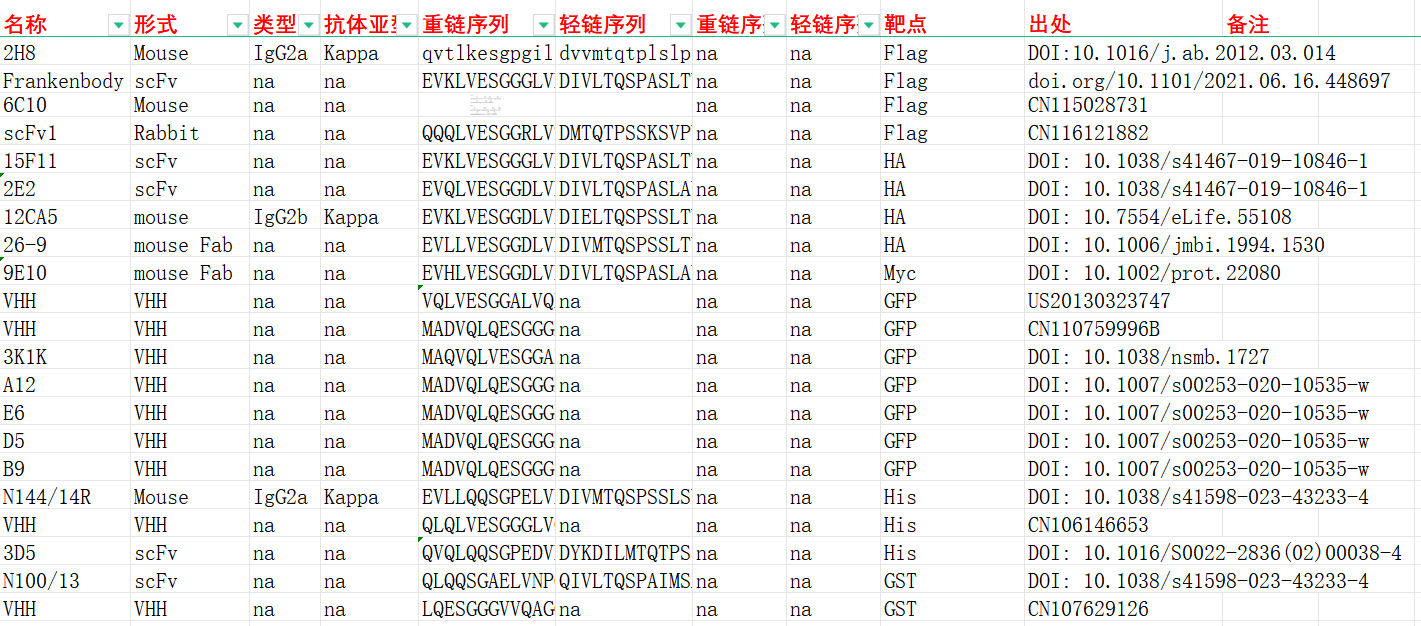
常见的蛋白标签根据应用不同可以分为亲和标签,表位标签和荧光标签。亲和标签一般较长,可以用于纯化或者增加蛋白的溶解度,如GST,SUMO,MBP,Fc等;表位标签往往是短肽序列,可用于免疫学应用,如Western Blot和免疫共沉淀,常用的表位标签有His,Flag,HA,C-Myc;荧光标签可用于活细胞和死细胞检测,最常用的荧光蛋白包括绿色荧光蛋白(GFP)。
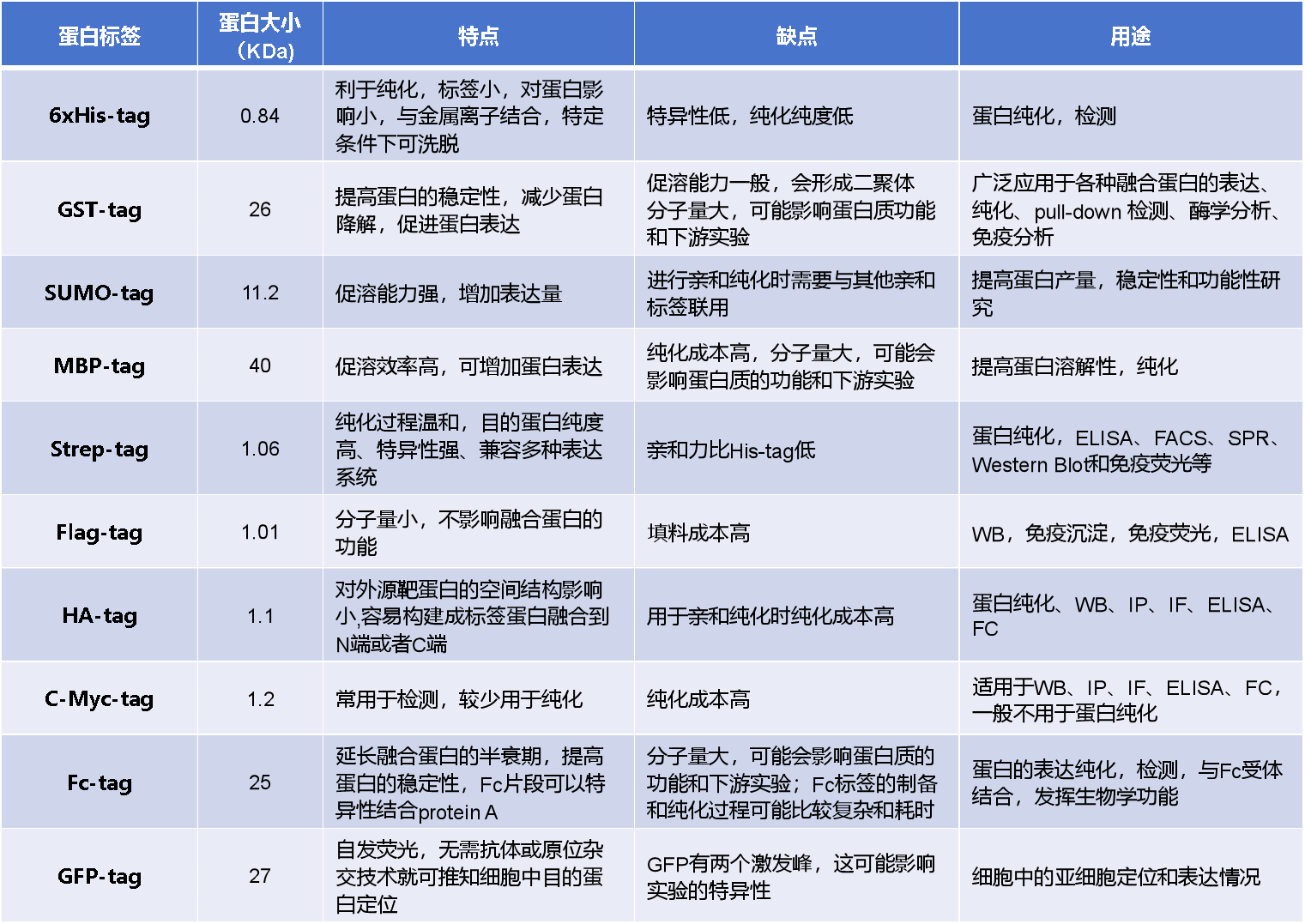
常见的蛋白标签
一.6xHis -tag
6xHis是指六个组氨酸残基组成的融合标签,可插入在目的蛋白的C末端或N末端。6xHis既是一种亲和标签也是一种表位标签,它可以用于纯化和检测。组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对重组蛋白进行分离纯化。
6xHis标签序列:HHHHHH
6xHis标签特点:
1. 6xHis标签分子量小,只有~0.84KD,一般不影响目标蛋白的功能;
2. His标签融合蛋白可以在非离子型表面活性剂存在的条件下或变性条件下纯化;
3. His标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA相互作用研究;
4. His标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫制备抗体;
5. 可应用于多种表达系统,纯化的条件温和;
6. 可以和其它的亲和标签一起构建双亲和标签。
二.GST-tag
GST(谷胱甘肽巯基转移酶)标签蛋白本身是一个在解毒过程中起到重要作用的转移酶,是一种由211个氨基酸组成的蛋白,它的分子量大小为26KD。天然GST负责保护细胞免受有害化合物和氧化应激的影响。GST主要应用在原核表达中,将它应用在原核表达的原因大致有两个,一个是因为它是一个高度可溶的蛋白,希望可以利用它增加外源蛋白的可溶性;另一个是它可以在大肠杆菌中大量表达,起到提高表达量的作用。GST的一个主要特性是其对三肽(谷胱甘肽)具有亲和性,可在亲和层析中使用。含有GST的溶液在经过内衬固定化谷胱甘肽的色谱柱时,GST会与谷胱甘肽结合,将其与溶液的其余部分分离。
GST标签的优缺点:
1. GST融合表达系统广泛应用于各种融合蛋白的表达,可以在大肠杆菌和酵母菌等宿主细胞中表达。GST标签蛋白可直接从细菌裂解液中利用含有还原型谷胱甘肽琼脂糖凝胶亲和树脂进行纯化。GST标签蛋白可在温和、非变性条件下洗脱,因此保留了蛋白的抗原性和生物活性。结合的融合蛋白在非变性条件下用10mM还原型谷胱甘肽洗脱。
2. GST在变性条件下会失去对谷胱甘肽树脂的结合能力,因此不能在纯化缓冲液中加入强变性剂如:盐酸胍或尿素等。如果要去除GST融合部分,可用位点特异性蛋白酶切除。
3. GST标签可用酶学分析或免疫分析很方便的检测。
4. GST是一个常用的促溶和促稳定的纯化标签;有助于保护重组蛋白免受胞外蛋白酶的降解并提高其稳定性。在大多数情况下GST融合蛋白是完全或部分可溶的。
5. 分子量较大,可能会影响蛋白质的功能和下游实验;
6. 如果蛋白不可溶,很难用变性的方法纯化。
三.SUMO-tag
SUMO标签蛋白是一种小分子泛素样修饰蛋白(Small ubiquitin-likemodifier),由100个氨基酸组成,是泛素(ubiquitin)类多肽链超家族的重要成员之一。在一级结构上,SUMO与泛素只有18%的同源性,然而两者的三级结构及其生物学功能却十分相似。
SUMO标签的优缺点:
1. SUMO标签促进靶蛋白可溶性表达,提供融合蛋白的表达量;
2. SUMO标签可以作为分子伴侣,促进蛋白质正确折叠;
3. SUMO对热和蛋白酶具有耐受性;
4. SUMO蛋白水解酶可以识别SUMO标签的三级结构,它可由SUMO蛋白水解酶高效切除,不存在任何氨基酸的残留,得到无标签目的蛋白;
5. SUMO本身不具有独立的纯化标签功能,所以要与其它标签如His标签联用;
6. 分子量较大,可能会影响蛋白质的功能和下游实验。
四.MBP-tag
MBP(麦芽糖结合蛋白)标签蛋白由370个氨基酸组成,分子量大小约为40kDa,由大肠杆菌K12的malE基因编码,MBP的折叠过程需要DnaK-DnaJ-GrpE和GroEL-GeoES两个分子伴侣系统的帮助,而这些分子伴侣也会聚集在目标蛋白的附近,帮助它们正确折叠,并增加目标蛋白的可溶性。所以它常被用作融合标签来增加目标蛋白的溶解度和表达水平。
MBP标签的优缺点:
1. MBP标签蛋白可促进连接蛋白的正确折叠,增加在细菌中过量表达的融合蛋白的溶解性,尤其是真核蛋白;
2. MBP融合蛋白可以通过亲和层析的方法从细胞裂解物中高效纯化出来;亲和纯化在生理条件下进行,使用麦芽糖进行温和洗脱,温和的洗脱条件保持了MBP标记的蛋白质的活性,结合的融合蛋白可用10mM麦芽糖在生理缓冲液中进行洗脱。缓冲条件为pH7.0到8.5,盐浓度可高达1M,但不能使用变性剂;
3. MBP标签可通过免疫分析很方便地检测;
4. MBP标签还可以通过特定的蛋白酶切割位点与目标蛋白分离,这样可以在不干扰蛋白质本身结构和功能的情况下去除MBP标签,获得高纯度的目标蛋白;
5. 如果蛋白在细菌中表达,MBP可以融合在蛋白的N端或C端;
6. MBP纯化的填料较脆弱,结合效率不高,并且价格较高;
7. 分子量较大,可能会影响蛋白质的功能和下游实验;
8. 可能出现带有MBP的融合蛋可溶,而切除标签会致使目的蛋白沉淀。
五.Strep-tag
Strep-tag技术开发的原理是众所周知的生物素和抗生物素蛋白链菌素之间的结合反应,Strep标签蛋白是一种分子量较小的蛋白质标签,由8个氨基酸(Trp-Ser-His-Pro-Gln-Phe-Glu-Lys)构成的短序列并称之为Strep-tag II。
Strep-tag序列:WSHPQFEK
Strep-tag特点:
1. 纯化过程温和、目的蛋白纯度高、特异性强、兼容多种表达系统,对于有挑战性蛋白的纯化十分有帮助;
2. Strep-tag可以和His标签蛋白联合使用,进行两步纯化获得超高纯度蛋白;
3. 对洗脱试剂有一定的要求,洗脱时需改用脱硫生物素(Desthiobiotin)。
六.Flag-tag
Flag标签蛋白为编码8个氨基酸的亲水性多肽(DYKDDDDK),同时载体中构建的Kozak序列使得带有FLAG的融合蛋白在真核表达系统中表达效率更高。是第一个为用于融合蛋白而设计的表位标签,并且是唯一一个申请专利的标签。Flag标签结构短小,且与融合蛋白质之间含有一个肠激酶切割位点,可以通过肠激酶切割被除去。
Flag tag序列:DYKDDDDK
FLag tag的特点:
1. FLAG作为融合表达标签,其通常不会与目的蛋白相互作用并且通常不会影响目的蛋白的功能、性质,有利用研究人员对融合蛋白进行下游研究;
2. 融合FLAG的目的蛋白,可以直接通过FLAG进行亲和层析,此层析为非变性纯化,可以纯化有活性的融合蛋白,并且纯化效率高;
3. FLAG作为标签蛋白,其可以被抗FLAG的抗体识别,这样就方便通过Western Blot、ELISA等方法对含有FLAG的融合蛋白进行检测、鉴定;
4. 融合在N端的FLAG,其可以被肠激酶切除(DDDK),从而得到特异的目的蛋白。因此现FLAG标签已广泛的应用于蛋白表达、纯化、鉴定、功能研究及其蛋白相互作用等相关领域。
七.HA- tag
血凝素(HA)标签是一种长度为9个氨基酸的多肽,其来源于人流感病毒HA分子的第98-106位残基。HA标签的分子量为1.1 KDa,HA标签被广泛用作表达载体中的表位标签,其有利于蛋白质的检测、分离和纯化。
HA标签的序列:YPYDVPDYA
HA标签的特点:
1. 对外源靶蛋白的空间结构影响小,容易构建成标签蛋白融合到N端或者C端,不会干扰蛋白的生物活性或生物分布;
2. 易于用Anti-HA抗体检测和ELISA检测;
3. HA融合FLAG的目的蛋白,可以直接通过FLAG进行亲和层析,此层析为非变性纯化,可以纯化有活性的融合蛋白,并且纯化效率高。
八.C-Myc -tag
Myc标签蛋白来源于人类原癌基因Myc,作为抗原表位表达在不同的蛋白质中仍可识别其相应抗体。是一个含11个氨基酸的小标签
C-Myc -tag的序列:EQKLISEEDL
C-Myc -tag的特点:C-Myc tag已成功应用在 Western-blot杂交技术、免疫沉淀和流式细胞计量术中, 可用于检测重组蛋白质在靶细胞中的表达。
九.Fc-tag
Fc标签是免疫球蛋白重链的恒定区(结构域CH2和CH3)。它与一个蛋白的C端融合,因此它在某种程度上类似于小鼠/人类嵌合抗体,有时Fc融合蛋白也被称为Fc嵌合蛋白。Fc标签约为25kDa。

(数据来源 Cavaco M, et al. Biopolymers. 2017)
Fc-标签的特点:
1. 延长半衰期:Fc标签通过与人体内的Fc受体(FcRn)结合,显著延长了融合蛋白在血浆中的半衰期;
2. 提高稳定性:Fc融合蛋白可以通过Fc铰链区的二硫键形成稳定的二聚体或六聚体复合物,增加了分子的稳定性;
3. Fc片段可以特异性结合protein A,这有助于简化Fc融合蛋白的纯化步骤;
4. Fc融合蛋白可以结合不同的Fc受体,包括FcγRⅠ(CD64)、FcγRⅡ(CD32)、FcγRⅢ (CD16)、FcεRⅠ、FcεRⅡ和FcRn,从而介导不同的生物学功能,如炎症反应、抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)、调节细胞因子分泌等。
十.GFP-tag
GFP是一种约27KDa的蛋白质,由238个氨基酸组成,来源于水晶水母aequoreavictoria。它在蓝色波长范围的光线激发下,会发出绿色荧光。GFP标签可位于蛋白质的C端或N端,该系统已广泛应用于各种细胞类型,包括细菌、酵母和哺乳动物细胞等,相应的GFP标签抗体也被广泛应用。GFP在检测蛋白表达、蛋白和细胞荧光示踪、研究蛋白质之间相互作用和构象变化中,起到了重要的作用。
GFP-tag的特点:
1. 与传统荧光染料相比,GFP的主要优势在于它无毒,并且可以在活细胞中表达,从而可以研究动态的生理过程;
2. 标签蛋白的检测不受细胞内其他产物的影响,操作简便、快速;
3. 自发荧光,无需抗体或原位杂交技术就可推知细胞中目的蛋白定位。
4. 灵敏度高,适用于高通量的药物筛选。
如何选择蛋白标签
一. 确定蛋白标签对目标蛋白表达和功能的影响
亲和标签与目的蛋白之间的作用是相互的,需要综合考虑,既要考虑到对目的蛋白结构功能的影响,又要考虑到对标签与其配体亲和作用的影响,以及实际的用途。大多数情况首选短的多肽标签,这是因为短的多肽标签对目的蛋白的结构影响最小,而且短肽不具有免疫原性,融合蛋白可直接用于抗体的制备。而大的亲和标签可能限制重组蛋白的折叠,影响蛋白质的生物学功能。从另一方面来讲目的蛋白可能会干扰短肽标签与其配体的结合,与小的短肽标签相比,大的多肽和蛋白质标签也在实验室作为常规选择,它们的亲和配体大多是低分子化合物,可以降低目的蛋白对结合的影响,增强纯化的特异性。在许多情况下,重组融合蛋白去除亲和标签后,目的蛋白可形成正确的结构。
二. 确定融合标签的目的
蛋白纯化:标签的普遍用途是蛋白纯化。6*His tag也广泛应用于大肠杆菌的蛋白纯化。可是哺乳动物细胞中因非分泌蛋白自身存在高组氨酸背景,因此避免非特异性的纯化吸附,避免使用6*His tag。
Western Blot检测:Flag标签具有分子量小并且及拥有许多与之匹配的商业化的抗体等优势,它是Western Blot实验中常用的蛋白标签。
免疫共沉淀反应:用于免疫共沉淀反应的蛋白标签有Flag,HA和cMyc标签。
活细胞成像:活细胞成像常使用荧光蛋白。
三. 确定蛋白标签是加在N端还是C端
标签既可以添加在靶蛋白的N端也可以添加在C端,但是蛋白标签到底放在哪一端主要取决于蛋白本身,蛋白的折叠方式,以及末端是否有功能要求。一般来说,对于蛋白太小容易被降解的或比较难表达的蛋白,蛋白标签会选择加在N端;其次目的蛋白的C端有内部折叠结构,也会选择将标签蛋白放在N端,在N端添加标签的一个优势是可以利用标签上的高效翻译起始位点。
倘若没有确切的蛋白结构,或蛋白功能域图谱,建议分别构建N-端标记和C-端标记的表达克隆,以检测哪个更有效。
四.纯化后是否要切除标签
融合蛋白是否需要去除标签,由目的蛋白的用途和标签的特点来确定,如果用于免疫动物生产抗体,则不需要;如果不影响蛋白质的功能研究,也不需要;如果影响了蛋白质的功能研究或用于临床治疗,则需要去除标签。
我们收集整理一批蛋白标签相关抗体序列信息。文档可关注公众号“迈思生物”,号内回复“Tag”下载。