摘要
该研究展示了GPRC5D与临床前阶段单链抗体(scFv)复合物的结构,结构分析表明,GPRC5D在跨膜区域和典型的C类GPCR非常相似,该研究发现了GPRC5D独特的头对头的同型二聚体排列和界面,主要涉及TM4,将其与其他C类同型或异型二聚体区分开来。此外,该研究阐明了GPRC5D上一个相当大的细胞外结构域的结合位点,以识别scFv。这些发现不仅揭示了这种非常规C类GPCR的独特二聚体组织,而且还具有推进靶向GPRC5D治疗多发性骨髓瘤的药物开发的潜力。
背景
多发性骨髓瘤(MM)是第二常见的血液系统恶性肿瘤,其主要表现为骨髓内单克隆浆细胞不受控制的增殖和积累,导致免疫球蛋白过量产生、骨吸收和终末器官系统损伤。尽管最近发展了许多基于抗体的疗法,但是这些抗体药物只有一小部分进入临床使用,MM目前仍然是一种无法治愈的恶性肿瘤。

(数据来源 Cho SF, et al. Front Oncol. 2022)
GPRC5D是一种非典型的C类孤儿G蛋白偶联受体,它在多发性骨髓瘤细胞表面的高表达使其成为治疗干预的的一个有吸引力的靶点。包括单克隆抗体,CAR-T细胞和和T细胞接合物。尽管其具有治疗潜力,但对其受体结构和抗体识别机制的认识不足阻碍了有效治疗的进展。
2024年6月19日,上海科技大学徐菲团队在Nature communications上发表了一篇名为“The binding mechanism of an anti-multiple myeloma antibody to the human GPRC5D homodimer”的文章,该研究展示了GPRC5D与临床前阶段单链抗体(scFv)复合物的结构,结构分析表明,GPRC5D在跨膜区域和典型的C类GPCR非常相似,该研究发现了一种独特的头对头的同型二聚体排列和界面,主要涉及TM4,将其与其他C类同型或异型二聚体区分开来。此外,该研究阐明了GPRC5D上有一个相当大的细胞外结构域的结合位点,以识别scFv。这些发现不仅揭示了这种非常规C类GPCR的独特二聚体组织,而且还具有推进靶向GPRC5D治疗多发性骨髓瘤的药物开发的潜力。

GPRC5D的结构和表达
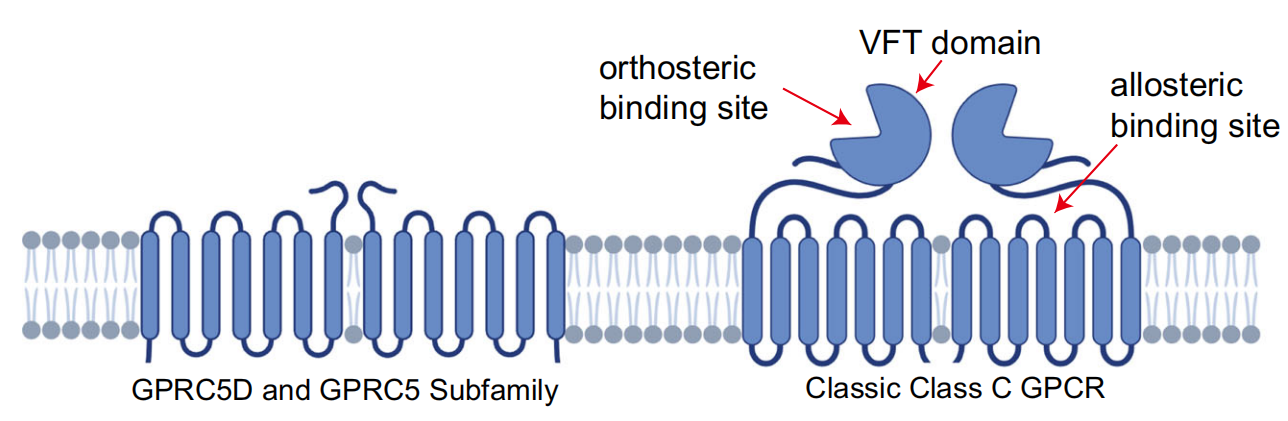
GPRC5D是一种孤儿受体,没有确定的内源性配体,GPRC5D属于第5亚家族C类G蛋白偶联受体(GPCRs),在哺乳动物中,还有另外三个GPRC5亚家族成员:GPRC5A,GPRC5B和GPRC5C。传统的C类GPCRs(如mGluR)通常包含一个名为Venus flytrap(VFT)的大N端结构域,负责与配体的垂直结合和同源或异源二聚体的形成。与经典的C类GPCR相比,其特点是细胞外N端较短且缺乏VFT结构域。由于缺乏大量的N端胞外区域,关于GPRC5D是否仍然可以形成二聚体以及信号如何通过跨膜区域转导的问题仍然存在。在人体中,GPRC5D主要在指甲和头发中表达,在产生硬角蛋白的分化细胞中表达。最近的研究表明,GPRC5D在多发性骨髓瘤细胞表面具有高度特异性和增强的表达,从而使其成为针对MM的抗体疗法的一个有吸引力的靶点。TALVEY™(talquetamab-tgvs)是世界上第一个针对GPRC5D/CD3的双特异性抗体,用于治疗成人患者的复发或难治性多发性骨髓瘤。
scFv150-18-GPRC5D复合物的整体结构
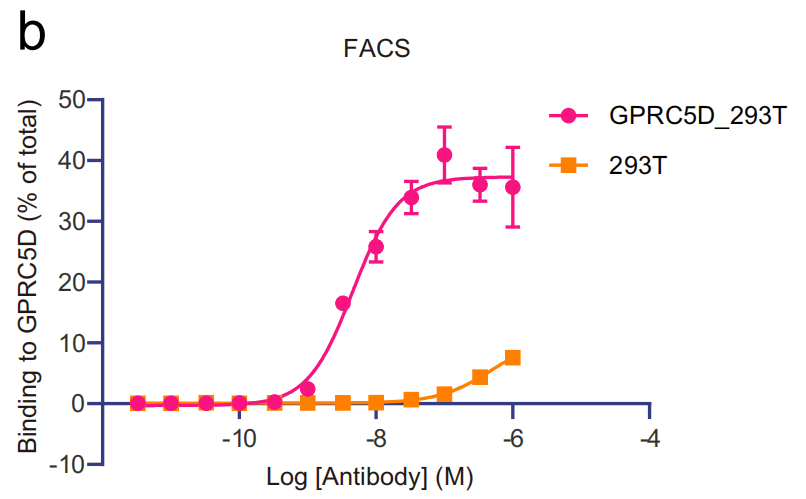
研究人员通过在昆虫细胞中共表达靶向GPRC5D的抗体scFv150-18(专利US20200123249A1)和GPRC5D成功获得结构良好的复合物。将scFv克隆为人IgG格式(IgG150-18),并进行荧光活化细胞分选(FACS)试验。结果表明,IgG150-18可以结合GPRC5D胞外结构域。
研究人员利用冷冻电子显微镜,阐明了人GPRC5D与单链抗体(scFv)之间形成的复合物的结构,并发现GPRC5D的整体结构和经典的GPCR一样采用典型的七跨膜(7TM)折叠。

scFv与GPRC5D之间的结合界面
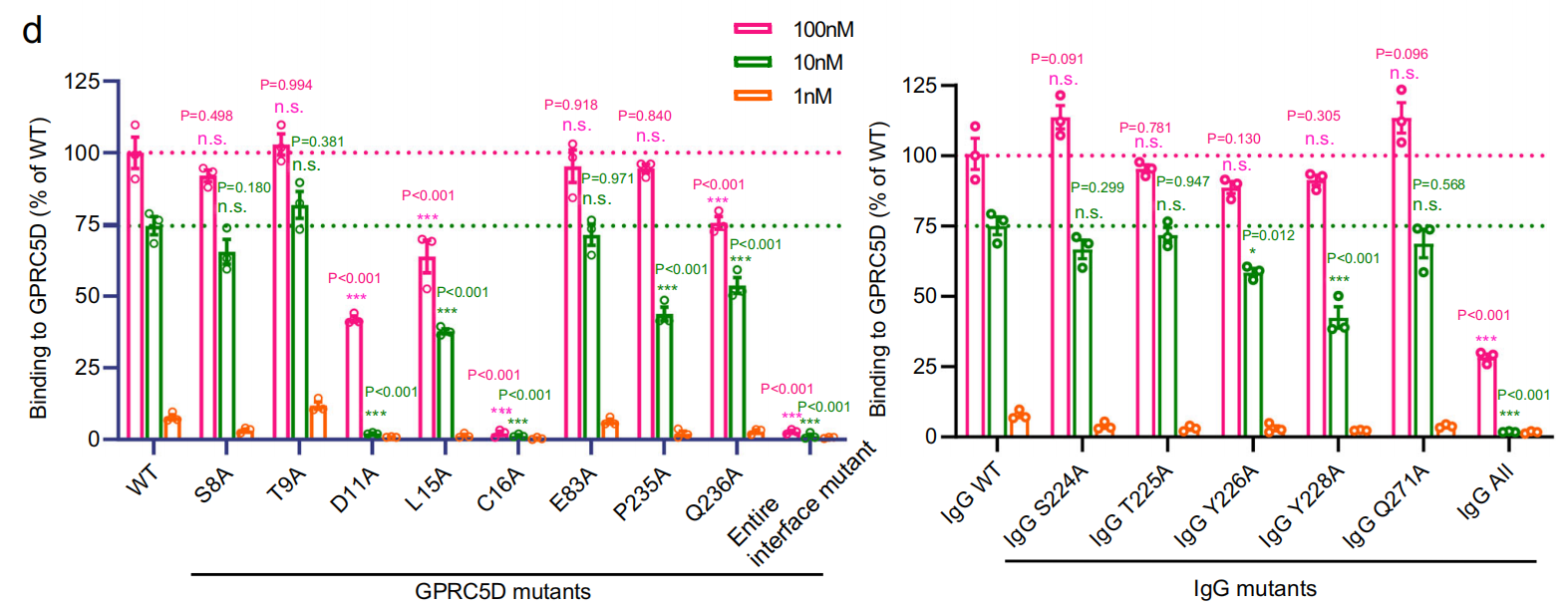
研究人员通过结构分析发现抗体结合GPRC5D的胞外区域,包括N端区域和3个细胞外环(ECL1、ECL2和ECL3)。GPRC5D胞外与抗体的相互作用主要由三对氢键介导,分别是Y226HCDR2和S8N-term;Y228HCDR2和C16N-term的主链羰基氧;T227HCDR2和Q236ECL3主链羰基氧。除此之外,其他的极性和疏水相互作用也对界面会产生影响。研究人员通过在GPRC5D的N端区域中引入组合突变来检测抗体和GPRC5D的结合能力,发现N端的突变几乎消除了GPRC5D和抗体的结合能力,表明scFv主要结合GPRC5D的N端。

研究人员在受体和抗体的近端残基上设计单个突变,对参与氢键形成的残基进行突变,发现大大削弱了抗体的结合,表明这些氢键相互作用对受体抗体结合的重要性。对GPRC5D-抗体相互作用的结构洞察可以指导更好的抗体疗法的设计和开发。
GPRC5D是非典型C类GPCR
GPRC5D的N端胞外区域相对较短,它的拓扑结构和A类GPCR相似,但是研究发现GPRC5D与A类GPCR跨膜区的序列形似性低。相反,它和C类GPCR的跨膜区序列的相似性较高。结构分析表明,尽管缺乏一个大的N端胞外VFT结构域,GPRC5D的跨膜结构域更接近C类受体。与A类GPCR相比,我们观察到GPRC5D的TM3和TM5上发生了大规模的螺旋位移,并向7TM束的中心移动;与其他C类GPCR相比,GPRC5D的跨膜螺旋区明显具有总体相似性,除了TM3更靠近螺旋中心。通过序列相似性比对和结构分析,强调了GPRC5D在C类GPCR中的独特性质。

GPRC5D的跨膜区浅口袋和非活性构象
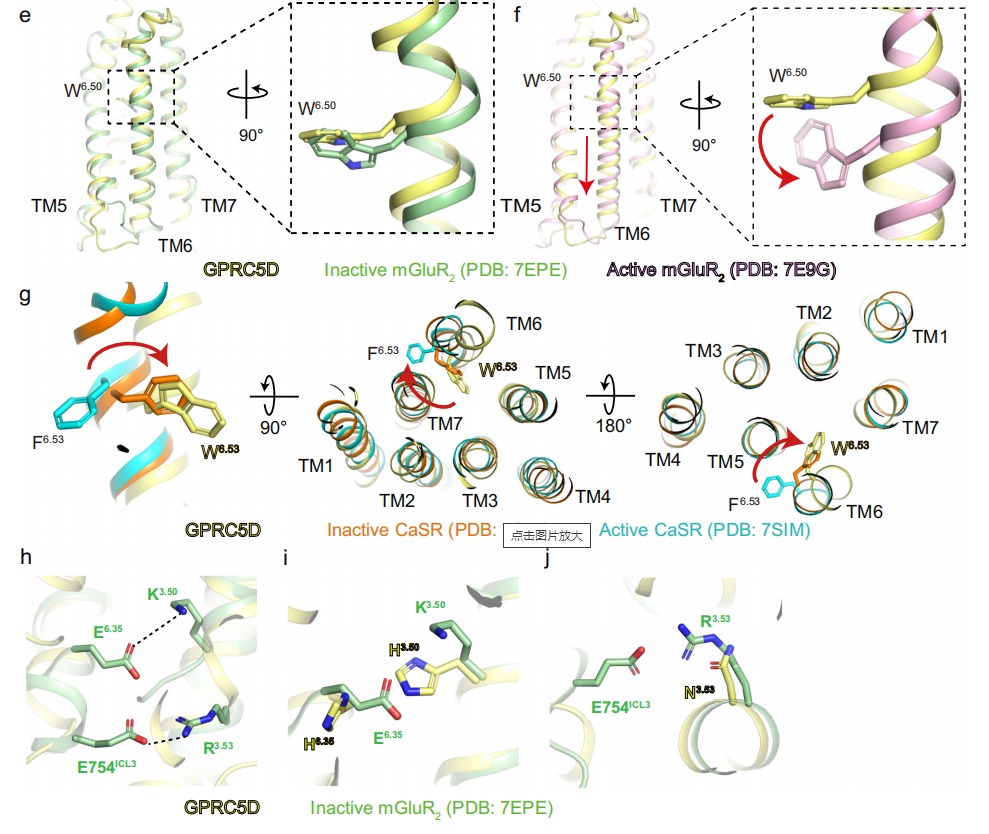
GPRC5D的跨膜区域存在一个浅口袋,这种浅口袋可能不利于配体的结合,因为F5.40和W6.53这对残基可能阻碍了配体进一步延伸到螺旋核心。冷冻电镜密度图中未观察到任何未知配体的密度,证实了GPRC5D结构处于无配体状态。通过与mGluR2在活性和失活状态的结构比较,发现GPRC5D的跨膜区域与非活性状态的mGluR2受体高度相似,表明GPRC5D可能处于非活性状态。
GPRC5D具有独特的二聚体界面
研究发现与大多数C类受体的二聚体界面位于N端细胞外VFT结构域不同,GPRC5D的二聚体界面位于跨膜螺旋TM4区域。GPRC5D的二聚体界面主要由两对氢键和一系列疏水相互作用介导。其他C类受体相比,GPRC5D采取了“头对头”的二聚体构型,而不是“尾对尾”的构型。

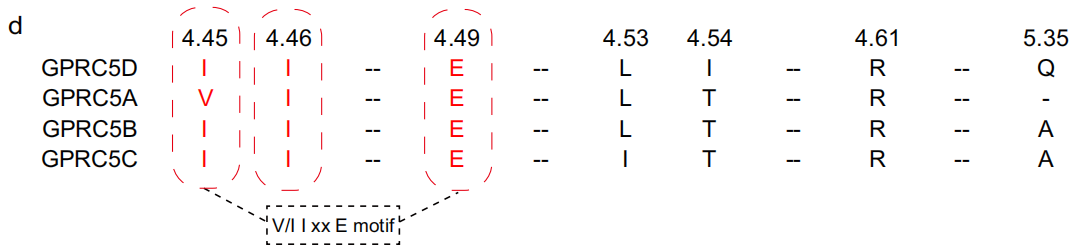
研究人员提出,GPRC5D二聚体界面中的V/I4.45I4.46xxE4.49氨基酸序列可能代表了GPRC5家族受体的一个保守的二聚体界面结构域。这一结构域在GPRC5家族内部有一定程度的保守性,但在整个C类受体家族中缺乏保守性。
总结
GPRC5D是一种的非典型的C类孤儿蛋白偶联受体,和经典的C类受体相比,它不仅具有短的N端胞外区,还具有独特的二聚体界面,与其他GPCR的序列相似性有限,这对发现内源性配体和探索GPRC5D的激活机制提出了挑战。然而,GPRC5D和scFv之间的特定结合界面和分子相互作用细节可能会加速针对GPRC5D的靶向抗体疗法的开发,利用计算和人工智能辅助方法,为多发性骨髓瘤的治疗带来希望。
