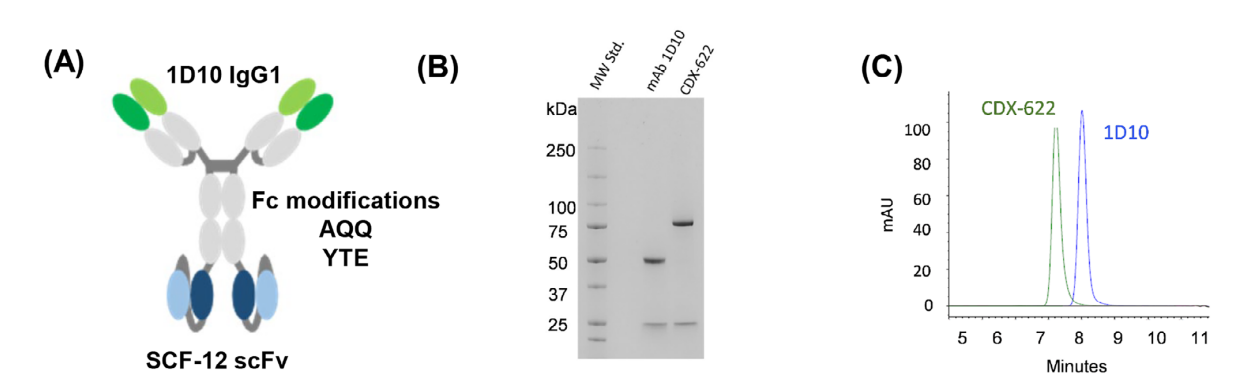
背景
基于生物学的针对细胞因子途径的治疗在许多炎症性和自身免疫性疾病中已显示出显著的临床益处。许多这类疾病在本质上具有异质性,通常由多种细胞类型、途径或机制驱动,这从根本上限制了针对单一靶点的治疗效果。使用多特异性抗体来靶向已知在特定疾病中发挥作用的非冗余途径,可能是一种有价值的策略,以改善疾病结果。肥大细胞(MC)对驱动过敏和炎症性疾病的一系列过敏原反应。干细胞因子(SCF)是受体KIT的配体,是MC存活和功能所必需的。胸腺基质淋巴细胞增多素(TSLP)是一种警报蛋白,可促进哮喘和其他炎症性疾病中的2型炎症。

2025年2月20日,研究人员在Allergy上发表了一篇名为“Dual Inhibition of Mast Cells and Thymic Stromal Lymphopoietin Using a Novel Bispecific Antibody, CDX-622”的研究,该文章描述了一种靶向SCF和TSLP的双特异性抗体(BSAB)CDX-622,以中和这些不同的细胞因子。 CDX-622通过SCF中和作用同时耗尽MCs,并通过TSLP抑制作用来抑制2型炎症反应。这些细胞因子的双重抑制可能会导致某些炎症性疾病的临床结果改善。

一种新型SCF中和单抗SCF-12的鉴定
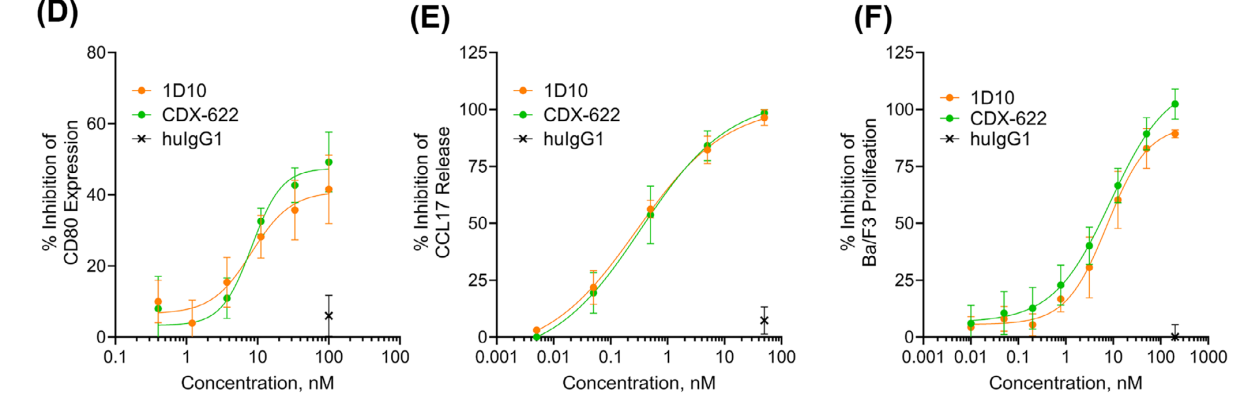
通过单B细胞筛选获得SCF-12单抗,SCF-12完全阻断了sSCF与纯化的人类KIT细胞外结构域(huKIT-ECD)的结合,具有低纳摩尔级效力。它表现出与抗KIT抗体barzolvolimab相似的效力。在稳定转染表达人类KIT的CHO-KIT细胞上连续稀释加入SCF-12和barzolvolimab,抑制了sSCF依赖性的KIT磷酸化(IC50 = 359±18 pM和IC50 = 641±133 pM)。此外,SCF-12和barzolvolimab还抑制了髓系白血病细胞系M-07e的sSCF依赖性增殖。在本实验中,SCF-12和barzolvolimab完全抑制sSCF增强的β-己糖氨酸酶释放(IC50分别为5.3±0.6 nM和5.4±0.6 nM)。
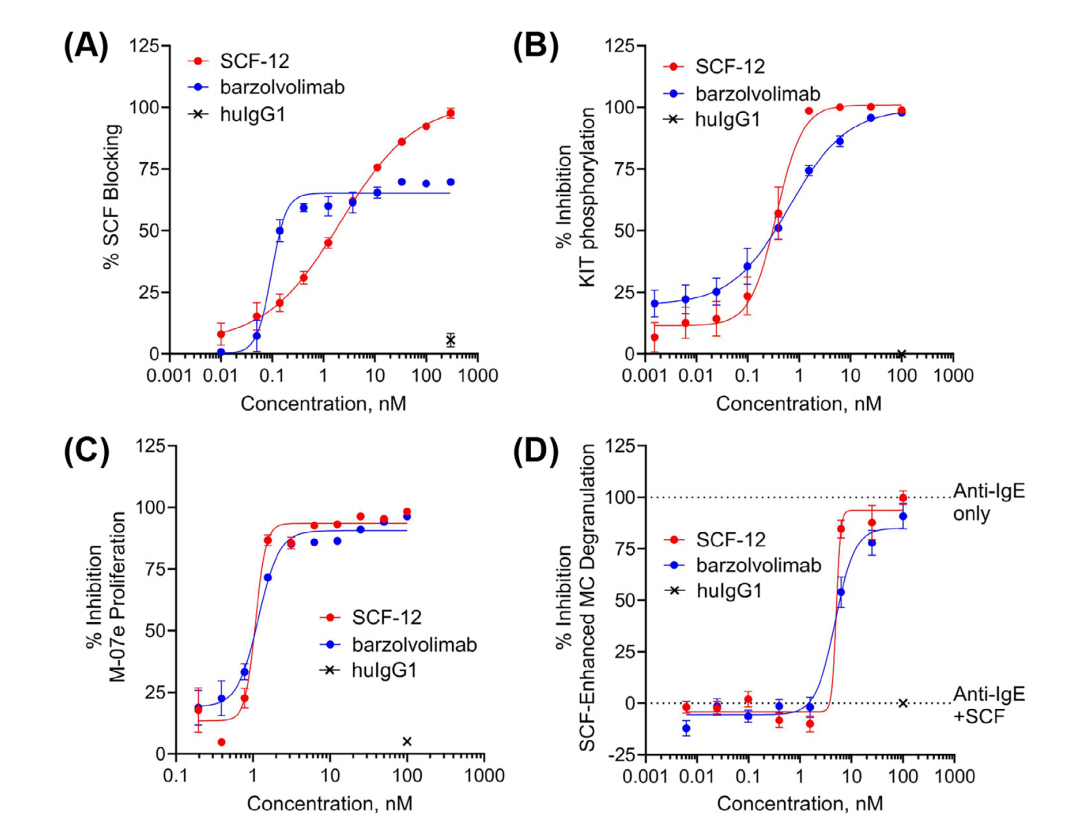
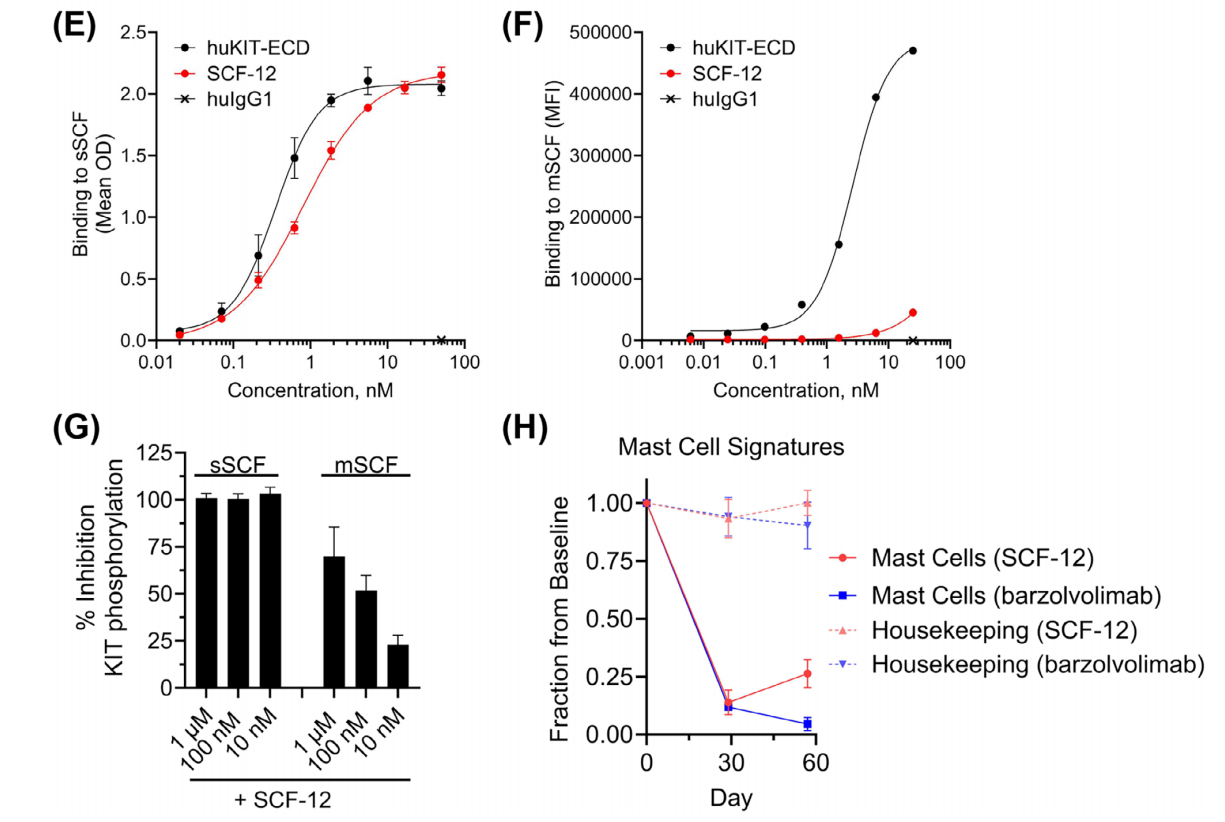
相对于mSCF,SCF-12优先结合并抑制sSCF。SCF-12与固定化sSCF结合,效价与huKIT-ECD相似(IC50 = 800±156 pM和350±72 pM)。SCF-12仅与转染表达膜相关SCF220变体(Sl/Sl4 SCF220)的Sl/Sl4细胞结合较弱。并且SCF-12仅部分抑制Sl/Sl4 SCF220细胞诱导的KIT磷酸化。SCF-12(n = 3)和barzolvolimab(n = 2)给药导致恒河猴中与MC相关的RNA特征显著减少。
一种新型TSLP中和单抗1D10的鉴定
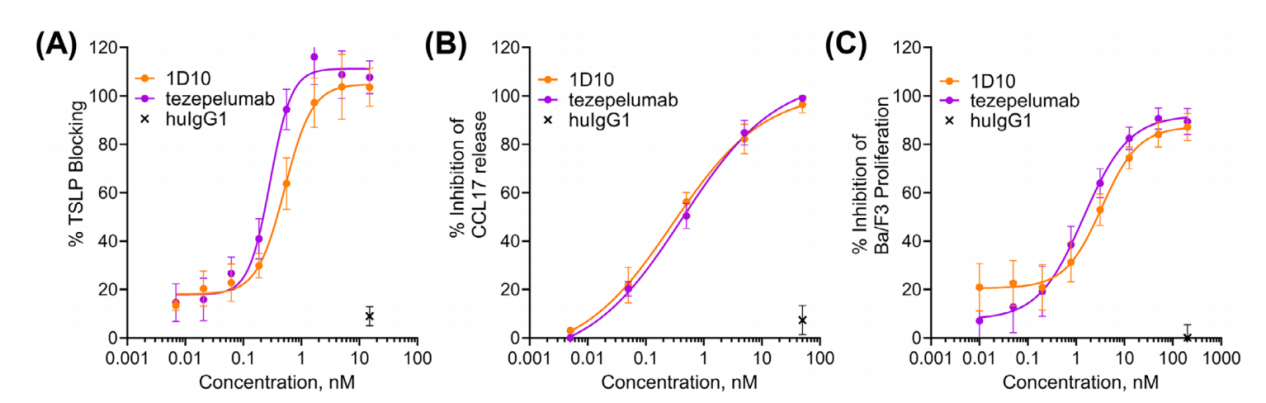
通过杂交瘤技术产生的TSLP单克隆抗体1D10通过人源化并纯化为IgG抗体,并显示出与Tezepelumab相当的中和活性。ELISA检测1D10和Tezepelumab阻断TSLP与固定化TSLPR的结合。1D10抑制TSLP介导的DC释放CCL17的能力与Tezepelumab相当。1D10和Tezepelumab阻断TSLP介导的Ba/F3细胞增殖。在体外功能分析中,1D10能有效中和TSLP依赖性活性。
CDX-622 bsAb的开发
CDX-622被开发为一种四价IgG1-scFv构建体,其中IgG是1D10,而scFv是SCF-12。它保持了与SCF和TSLP的高亲和力结合,并保留了单克隆抗体样特征。CDX-622编码全长1D10单抗和以VH-VL取向与1D10单抗重链C端遗传连接的SCF-12的scFv。
CDX-622的IgG1恒定区也被修饰,引入了AQQ(L234A/L235Q/K322Q)和YTE(M252Y/S254T/T256E)突变。引入AQQ突变可阻止Fcγ受体(Fcγr)相互作用、效应器功能和C1q受体结合,而YTE突变可增加FcRn结合,通过降低体内清除的速率改善药代动力学(PK)。
CDX-622在体外有效中和人SCF和TSLP的作用
通过体外实验发现CDX-622可以有效地阻断TSLP和sSCF的功能效应,其效力与亲本单克隆抗体相当。
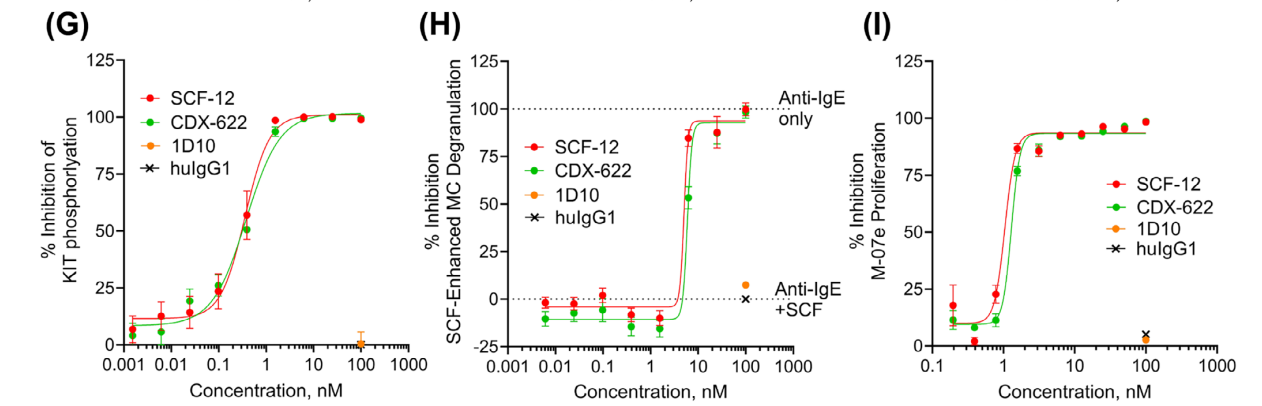
CDX-622中和SCF和TSLP依赖的功能
CDX-622的存在导致细胞因子释放完全或接近完全抑制,CDX-622显著地中和了sSCF和TSLP对人肥大细胞(MCs)的影响。
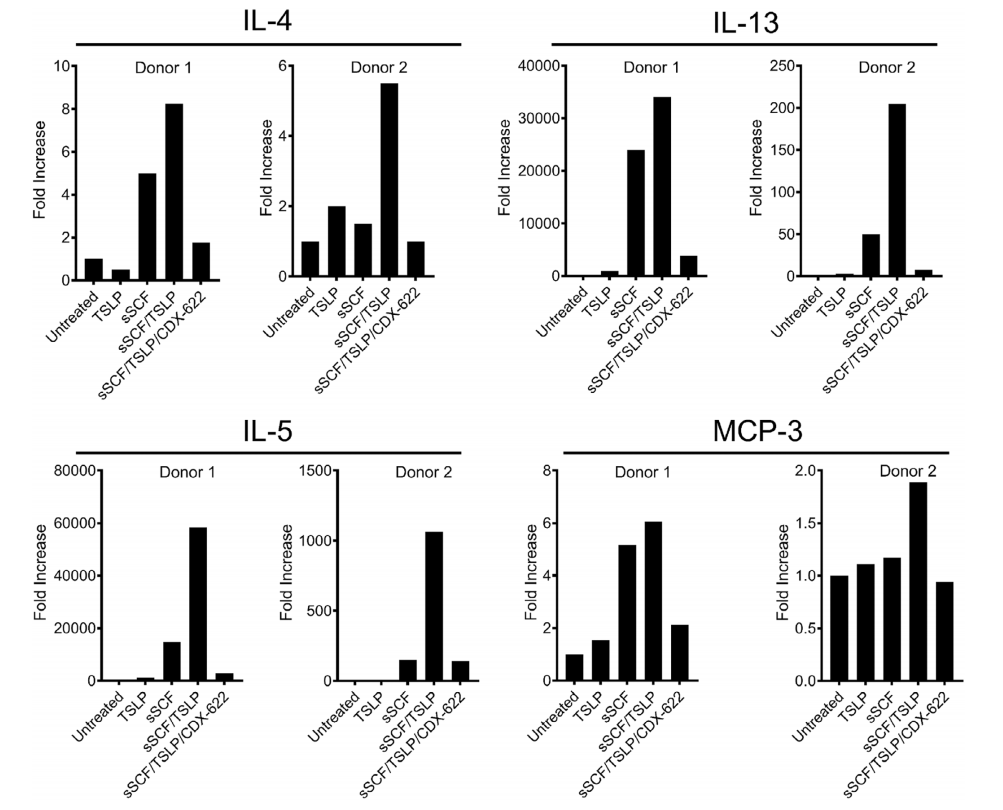
通过离体的人皮肤模型,研究了CDX-622抑制TSLP和SCF驱动的炎症反应的能力,发现给药CDX-622导致许多这些炎症途径的强烈下调。总之,这些数据证明CDX-622可以同时中和导致炎症的两种重要且不重叠的机制。

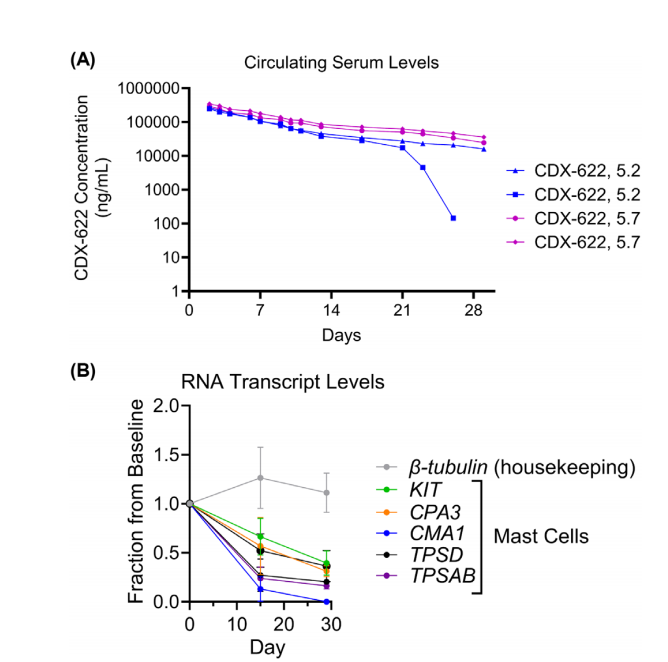
CDX-622在体内表现出单克隆抗体样的PK和抑制MCs
体内实验使用CDX-622人源化变体(5.7和5.2),其差异仅在于SCF-12 scFv使用了不同的人源化可变区,这两种bsAb在所有体外研究中表现相似。CDX-622耐受性良好,没有观察到任何临床或血液学参数的不良反应。PK分析显示,构建体5.7的两只动物的药物暴露时间延长(t1/2约14天),而构建体5.2处理的一只动物在第15天后产生了抗药物抗体,明显影响了暴露。CDX-622早在D15就导致MC相关RNA特征显著降低,并持续到D29。这些数据表明CDX-622具有良好的产品前景,并表明它可以导致与预期机制一致的MCs的深度抑制。