抗体药物偶联物(ADC)是一种有前景的癌症治疗方式,能够选择性地将有效载荷(Payload)细胞毒性分子递送至肿瘤,降低副作用的严重程度,理想的ADC有效载荷应具有足够的毒性、低免疫原性、高稳定性和可修饰的功能基团,本文对ADC中的一些常用Payload进行了梳理,并进一步讨论了ADC有效载荷的未来研究方向。
抗体药物偶联物(ADC)是一种有前景的癌症治疗方式,能够选择性地将有效载荷(Payload)细胞毒性分子递送至肿瘤,降低副作用的严重程度。通常ADC由3个关键成分组成:抗体,连接子和有效载荷,所有这些因素都会影响ADC的可给药特性,如抗肿瘤作用、药代动力学、稳定性和细胞毒性。ADC与肿瘤细胞上的靶抗原受体结合,形成ADC-抗原复合物,通过内吞进入细胞中,连接子在细胞内低PH值或溶酶体蛋白作用下断裂,释放细胞毒性荷载,诱导DNA损伤或影响微管结构来引发癌细胞死亡。
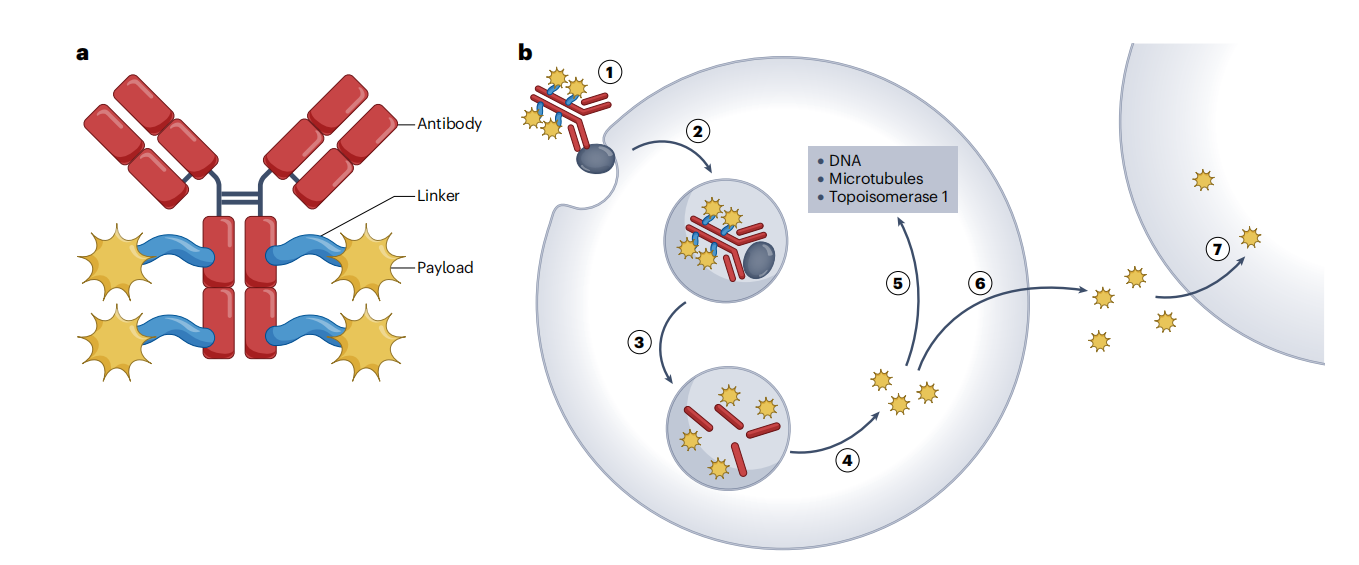
(数据来源 Dumontet C, et al. Nat Rev Drug Discov. 2023)
理想的ADC有效载荷应具有足够的毒性、低免疫原性、高稳定性和可修饰的功能基团。本文对ADC中的一些常用Payload进行了梳理,并进一步讨论了ADC有效载荷的未来研究方向。
ADC发展
ADC的概念最开始源于Paul Ehrlich提出的“魔弹”理论,并推测某些化合物能够直接到达细胞内的某些靶点从而治疗疾病,但直到1975年杂交瘤技术的发展开始用于生产单克隆抗体,才真正开始了开发ADC药物的时代。在技术日益成熟的推动下,ADC药物经历了三代创新:早期概念验证-解决药物异质性及稳定性问题-革新偶联方法。
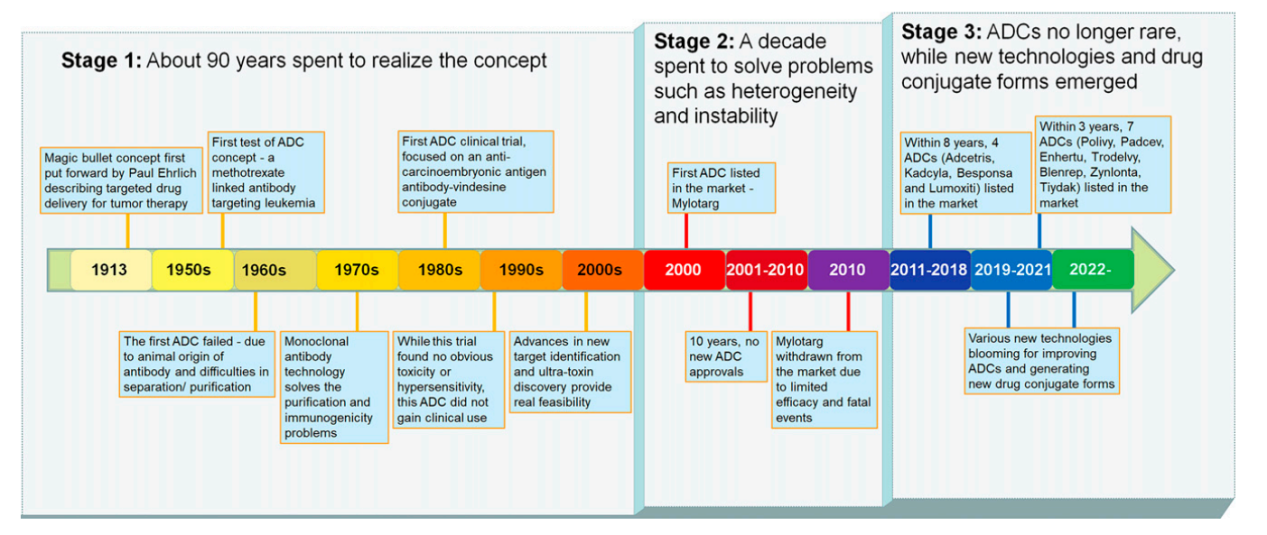
(数据来源 Jin Y, et al. Pharmacol Rev. 2022)
Payload特点
有效载荷(Payload)发挥ADC的细胞内细胞毒活性,通过接头部分与抗体共价结合的细胞毒性剂的性质非常重要,因为其作用机制将决定所得ADC作为抗癌化合物的效力及其可能的适应症。理想的有效载荷具备以下特点:具有足够高的细胞毒性;具有足够低的免疫原性;具有高稳定性;具有可修改的功能组,而不会显著影响其效力;具有旁观者杀伤效应;具有适当的水溶性;靶点应为细胞内,因为大多数ADC需要进入肿瘤细胞才能释放其有效载荷。
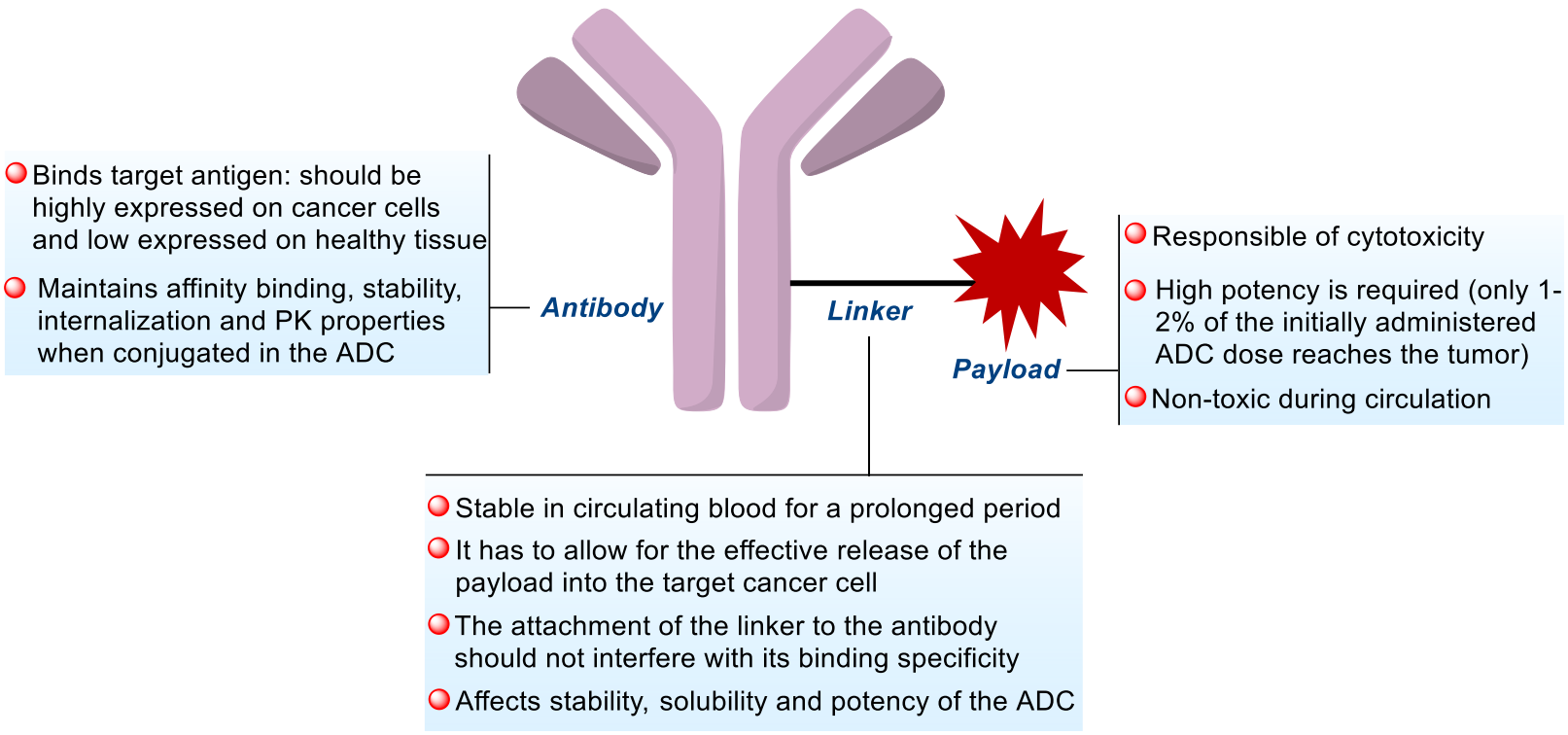
(数据来源 Cheng-Sánchez I, et al. Mar Drugs. 2022)
Payload的发展
在第一代ADC药物中,传统化疗药物如甲氨蝶呤、长春花碱和阿霉素被用作细胞毒性有效负载,然而,由于其对癌细胞的细胞毒性不足、缺乏肿瘤选择性以及在靶细胞中的积累较低,这些第一代ADC的疗效甚至比其亲本有效负载更差,导致其临床失败。大多数第二代ADC使用更有效的微管蛋白抑制剂作为有效负载。虽然微管蛋白抑制剂对于活跃分裂的肿瘤细胞非常有效,但它们对于静态癌细胞的效果要差得多。为了潜在地克服这一限制,大多数第三代ADC选择可靶向整个细胞周期的DNA损伤剂作为细胞毒性有效负载。DNA损伤剂可以通过双链断裂、烷基化、嵌合和交联破坏DNA结构来杀死肿瘤细胞。代表性的DNA损伤有效负载包括烯二炔、拓扑异构酶I抑制剂和吡咯并苯二氮卓类(PBD)。

(数据来源 Wang Z, et al. Acta Pharm Sin B. 2023)
Payload分类
ADC的有效载荷有两大代表:微管蛋白抑制剂和DNA抑制剂;其中DNA抑制剂又分为DNA损伤剂和拓扑异构酶抑制剂。
(Payload分类)
微管蛋白是微管的组成成分,微管蛋白抑制剂通过与微管蛋白结合,干扰微管的动态结合,使细胞停滞在细胞周期的G2/M期,最终导致细胞凋亡。相比于微管蛋白抑制剂,DNA抑制剂能够通过双链断裂、烷基化、嵌合、交联等方式破坏DNA,作用于整个细胞周期,产生细胞毒作用,对实体肿瘤有良好的治疗效果。DNA抑制剂的靶点远少于微管蛋白抑制剂,当ADC携带相同数量的载荷进入细胞时,DNA抑制剂能够表现出更好的杀伤效果。此外,以DNA抑制剂为载荷的ADC可以靶向抗原表达较低的肿瘤细胞,这也是为什么在许多下一代ADC中都选择DNA抑制剂作为载荷的原因。
微管蛋白有效载荷
常见微管蛋白有效载荷有四大类:海兔毒素类(例如,MMAE,MMAF);美登素类(例如,DM1,DM4);微管溶素类,软海绵素类(例如,艾日布林)(数据来源 Wang Z, et al. Acta Pharm Sin B. 2023; Conilh L, et al. J Hematol Oncol. 2023)。
海兔毒素类:在1987年从Dolabella auricularia中分离得到,对多种癌细胞有较强的抗增殖活性,能强烈抑制微管组装,导致细胞周期停滞和细胞凋亡,是一种很有前途的抗癌药物。其中应用最广泛的是MMAE和MMAF。它们各自含有一个功能性手柄,可进行后续结合,进一步提高体内疗效。MMAE包含四种氨基酸:单甲基缬氨酸(Me Val)、缬氨酸(Val)、多拉索氨酸(Dil)和多拉普罗因(Dap),以及羧基端胺基去甲麻黄碱。MMAF中单甲基缬氨酸的C端被苯丙氨酸取代,其细胞活性显著降低。与MMAE相比,MMAF对游离微管蛋白的结合亲和力提高了近5倍,这主要归因于β1微管蛋白亚基上关键的Arg278残基,该残基通过有序水分子暴露于MMAF。其中,有6款已经上市的ADC药物,使用了海兔毒素类有效载荷,例如,Brentuximab vedotin,Polatuzumab vedotin,Enfortumab vedotin,Belantamab mafodotin,Tisotumab vedotin,Disitamab vedotin。

美登素类:美登素最初是从非洲灌木Maytenus ovatus的树皮中分离得到,能够与微管蛋白结合,抑制微管的组装。在体外细胞活性测定中,其IC 50属于皮摩尔范围,显示了其强大的抑制肿瘤细胞增殖的能力,在其他实验中也表现出了良好的稳定性和溶解性。但由于其治疗窗口窄,且由于缺乏选择性而产生神经毒性、胃肠道反应等毒副作用,因此临床上已经禁止直接用于人体治疗。然而美登素的高细胞毒性完美地满足了ADC负载的要求,使美登素成为ADC负载的有力候选者。用3-甲基二硫丙基取代maytansine中的N-乙酰基,可以得到含二硫的maytansine衍生物DM1。通过在DM1二硫键周围添加两个甲基得到DM4。DM1和DM4通过含二硫键的连接子连接到抗体上,形成ADC。DM1和DM4是临床实际应用中最常用的两种美登素类 ADC负载,例如Trastuzumab-SMCC-DM1就是第一个获批上市的基于美登素衍生物的ADC药物。目前,20%在开发的ADC使用美登素衍生物作为负载。

微管溶素类:微管溶素Tubulysins是Hofle等人从粘菌培养基中分离出的一种天然抗有丝分裂肽。微管溶血素(Tut)又称微管溶血素A,是由N-甲基-d-哌可酸(mep)、利索莱因(l-ile)、微管缬氨酸(tuv)和微管丙氨酸(tup)组成的线性四肽,又称微管溶血素tut(tut),能抑制微管蛋白的聚合,诱导细胞凋亡,对癌细胞包括多药耐药的KB-V1细胞有较强的抗增殖活性(IC 50 = 0.08 nmol/L),在抗癌药物研发中具有良好的前景。2018年,KC Nicolaou团队合成了高效的微管溶血素类似物29和30,对HEK293T细胞的IC 50分别为6和3 pmol/L。 随后,微管溶血素类似物31,32,33,34被研究人员陆续设计出来,他们都具有作为ADC负载的潜力。

艾日布林:聚醚大环内酯的天然产物,Halichondrin B,最初从Halichondraria Okadai中分离,已被证明具有良好的抗增殖活性。其结构简化的新型非紫杉烷全合成类似物甲磺酸艾日布林是一种具有抗有丝分裂作用的微管动力学抑制剂,已于2010年获批用于治疗局部晚期和转移性乳腺癌(MBC)患者。艾日布林在肿瘤生物学中强大的抗有丝分裂活性使其有望成为一种有希望的ADC负载。Earl F. Albone团队通过在C-35伯胺基团上添加连接子,设计了一种以艾日布林为负载的ADC,对卵巢癌细胞IGBOV1有很强的作用(IC50为20 pmol/L)。在非小细胞肺癌细胞NCI-H2110异种移植模型中,5 mg/kg ADC剂量可诱导肿瘤完全消除,提示微管靶向药物艾日布林可作为ADC负载。通过在C32侧链上引入低碱性胺或增加艾日布林的亲脂性,得到的化合物27在体内外对多种异种移植肿瘤有抑制作用,具有口服生物利用价值,可增加脑脊液中的暴露量,可能为治疗脑肿瘤等更多种人类癌症提供药物候选物。

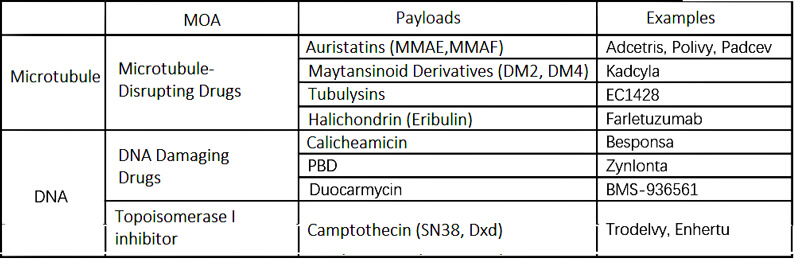
隐藻素:Cryptophycin是由蓝藻产生的天然大环多肽,具有16元环。它含有两个羟基酸(A和D单元)和两个氨基酸(B和C单元)。Cryptophycin不可逆地抑制有丝分裂期间的β-微管蛋白聚合,这可导致细胞周期阻滞在G2/M期并激活凋亡途径,从而在体外产生皮摩尔抗增殖能力。cryptophycin-52的类似物37(IC 50= 33 pmol/L)是一种非常有前途的临床候选药物,已由Eli Lilly公司获得专利。隐藻素-52中A单元的芳香环可以在不显著影响其生物活性的情况下进行原位修饰。这些修饰被Sanofi-Aventis用作抗体偶联的偶联点。杨金良团队将cryptophycin-52的前体药物CR55(CR55在生理条件下可转化为cryptophycin-52)与曲妥珠单抗偶联,在HER2阳性肿瘤细胞株中IC50为低纳摩尔水平(0.58–1.19 nmol/L),10 mg/kg相应ADC在卵巢癌(SKOV3)和胃癌(NCIeN87)异种移植模型中表现出显著的抗肿瘤活性,为基于cryptophycin-55和cryptophycin-52的ADC抗肿瘤药物的开发提供了思路。
EG5抑制剂:驱动蛋白(KSP/EG5/KIF11)是一种ATP依赖性蛋白,参与细胞周期G2/M期着丝粒的分离和双极纺锤体的产生,在有丝分裂中起重要作用。EG5在血液肿瘤(如AML细胞和弥漫性大B细胞淋巴瘤(DLBCL))和实体肿瘤(如乳腺癌、膀胱癌和胰腺癌)中的高表达与其预后不良有关,使其成为一个有吸引力的癌症治疗靶点。诺华公司开发了EG5抑制剂43、44,作为有效载荷与抗体结合,使用不可裂解的连接体靶向HER2。使用非细胞渗透性EG5吡啶抑制剂作为有效载荷,Anette Sommer开发了一种新型IL3RA靶向ADC,该ADC显示出有效和选择性的抗增殖作用。Carsten Terjung研究了一种新的EG5吡咯亚类抑制剂45作为ADC新型有效载荷的适用性。在尿路上皮细胞癌(UCC)异种移植模型中,这种ADC显示出高效,可完全根除肿瘤。

DNA靶向有效载荷
DNA靶向有效载荷可以分为DNA损伤剂和拓扑异构酶抑制剂,DNA损伤剂包括卡奇霉素类、PBD(吡咯并苯二氮卓)类、倍癌霉素类等。拓扑异构酶I抑制剂主要是喜树碱类衍生物,包括依沙替康、SN38与Dxd等。
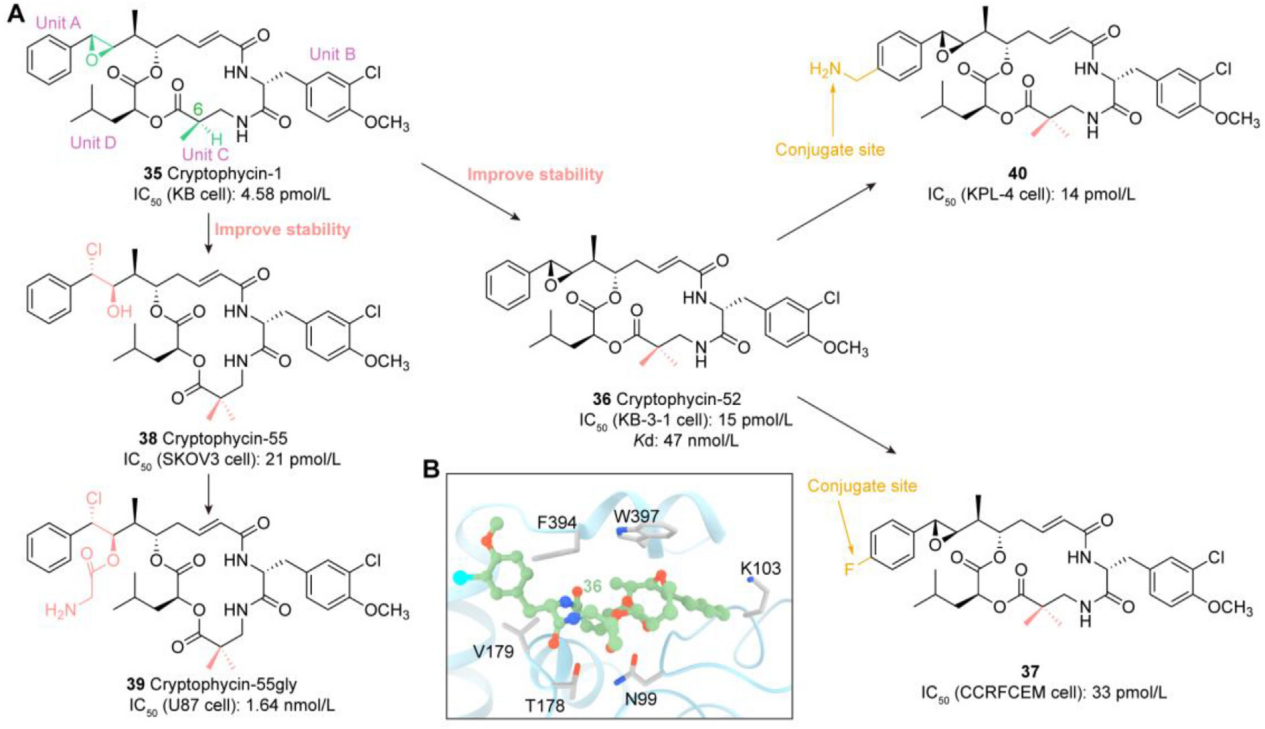
卡其霉素类:卡奇霉素靶向与DNA结合的小沟,特异性诱导DNA双链断裂,导致细胞凋亡。尽管最初的实验显示出很强的活性,但卡奇霉素对正常细胞DNA的破坏阻碍了它们的临床进展。尽管如此,高细胞毒性、小分子大小和明确的作用机制使卡奇霉素成为有吸引力的ADC有效载荷。卡奇霉素γ I 1是目前研究最多的卡奇霉素。Calicheamicin gI 1具有很强的细胞效应,以Mylotarg为代表的adc的出现在很大程度上依赖于Calicheamicin gI 1的发现,其n -乙酰基衍生物成为Mylotarg的有效载荷。Nicolaou等合成了Calicheamicin qI 1,它是Calicheamicin gI 1的类似物,也适合用作ADC有效载荷。此外,FDA批准的Inotuzumab Ozogamicin(Besponsa)也是以calicheamicin作为有效载荷。
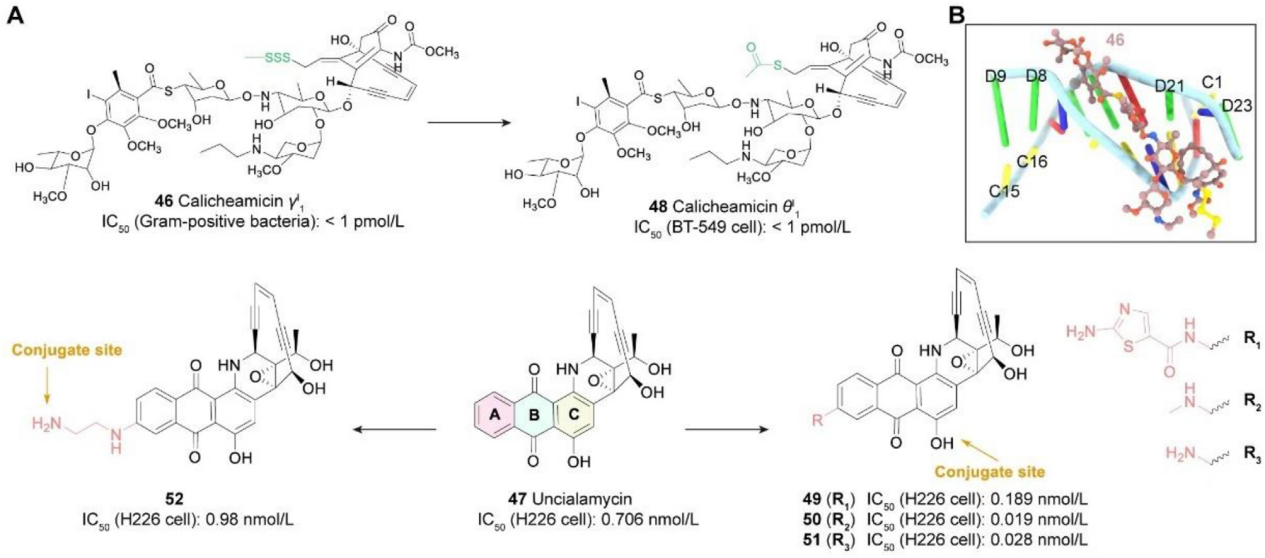
PBD类:链霉菌中发现的吡咯苯二氮卓类(PBD)是一类具有抗肿瘤活性的天然产物,其作用方式是在DNA小沟内选择性烷基化,鸟嘌呤的N2与PBD的亲电性N10/C11亚胺形成共价键,DNA链间交联造成持续的DNA损伤,导致细胞周期停滞在G2/M期,引起细胞凋亡,从而表现出强大的细胞毒作用。Zynlonta是第一款使用PBD类Payload的上市ADC产品,由ADC Therpaeutics公司开发。PBD二聚体具有作为ADC载荷的潜力,例如以PBD为载荷设计的靶向ROR1的ADC CS5001,在多种表达ROR1的肿瘤细胞系中表现出很强的选择性,并在血液和实体瘤异种移植小鼠模型中表现出显著的体内抗肿瘤活性,目前正在进行临床试验。

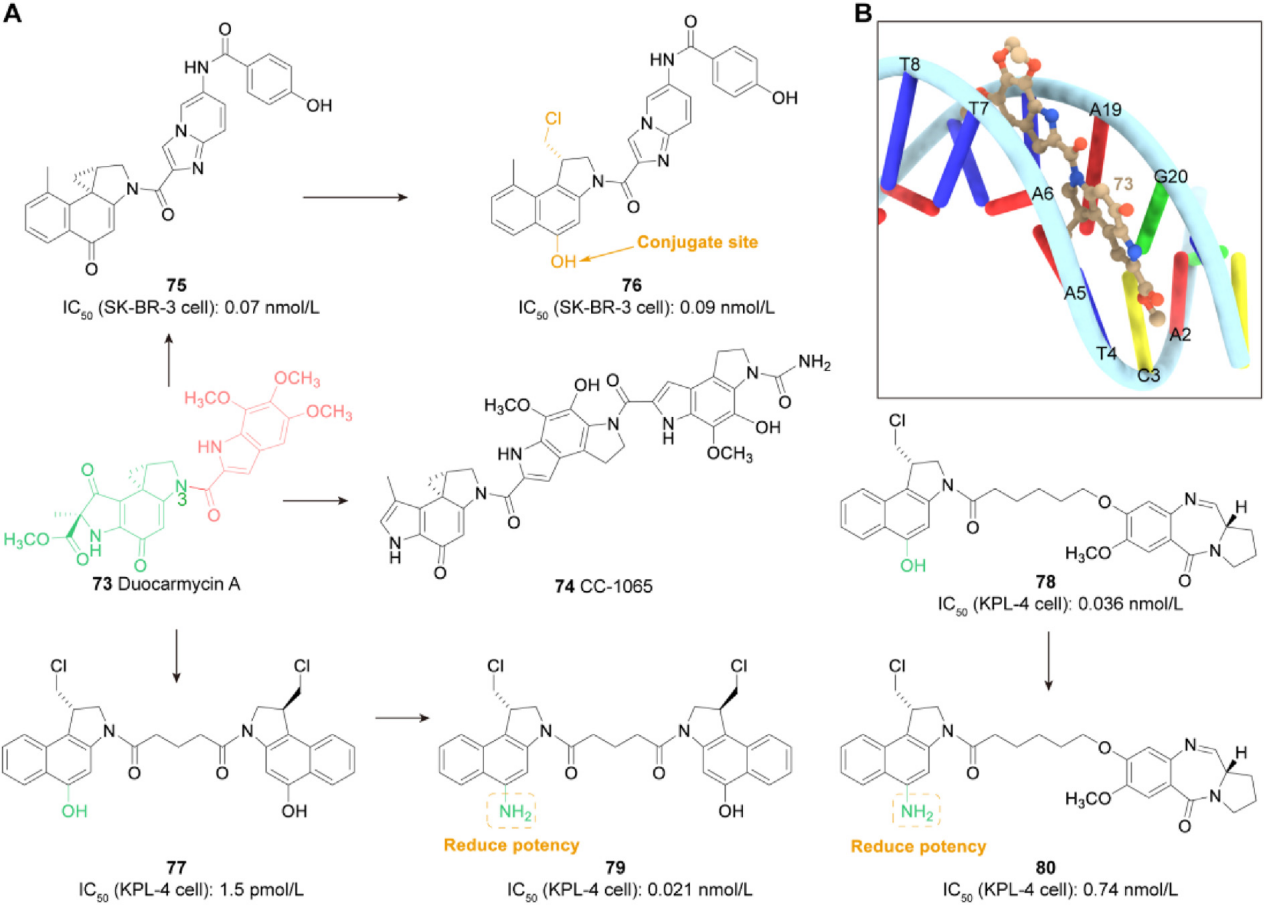
Duocarmycin:Duocarmycin A是从链霉菌中分离出来的一种强效DNA烷基化剂,由DNA烷基化部分和结合部分组成。通过其高活性的丙烷环与DNA微沟结合,并在N3位烷基化腺嘌呤,最终导致细胞死亡。Patrick H. Beusker 开发了一种基于Duocarmycin的用于还原链间二硫键的新型有效载荷。它与抗HER2抗体曲妥珠单抗结合,产生具有良好体内和体外特性的ADC SYD985。
拓扑异构酶I抑制剂:拓扑异构酶I抑制剂是FDA最新批准的抗体-药物偶联有效载荷家族。拓扑异构酶位于细胞核内。它们的作用是控制和修复DNA开放、上游转录和复制过程中发生的DNA超螺旋和缠结。这些催化酶可切割、修复超螺旋并重新连接DNA链。拓扑异构酶根据其切割活性分为两个家族:拓扑异构酶I切割单链DNA,而拓扑异构酶II切割双链DNA。拓扑异构酶抑制剂特异性结合DNA-拓扑异构酶复合物的界面,从而抑制拓扑异构酶修复机制,导致DNA损伤,进而导致细胞凋亡。该有效负载包括喜树碱(CPT)和非喜树碱基化合物。喜树碱(CPT)是一种天然植物碱,由五个化学环组成,水溶性较差。CPT衍生物最近被用作ADC有效载荷,因为它们具有中等细胞毒性,IC 50值在低纳摩尔范围内。迄今为止,两种CPT衍生物已成功与抗体结合并获得批准,DXd和SN-38。
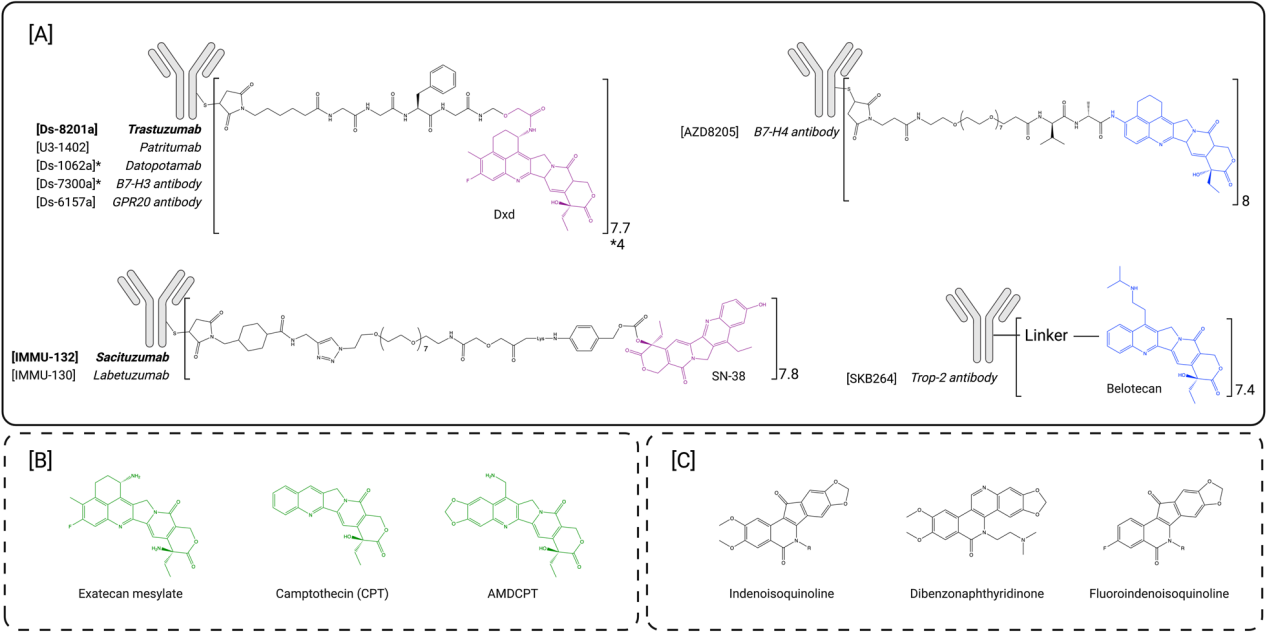
DXd是exatecan的衍生物,与CPT相比,该化合物活性更高、溶解性更好。研究发现,这种新化合物保留了exatecan的效力,同时能够使每个抗体成功生物结合多达8个DXd分子,而不会出现严重聚集。尽管DXd有效载荷表现出比exatecan mesylate更低的被动膜通透性,但发现其骨髓毒性较低。Trastuzumab deruxtecan由已获批准的HER2靶向抗体Trastuzumab组成,通过基于maleimide的mc-GGFG-am蛋白酶可裂解接头连接至8个DXd有效载荷。这款创新的DAR8 ADC由于其优化的连接体和有效载荷,与第一代ADC相比,其临床前治疗窗口有所改善。exatecan已在临床前被探索为潜在的ADC有效载荷,可以在较高的DAR值下结合,而不会干扰ADC的药代动力学特性,这些ADC在肿瘤异种移植中表现出强大的抗肿瘤活性,exatecan比DXd具有更好的被动细胞通透性,与基于deruxtecan的ADC相比,其表现出更强的旁观者杀伤作用。
非常规ADC有效载荷
除了上述描述的一些常规的ADC有效载荷,临床上还有许多非常规的有效载荷,例如,拓扑异构酶II抑制剂,RNA聚合酶抑制剂、Bcl-xL抑制剂和免疫刺激剂。此外,糖皮质激素现在正成为用于肿瘤学以外适应症的ADC有效载荷。
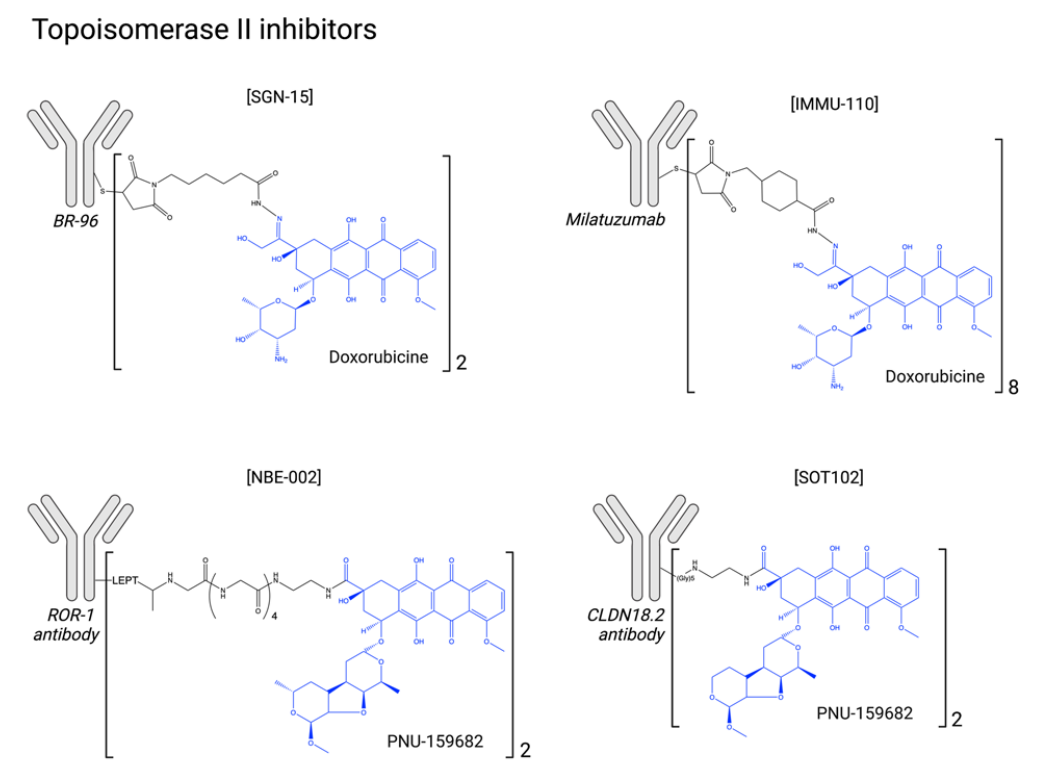
拓扑异构酶II抑制剂:拓扑异构酶II抑制剂广泛用于血液系统恶性肿瘤和实体肿瘤的抗癌治疗。其作用机制复杂,可能不仅涉及直接抑制拓扑异构酶II活性,还可能涉及DNA插入、ROS诱导和线粒体破坏。其毒性包括骨髓抑制、胃肠道毒性,在某些情况下还会出现高度心脏毒性。
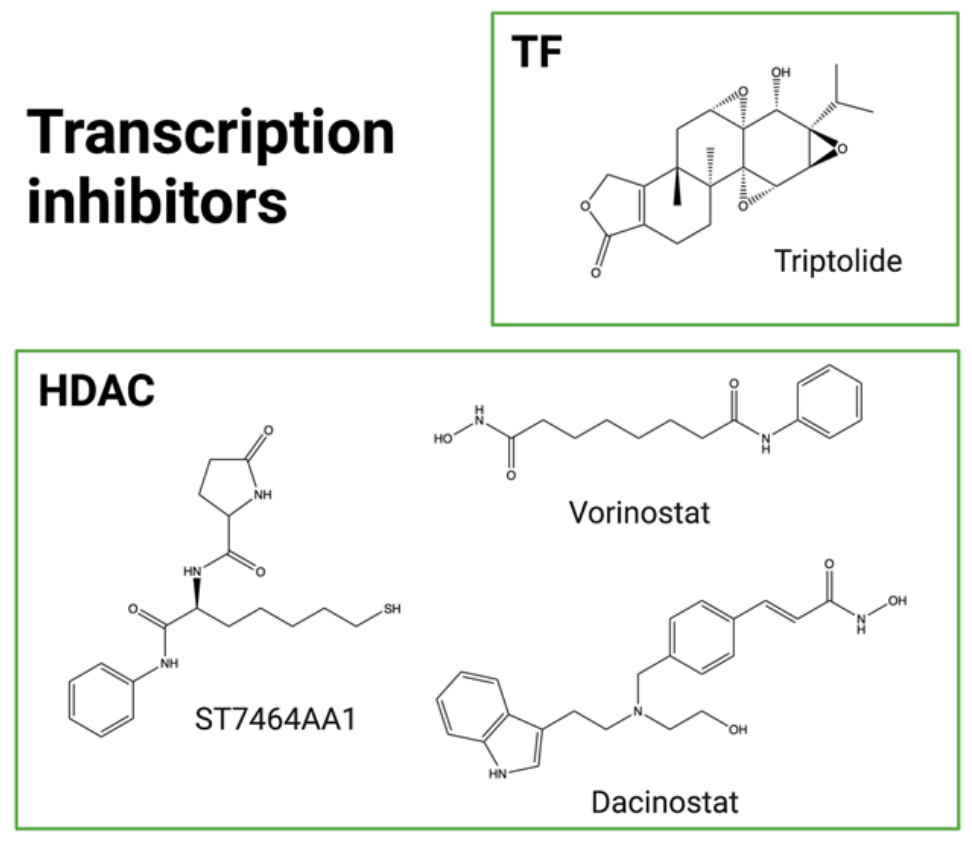
转录抑制剂:转录在细胞发育、活动和增殖中起着根本性作用,因此可以成为ADC有效载荷的创新和原始靶点。转录受RNA聚合酶II(RNApolII)调控,该酶直接与DNA结合,涉及与RNApolII 形成复合物以启动转录的转录因子(例如TFIIH)和介导染色质结构和可及性的共调节剂(例如组蛋白去乙酰化酶,HDAC)。虽然一些HDAC抑制剂已获得批准,但由于耐受性差,目前尚无 RNApolII抑制剂获批。Amanitin是从鹅膏菌中提取的天然强效RNApolII抑制剂。α-Amanitin和β-Amanitin以及其他七种大环衍生物构成了鹅膏毒素家族。尽管α-鹅膏毒素被广泛用作探索转录机制的实验室试剂,但其毒性过大,特别是对肝脏的毒性,无法进一步开发为抗癌剂。然而,这种分子作为潜在的ADC有效载荷具有许多优势,包括其原始的细胞内靶点、良好的物理化学性质(包括亲水性)、对外排泵不敏感,以及在静止癌细胞中产生细胞毒性的能力。2021年5月,首个Amanitin抗体偶联物HDP-101进入早期临床试验。HDP-101是一种针对BCMA的ADC,目前正在多发性骨髓瘤和浆细胞疾病患者中进行评估。ATAC最近被发现可以是一种免疫激活药物,它们被发现可以诱导免疫原性细胞死亡(ICD),并与ICI表现出协同作用,这为临床环境中联合应用的可能性开辟了新的视野。
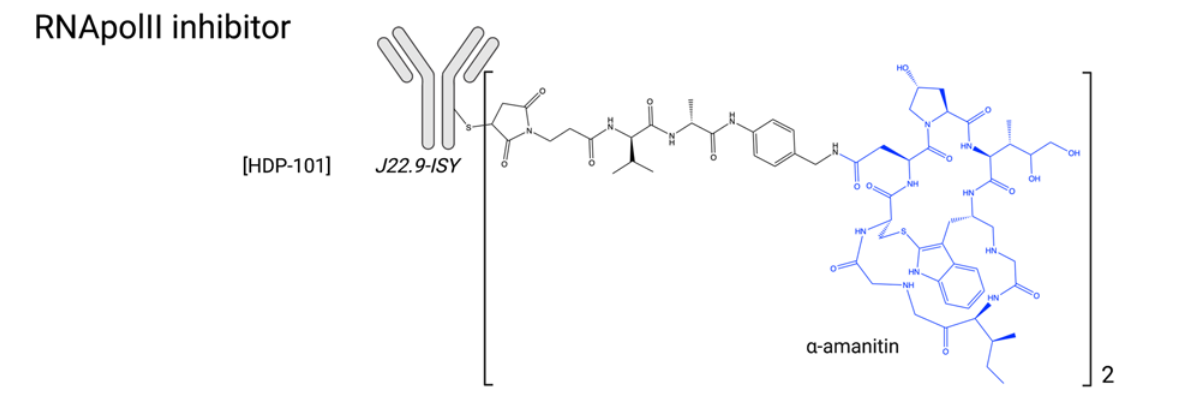
许多针对其他靶点(EpCam、HER2、PSMA、CD19)的α-Amanitin ADC在体外和体内均表现出强大的抗肿瘤活性。α-鹅膏蕈碱还与MMAE结合,形成双弹头。20世纪90年代还出现了其他高效RNApolII抑制剂,如鬼笔环肽和霉菌毒素单端孢菌素、疣孢菌素A和疣孢菌素A。

另一种阻止DNA转录的策略是抑制转录因子(TF)。在起始步骤中,TF对RNApolII附着在DNA 上至关重要。TF抑制剂(TFi)已经在水溶性前药minnelide的临床试验中证明了其抗肿瘤活性,目前处于II期评估(NCT04896073)。雷公藤内酯醇是一种从中药“雷公藤”中提取的天然化合物,具有很强的细胞毒性,但也具有疏水性,生物利用度差,毒性高。因此,人们正在努力开发具有更好药理化学性质的类似物。另一种策略是将这种分子与靶向实体结合,从而绕过这些问题。雷公藤内酯醇最近首次与抗CD26抗体结合,以靶向间皮瘤和淋巴瘤。这种不可裂解的ADC 可有效阻止靶细胞中的mRNA合成,并表现出良好的体外和体内抗肿瘤活性。还开发了一种西妥昔单抗-雷公藤内酯醇ADC,用于治疗EGFR阳性肺癌。该ADC对EGFR过表达模型具有选择性,且毒性低于未结合的雷公藤内酯醇。西妥昔单抗-雷公藤内酯醇可有效诱导转录抑制,具有强大的体外和体内抗肿瘤活性。
HDAC(组蛋白去乙酰化酶)影响转录因子,因此参与包括转录在内的各种细胞过程。它们被发现在癌细胞中过度表达或过度激活,并被认为与增殖、迁移和侵袭增加有关。Vorinostat和dacinostat是FDA批准的HDAC抑制剂(HDACi)的两个例子。
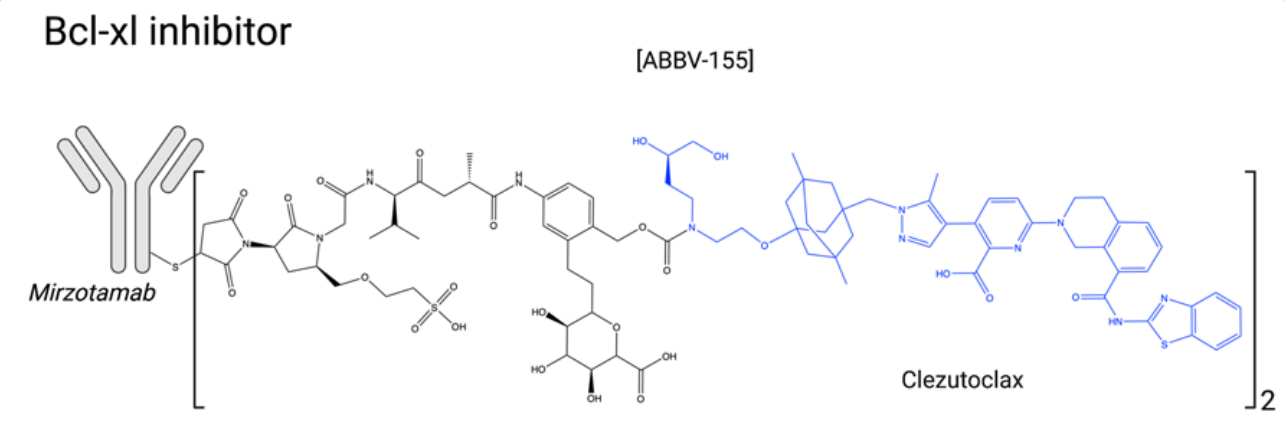
Bcl-xL抑制剂:Bcl-2家族成员可以是促凋亡蛋白(Bad、Bim、PUMA、Bik、Bak、Bax等),也可以是抗凋亡蛋白(Bcl-2、Bcl-xL、Bcl-w、Mcl-1等)。在癌细胞中,这些蛋白之间的平衡通常倾向于存活,这使得抗凋亡蛋白成为创新ADC有效载荷的有趣和原始靶点。Bcl-xL抑制与严重的血小板减少有关,这证明寻找高度特异性的Bcl-2抑制剂(如venetoclax)是合理的。目前,venetoclax被批准用于治疗慢性淋巴细胞白血病亚组和急性髓细胞白血病。ABBV-155(mirzotamab clezutoclax)是一种与Bcl-xL抑制剂clezutoclax结合的抗B7-H3抗体。这种创新的ADC于2018年进入正在进行的I/II期临床试验,作为单一药物以及与紫杉醇联合用于治疗晚期非小细胞肺癌和乳腺癌患者的晚期实体瘤。
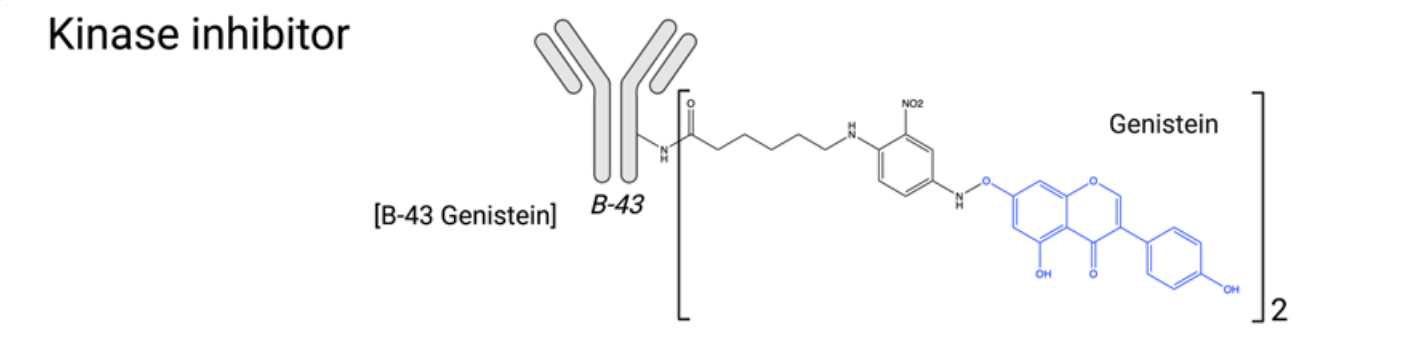
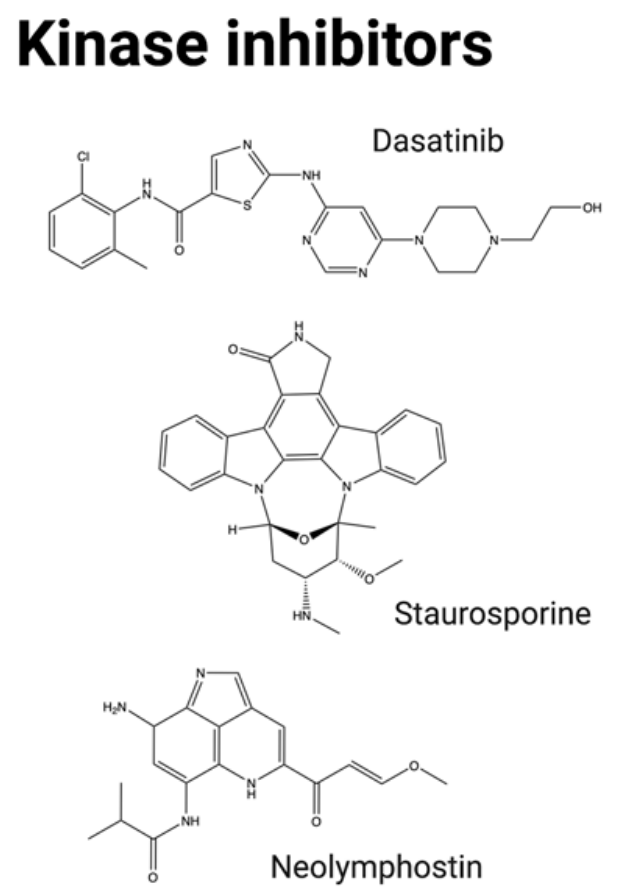
激酶抑制剂:蛋白激酶是催化磷酸化的酶,分为3类:丝氨酸、苏氨酸或酪氨酸激酶。目前临床试验中超过四分之一的小分子是蛋白激酶抑制剂,30多种FDA批准用于治疗癌症的分子是激酶抑制剂。在癌症中,多种激酶家族参与细胞周期进程、细胞增殖、运动和血管生成。虽然蛋白激酶抑制剂在癌症治疗方面得到了广泛研究,但作为ADC的有效载荷尚未得到广泛研究,可能因为它们的效力较低。抗CD19抗体B43已经与木黄酮偶联,发现木黄酮可通过抑制酪氨酸激酶受体表皮生长因子受体(EGFR)从而诱导细胞凋亡和细胞增殖抑制。体外和体内临床前研究表明,累积剂量为100 mg/kg时无毒性,且在小鼠模型中比标准化疗具有更强的抗肿瘤效果。这些有优异的结果使得其在1999年对ALL和NHL患者进行了临床研究。其在人体内呈现良好的药代动力学特征外,没有毒性,且有优异的抗肿瘤活性。然而,这种ADC药物的进展还没有进一步的报告。
最近,其他激酶抑制剂作为ADC有效载荷也进行了评估。包括neolymphostin(一种PIKK抑制剂),以及dasatinib和staurosporine(多激酶抑制剂)。但总体而言,ADC形式的酪氨酸激酶抑制剂的疗效目前被发现是有限的,该家族很难在晚期患者中获得成功。
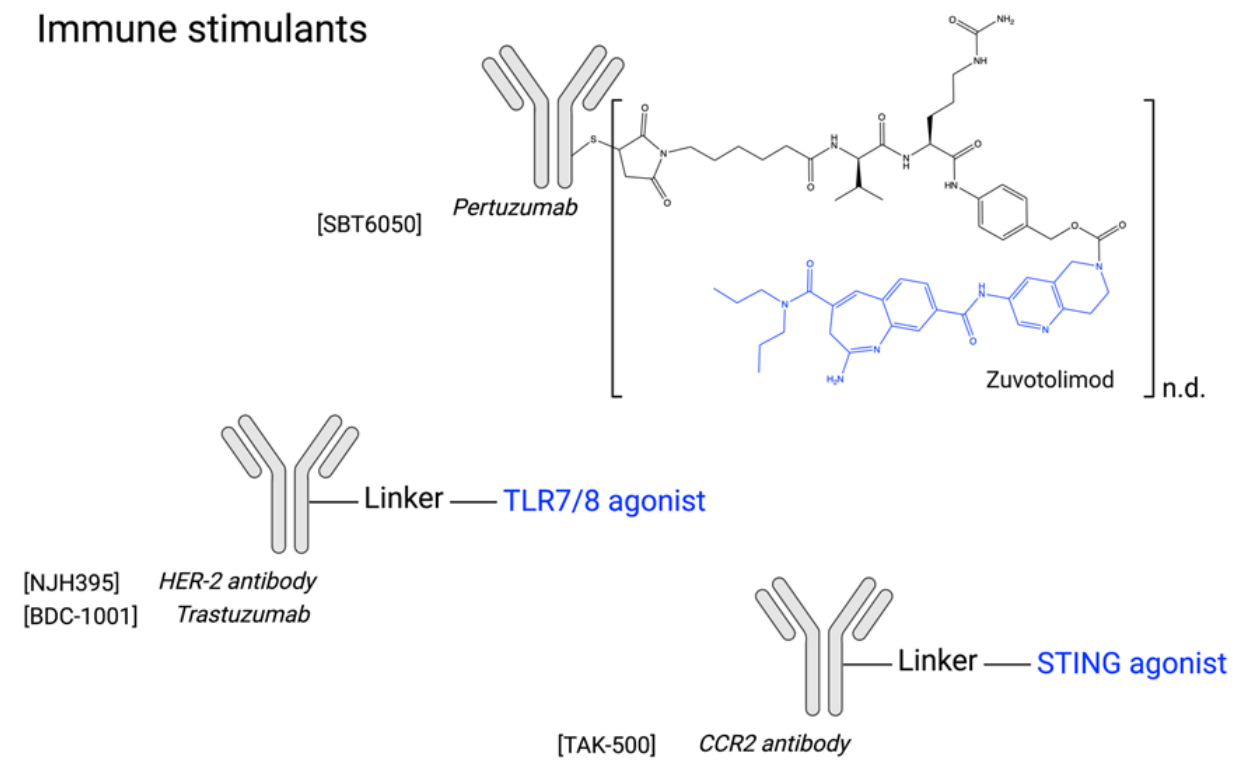
免疫刺激抗体偶联物:免疫刺激抗体偶联物代表了一类新的抗体-药物偶联物,目前有2种ADC 正在临床试验中(NJH395,BDC-1001),以及因申办方战略决策而终止临床评价的SBT6050(NCT05091528)。STING激动剂与TLR激动剂构成了结合免疫刺激剂的两大主要类别。针对适应性免疫系统的免疫检查点抑制剂的成功极大地增强了利用先天免疫系统的刺激的努力。然而,STING和TLR激动剂等最强效药物的全身给药与严重的全身毒性有关,由细胞因子释放综合征引起,因此当前的研究仅限于肿瘤内注射。因此,将它们与蛋白质或mAb结合似乎是一种有前途的方法,可以充分利用其强大的抗肿瘤潜力,同时改善耐受性。
新型ADC有效载荷设计策略
以PROTAC分子为有效载荷的ADC:ADC开发中的主要挑战与剂量限制性毒性(DLT)有关,这表明难以平衡药物治疗的疗效和脱靶毒性。ADC实际输送到肿瘤的药物剂量非常小,这意味着药物分子必须具有极强的细胞毒性,尽管这会导致毒副作用。PROTAC是一组双功能化合物,由靶向目的蛋白(POI)的配体、E3连接酶的配体和连接子组成。PROTAC将POI和E3连接酶拉近在一起,用泛素化标记POI,然后被蛋白酶体降解。PROTAC具有催化作用,因此可以在较低剂量下有效降解目的蛋白。PROTAC可能是ADC的理想有效载荷。抗体与PROTAC分子偶联形成的抗体PROTAC偶联物可以在特定细胞中特异性降解靶蛋白,实现PROTAC技术在细胞或组织水平的选择性。抗体-PROTAC偶联物结合了PROTAC的催化特性和ADC的组织特异性,从而克服了传统靶向降解剂和ADC的局限性,在靶向新靶点方面具有巨大的潜力。将靶向BRD4蛋白的PROTAC分子123与HER2抗体连接,可形成分子量约为150kD的抗体PROTAC偶联物,平均每个抗体分子上有4个PROTAC分子。

以NIR-PIT药物为有效载荷的ADC:近红外光免疫治疗(NIR-PIT)药物一般由靶向肿瘤的肿瘤特异性单克隆抗体和光激活化学物质通过连接体组成,本质上是ADC药物。NIR-PIT药物可以与照射红外光至肿瘤部位的装置一起,形成一个新的靶向抗癌平台,该平台使抗体介导的靶向递送达到高度的肿瘤特异性,同时利用红外光激活药物的生物物理机制,精准诱导癌细胞快速死亡,而不伤害周围的正常组织。NIR-PIT药物诱导的多克隆免疫反应可以消灭NIR-PIT药物第一步存活下来的肿瘤细胞,即使由于靶抗原表达不均匀导致NIR-PIT药物不足、递送不均匀或剂量不足,因为后续的第二步多克隆免疫反应也会杀死残留的肿瘤细胞。此外,NIR-PIT药物还可作为已有 PD-1单克隆抗体、PD-L1单克隆抗体或CTLA-4单克隆抗体的有益补充,增强其肿瘤免疫反应。NIR-PIT药物中的有效载荷不是细胞毒性物质,而是水溶性酞菁衍生物,例如,IR700。 当抗体与肿瘤表面抗原结合时,在近红外光的刺激下,IR700发生光诱导配体释放反应,释放亲水侧链,导致剩余部分的疏水性显著增加。这反过来会破坏细胞膜,引发针对癌细胞的快速、高选择性免疫原性细胞死亡(ICD)。
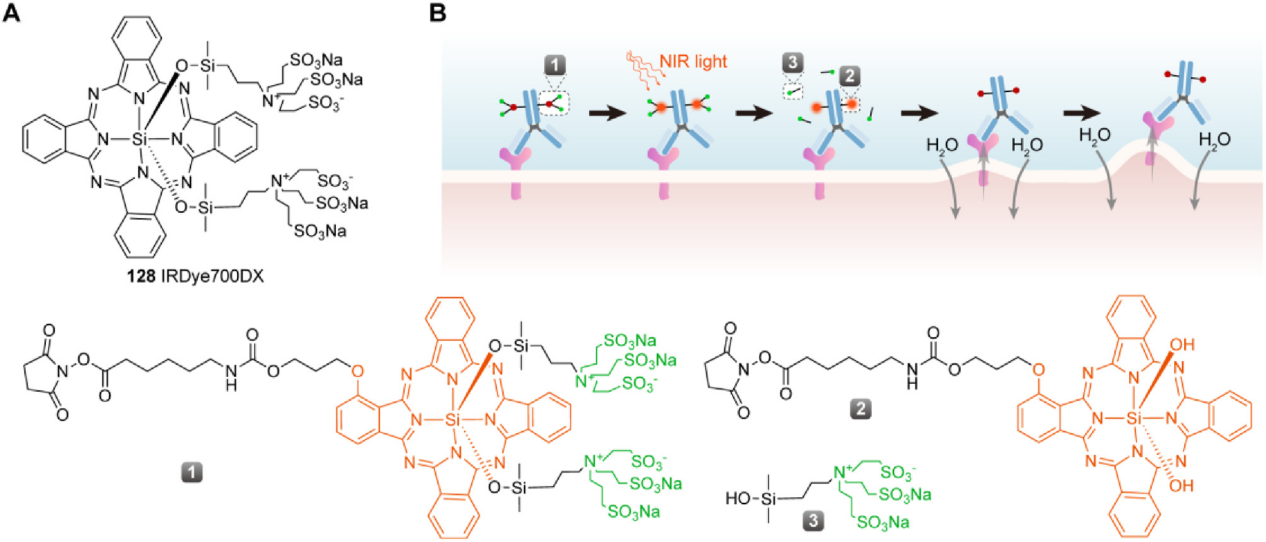
作为ADC领域的“冷门赛道”,光免疫ADC的临床和市场前景尚需经过时间的考验,但基于相关原理开发新靶点和新型光激活效应分子或将成为ADC赛道新的突破点。
双载荷ADC:随着ADC治疗耐药性的出现,将一种抗体与两种甚至更多种不同的细胞毒性有效载荷结合为开发下一代ADC提供了一个有吸引力的选择。为了证明双有效载荷药物ADC的优势,Levengood等人在2017年制备了一类含有两种不同微管蛋白聚合抑制剂的ADC。该团队将具有不同物理和化学性质的MMAE和MMAF与CD30抗体偶联,以发挥互补的抗癌活性。
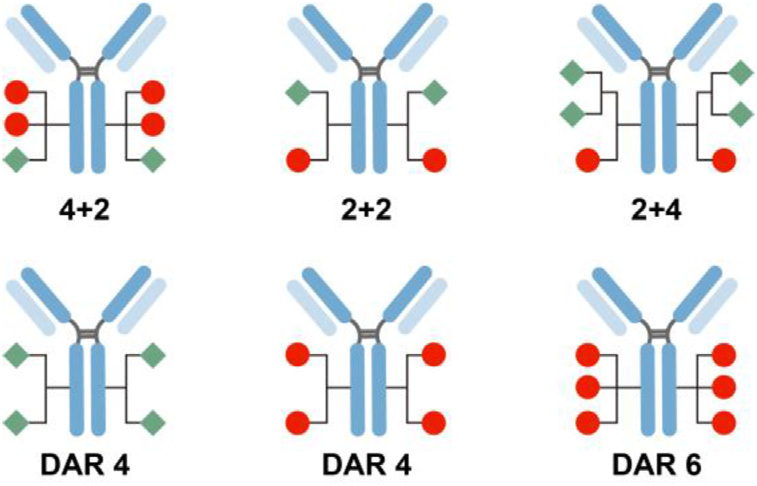
ADC药物经常会遇到肿瘤内异质性的问题,例如乳腺癌通常由多种具有不同基因表达谱的细胞组成,其异质性是化疗后产生耐药、复发和转移的主要因素。为了解决这一问题,Kyoji Tsuchikama通过化学酶联法高效构建了一系列具有明确药物抗体比(DAR)的双负载ADC(DAR组合分别为2+2、4+2和2+4)。
PDC的有效载荷:肽药物偶联物(PDCs)是一种新型的靶向治疗药物,由连接子、归巢肽和细胞毒性载荷组成。与ADC药物相比,PDC药物具有分子量小、肿瘤穿透力强、免疫原性低、可采用固相合成大规模合成、生产成本低、药代动力学相对较好、批次产品相对均匀等优势,是继小分子靶向药物、单克隆抗体和ADC之后的下一代靶向抗肿瘤药物。PDC的作用机制根据连接子和归巢肽的不同而不同,一是PDC被细胞内化并释放载荷。另一种是PDC在肿瘤微环境中被裂解,并将有效载荷内化以发挥作用。

PDC有效载荷可分为化学药物、蛋白质药物、多肽类药物。其中以化学药物和蛋白质药物较为常见。常用的化学药物有DM1、MMAE、KSP抑制剂、喜树碱、阿霉素、紫杉醇、甲氨蝶呤、柔红霉素等。蛋白质药物主要有干扰素和肿瘤坏死因子。放射性同位素也是常用的PDCs载荷。

小结
ADC药物开发前景广阔,因为它整合了特异性抗体以选择性靶向肿瘤细胞,结合了多种强效的细胞毒性载荷,并采用多样化的连接体技术来产生有效的癌症治疗药物。从技术角度来看,ADC药物至今已经历三代变革,在抗体、药物载体、连接体等方面均有突破,尤其是在有效载荷的使用上。有效载荷多样化将发挥关键作用,有效载荷多样化也有望为尚未从靶向治疗中获益的其他癌症打开ADC治疗武器库。通过对有效载荷的改造和新型有效载荷的发现,从而构建出更多提高疗效、克服耐药性、减少不良反应的ADC药物,推动ADC药物研究的发展。
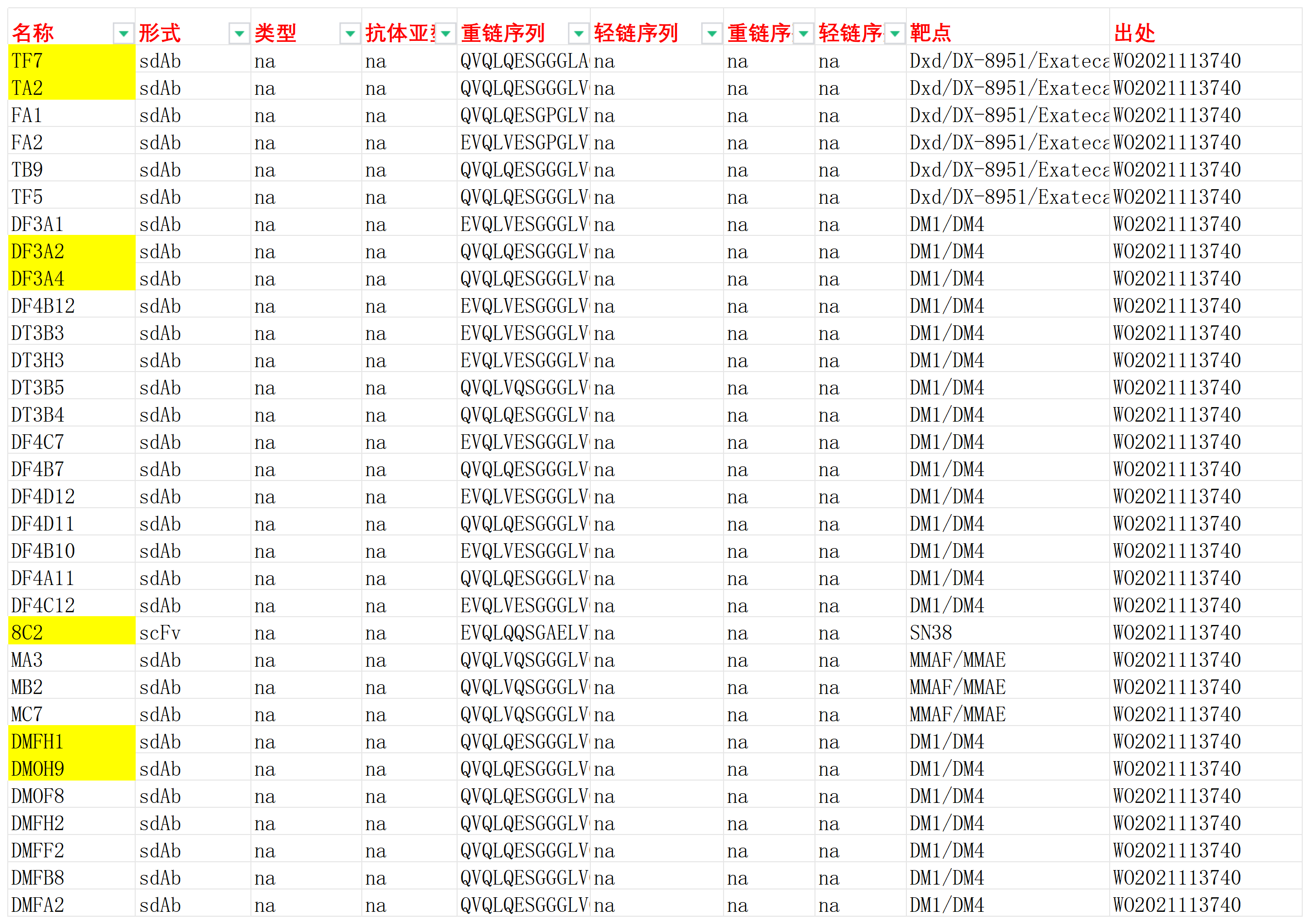
我们收集整理一批Payload相关抗体序列信息。文档可关注公众号”迈思生物”,号内回复“Payload”下载。