配文摘要
去除或者替换V结构域(VH/VL)的IgG1抗体,评估在HEK293细胞中的表达,组装和分泌,发现V结构域不启动HC-LC的组装和分泌;相反,控制IgG组装和分泌的关键因素是CH-CL配对。此外,VL结构域的完整性对IgG的分泌也至关重要。这些数据为基于IgG骨架的生物活性分子设计提供了有价值的见解。
背景
IgG抗体的CH1结构域通过内质网蛋白质量控制(ERQC)机制,由分子伴侣BiP介导,控制抗体的组装和分泌。然而,目前尚不清楚这一过程是否需要可变域。2024年5月2日,韩国亚洲大学的研究人员在Frontiersin Molecular Biosciences上发表了一篇名为“The dispensability of VH-VL pairing and the indispensability of VL domain integrity in the IgG1 secretion process”的研究成果,去除或者替换V结构域(VH/VL)的IgG1抗体,评估在HEK293细胞中的表达,组装和分泌,发现V结构域不启动HC-LC的组装和分泌;相反,控制IgG组装和分泌的关键因素是CH-CL配对。此外,VL结构域的完整性对IgG的分泌也至关重要。这些数据为基于IgG骨架的生物活性分子设计提供了有价值的见解。

抗体的组装概述
抗体是由2条重链(HCs)和2条轻链(LCs)组成,它们的正确折叠和组装是产生抗体的细胞分泌的先决条件。这些细胞的内质网质量控制(ERQC)机制确保只分泌正确组装的Ig分子,从而防止错误折叠和错误组装的免疫球蛋白(Ig)蛋白的分泌。ERQC机制在IgG同型中得到了最广泛的研究。新合成的Ig链首先通过链间二硫键在ER中以γ-H链(γ-hc)二聚体的形式组装。这些HC二聚体的cγ-1结构域保持未展开状态,并被分子伴侣子BiP保留在ER中,直到它通过与CL结构域的相互作用与两个折叠的LCs共价结合。折叠的CL结构域与Cγ1结构域的相互作用释放BiP,诱导Cγ1结构域的完全折叠和氧化,从而使HC和LC在分泌前组装成IgG(H2L2)结构。
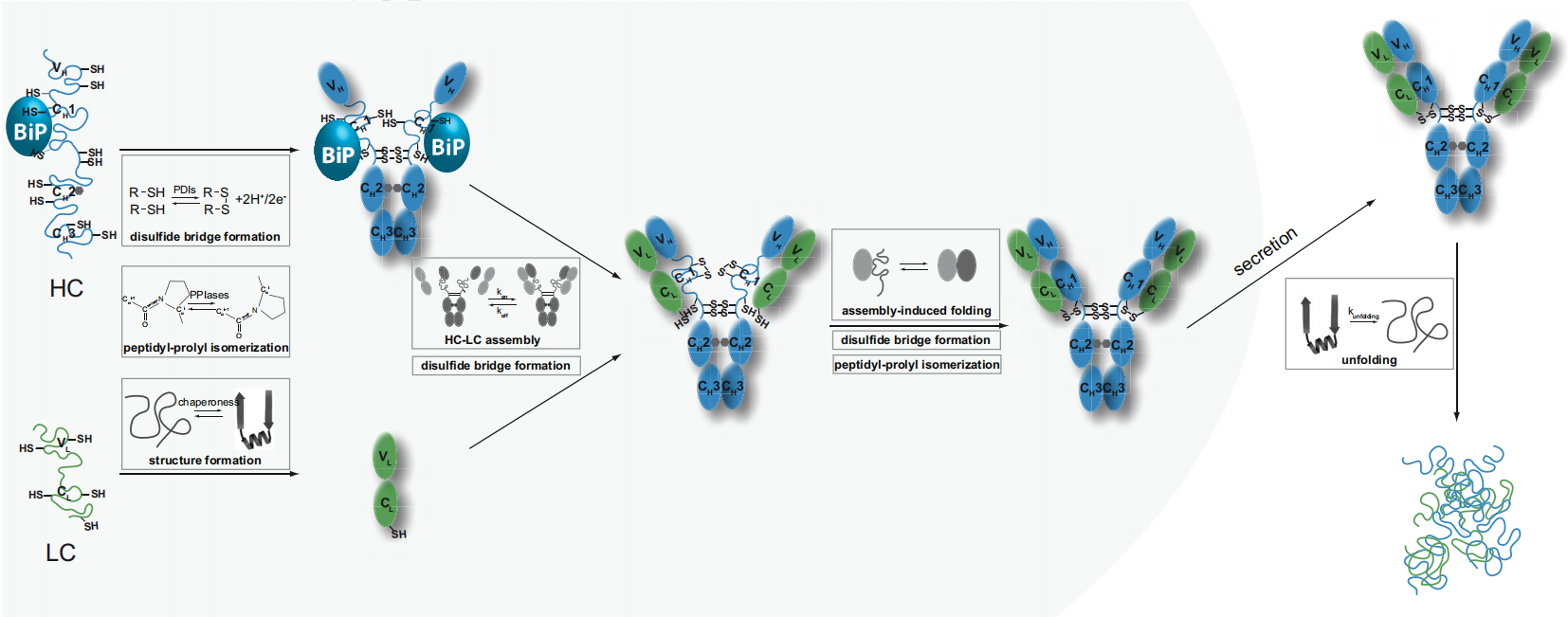
(数据来源 Feige MJ, et al. Biochim Biophys Acta. 2014)
VH和VL配对对于IgG的组装和分泌是不必要的
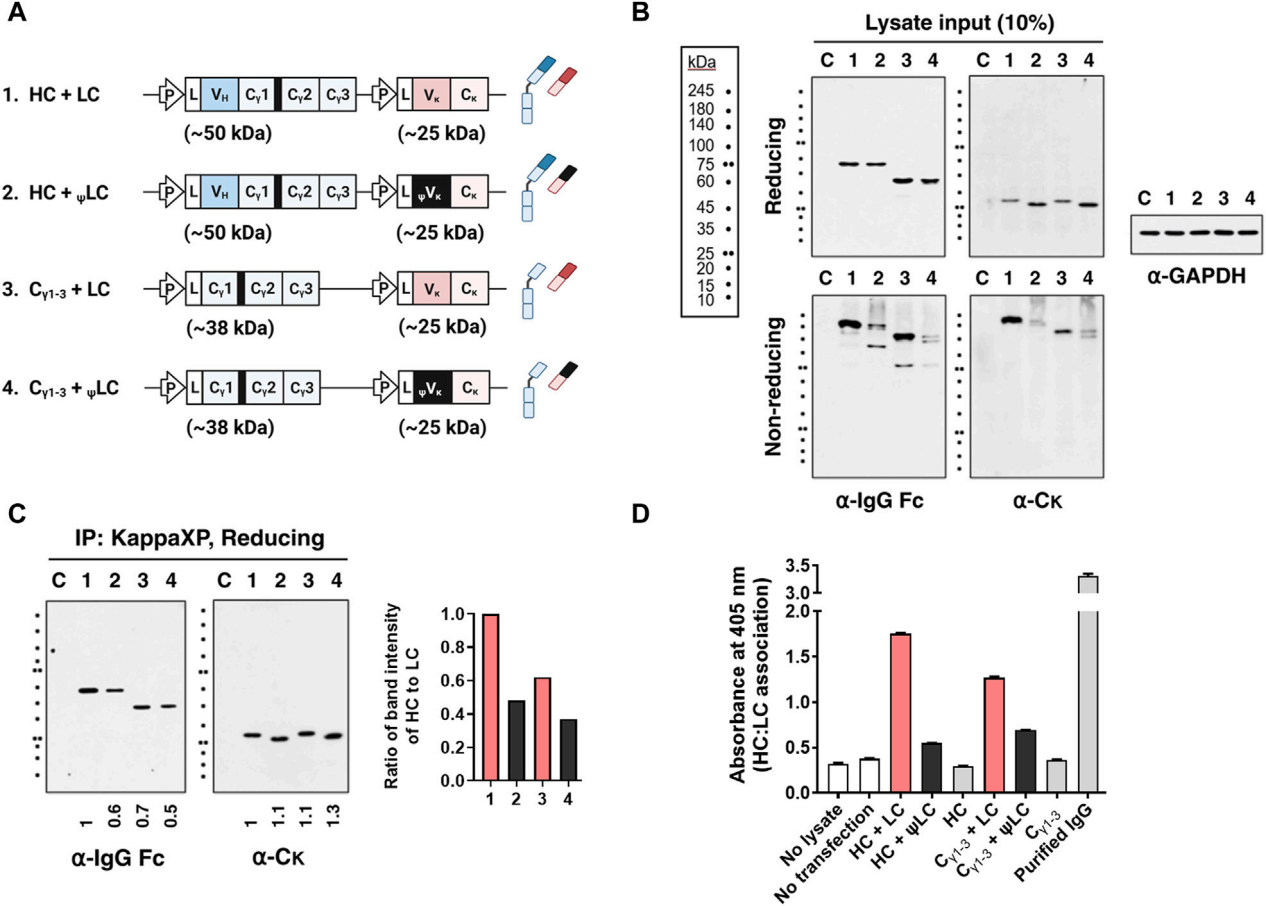
研究人员通过使用单载体策略生成结构域删除的变体来共表达HC和LC。随后,在还原和非还原变性条件下分析转染细胞的裂解物和上清液。结果显示,与野生型IgG HC相比,在没有VH、VL或两个结构域的情况下,HC和LC的表达水平相似。对上清液的分析表明,缺乏VH、VL或两个结构域的Igs以完全组装的形式分泌。这表明VH和VL链或它们的配对形式(VH/VL)对IgG的分泌能力而言并非必需。相反,Cγ1和Cκ结构域才是决定因素。

异常ψVκ结构域破坏Ig分泌
通过使用来自2C281杂交瘤克隆的伪型Vκ(ψVκ)取代了天然的Vκ结构域,其特征是由于CDR3的帧移突变而缺失FR4片段。鉴于FR4恰好位于Cκ结构域的上游,可以推测它对Cκ结构有重大影响。将携带ψVκ的LC命名为ψLC。然后研究了它们在四种HEK293细胞转染物上清中的分泌情况:(HC+LC)、(Cγ1-3链+LC)、(HC+ψLC)和(Cγ1-3链+ψLC)。发现当HCs和ψLC共表达时,无论是单独的,作为组装中间体,还是以完全组装的形式,它们都不会分泌到培养上清中。ψVκ结构域的异常会导致下游Cκ结构发生不利变化,阻碍BiP从Cγ1链上的解离,进而影响Cγ1链的正确折叠,最终导致完整IgG抗体无法分泌。

异常Vκ结构域阻止LC与HC结合
研究人员通过评估四种HEK293细胞转染物(HC+LC)、(Cγ1-3链+LC)、(HC+ψLC)和(Cγ1-3链+ψLC)的表达和组装,在细胞裂解物中,HC和ψLC的共价装配效率低于野生型IgG,可以观察到150 kDa IgG条带的减弱,以及出现多个大于IgG分子量的模糊蛋白条带。免疫共沉淀和ELISA分析进一步证实,与野生型LC相比,ψLC与HC(或Cγ1-3链)的结合效率降低了52%和40%。异常的ψVκ结构域导致了LC与HC之间的结合效率降低,从而阻碍了完整IgG的正常装配和分泌。
ψLC与BiP相互作用
在稳定表达融合HA标签的BiP细胞系中,转染编码wtLC、ψLC和Cκ的基因,与野生型HEK293细胞(仅含有内源性BiP)相比,用BiP-HA慢病毒颗粒转导的HEK293细胞的BiP表达(内源性BiP和BiP-HA)增加了1.5倍。发现无论HC是否存在,ψLC本质上无法分泌。观察到wtLC以单体和二聚体形式分泌,而Cκ则以二聚体形式分泌。与wtLC(Vκ-Cκ)不同,在没有HC表达的情况下,单个Cκ结构域的分泌水平几乎无法检测到。关于细胞表达,ψLC表现出比wtLC更高的表达。通过免疫共沉淀发现在细胞内,ψLC稳定地与BiP结合。表明VL结构域决定了BiP/LC复合物的物理稳定性。通过蛋白酶敏感性试验,以比较细胞中wtLC和ψLC的折叠状态,ψLC的降解速度比wtLC更快,表明与wtLC相比,ψLC处于非结构化状态。

ψVκ引起Fab结构改变
使用Discovery Studio 2020软件生成wt Fab和ψFab蛋白的三维结构;然后通过测量均方根偏差(RMSD)和Fab肘角与野生型Fab相比,发现ψFab的根均方偏差(RMSD)达到了18.3115 Å,表明两者的结构存在明显差异;野生型Fab的铰链角(elbow angle)为146°,而ψFab的铰链角为194°。这表明ψVκ域的引入导致了V区和C区域之间的相对位置发生了显著变化,整体Fab结构发生了重大重排。ψVκ域的异常结构导致了Fab整体构象的严重扭曲,这可能是导致含有ψLC的抗体无法正确折叠和分泌的重要原因。

小结
本文发现VH-VL配对对IgG1装配和分泌并非必需,控制IgG组装和分泌的关键因素是IgG分子内的CH -CL配对,VL区域的结构完整性对IgG分泌不可或缺。这些发现为设计基于IgG的生物活性分子提供了有价值的见解。
