IFNγ是一种细胞因子,是II型干扰素中唯一成员,在组织稳态、免疫和炎症反应以及肿瘤免疫监视中发挥重要作用,具有促癌和抗癌两面性。IFNγ受体发出的信号可激活Janus激酶(JAK)信号转导和转录激活因子1(STAT1) 通路,从而诱导具有关键免疫效应功能的经典干扰素刺激基因的表达。

(数据来源 Castro F, et al. Front Immunol. 2018)
IFNγ产生
在肿瘤微环境(TME)中,许多免疫细胞亚群,包括T细胞,自然杀伤(NK)细胞,调节性T细胞,辅助T1(TH1)细胞,CD8 +细胞毒性T淋巴细胞(CTL)都会产生干扰素IFNγ。不同细胞类型产生的IFNγ可以对其预期目标和TME内的旁观者产生独特且不同的影响。此外,这些细胞分泌IFNγ的方式,例如突触、渗漏突触或多向分泌,可以影响IFNγ产生的结果。

(数据来源 Gocher AM, et al. Nat Rev Immunol. 2022)
IFNγ结构:
IFNγ由146个氨基酸组成,IFNγ的蛋白结构主要包含α-螺旋,允许两个IFNγ分子通过非共价键以反平行方式二聚化,IFNγ同源二聚体通过与两个IFNγR1亚基和两个IFNγR2亚基结合形成一个六聚体复合物。

(数据来源 Mendoza JL, Escalante NK, Jude KM, et al. Nature. 2019)
IFNγ的信号通路和调控:
干扰素IFNγ的受体IFNGR由IFNGR1(α亚基)和IFNGR2(β亚基)组成,IFNγ和其受体结合可以激活典型的Janus激酶(JAK)-信号转导和转录激活因子(STAT)信号通路。受体相关的Janus 激酶(JAK)的激活导致IFNγR胞质结构域中的酪氨酸残基磷酸化,从而产生招募信号转导子和转录激活子1(STAT1)的识别底物。STAT1的酪氨酸磷酸化促进二聚化、核转位、DNA与IFNγ 激活位点(GAS)元件的结合以及STAT1二聚体的转录激活。除了诱导与GAS元素结合的STAT1二聚体并与IFNγ诱导的干扰素调节因子(IRF)协同作用之外,IFNγ还可以激活非规范转录复合物,这些复合物类似于由I型干扰素诱导的干扰素刺激基因因子3(ISGF3)复合物,因为它们含有IRF9并与干扰素刺激反应元件(ISRE)结合。

(数据来源 Ivashkiv LB. Nat Rev Immunol. 2018)
IFNγ在肿瘤微环境中的作用
IIFNγ在肿瘤微环境中具有双重作用,抗肿瘤作用和促肿瘤作用。IFNγ通过T细胞、NK细胞、单核细胞、DC和癌细胞上的CXCL9、CXCL10和CXCL11及其同源受体CXCR3的转录调节,促进免疫细胞向TME的募集。活化的CTL对TME的趋化性增强,可增强细胞毒性作用并限制肿瘤生长。IFNγ的一个关键抗肿瘤功能是可以通过诱导APC细胞表达MHC-I分子,从而将肿瘤抗原呈递给T细胞。IFNγ对肿瘤细胞的免疫激活活性很大程度上归因于诱导肿瘤细胞表达MHC I类以及肿瘤细胞、单核细胞、内皮细胞和成纤维细胞分泌CXCL9、CXCL10和CXCL11,以促进淋巴细胞迁移并抑制血管生成(抗肿瘤)。IFNγ也可以通过诱导肿瘤细胞表达免疫抑制分子PDL1、IDO1、iNOS等来发挥促肿瘤作用。IFNγ对肿瘤血管和淋巴管也有双重调控作用,可以抑制淋巴管生成,但也可以间接促进肿瘤血管生成。

(数据来源 Gocher AM, et al. Nat Rev Immunol. 2022)
IFNγ与癌症免疫治疗
几乎所有癌症免疫疗法,如重组细胞因子、疫苗、检查点抑制剂、嵌合抗原受体T细胞疗法和TLR激动剂,都会调节IFNγ。这些疗法旨在诱导炎症以帮助清除肿瘤;然而,IFNγ驱动的适应性免疫抵抗可能导致治疗抵抗或疾病恶化。过去十年来,许多IFNγ调节免疫疗法的临床前研究旨在利用抗肿瘤作用并阻断IFNγ在TME中的促肿瘤作用。
CAR T细胞疗法:IFNγ受体信号通路在调节CAR T细胞与固体肿瘤细胞之间的黏附过程中起关键作用,这为进一步优化CAR T细胞疗法治疗固体肿瘤提供了新的思路。
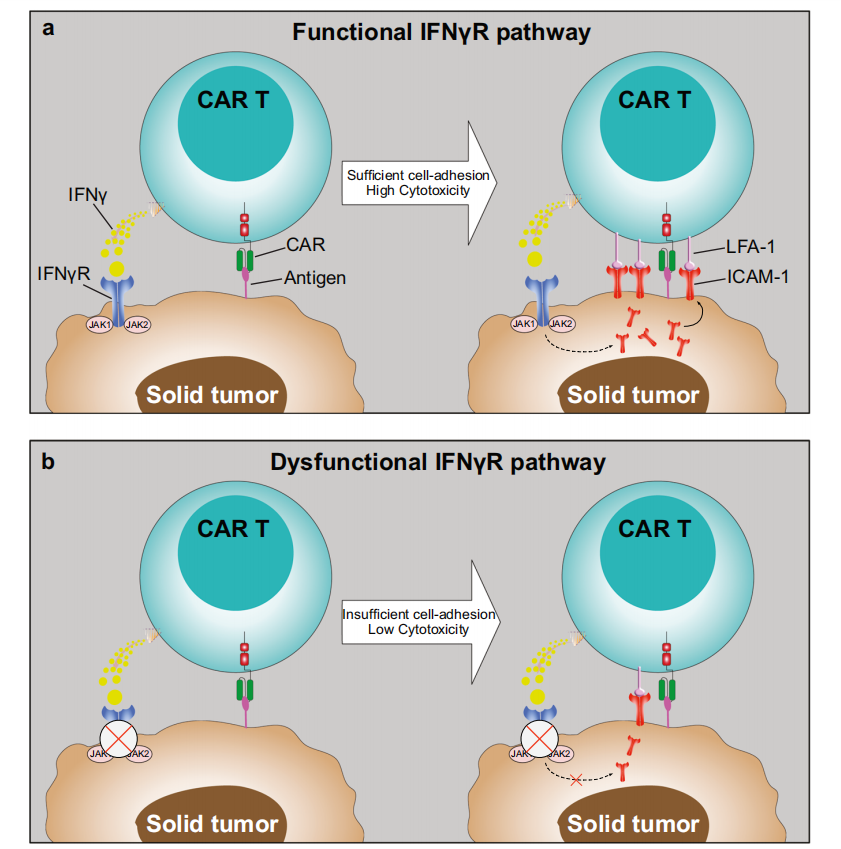
(数据来源 Hong L, Ye L. Signal Transduct Target Ther. 2022)
免疫检查点阻断:IFNγ在抗PD1或抗PDL1的免疫检查点阻断中起着重要作用。研究发现,IFNγ 位于黑色素瘤表面PDL1高表达的区域,这意味着CTL可能通过IFNγ驱动的PDL1表达触发自身抑制。这种适应性免疫抗性机制可能解释肿瘤逃避免疫监视。除了驱动PDL1表达上调外,CTL 产生的IFNγ也是介导其治疗效果所必需的。
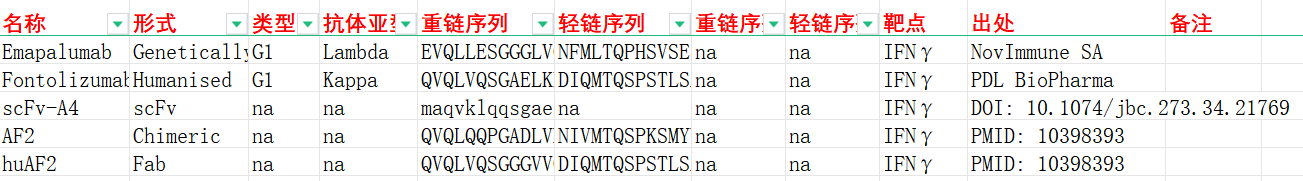
我们收集整理一批IFNγ相关抗体序列信息。文档可关注公众号“迈思生物”,号内回复“IFNγ”下载。