背景
随着机器学习算法的日益复杂化,我们可以仅凭氨基酸序列就能预测蛋白质的结构,并且这些方法强调了大多数蛋白质的天然结构代表着仅由蛋白质中氨基酸之间的相互作用决定的能量最小值。这些方法仅限于天然结构预测:我们仍然无法准确预测多肽从未折叠状态到其天然结构的过程中所使用的主要机制,蛋白质序列的细微变化可能导致折叠机制的巨大差异。动力学稳定的蛋白质在其一生中可能只折叠一次,因此,密码子介导的蛋白质折叠先驱轮的调节可以产生持久的影响。蛋白质合成的速度比许多折叠反应慢,并且取决于编码蛋白质序列的同义密码子。同义密码子替换有可能调节共翻译蛋白质折叠机制,并且越来越多的蛋白质已被鉴定出具有对密码子使用敏感的折叠机制。
2024年9月12日研究人员在Annual review of biophysics上发表了一篇名为“The Effects of Codon Usage on Protein Structure and Folding”的文章,该文章综合了最近的发展描述了密码子使用对蛋白质结构和折叠机制的影响,包括对适应度的下游影响,重点关注同义密码子变化对功能性蛋白质生产的影响,特别是共翻译蛋白质折叠、多聚体蛋白质组装以及膜靶向和分泌。

密码子与蛋白质折叠关系
经典的安芬森实验现已用于尝试重新折叠数千种不同的蛋白质,实验发现只有一小部分蛋白质被发现可以在平滑的漏斗状能量景观中可逆地重新折叠。大多数蛋白质,尤其是那些大蛋白质、多聚蛋白质或具有复杂结构拓扑结构的蛋白质,在从变性剂中稀释时往往会错误折叠和聚集,而不是正确重新折叠。
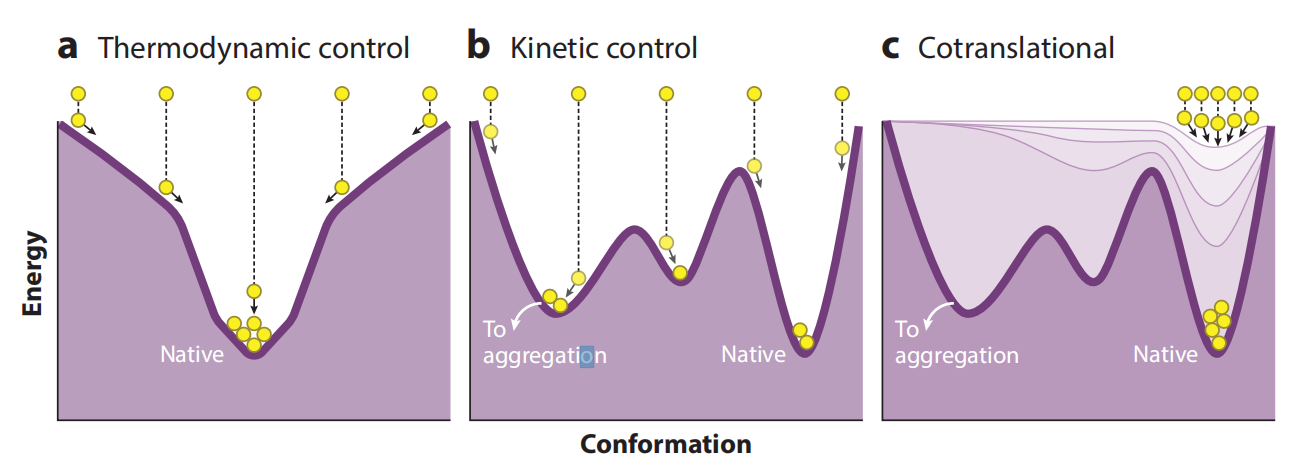
细胞环境中蛋白质折叠的一个普遍特征是,每个细胞中的每个蛋白质在从核糖体的出口通道出来时都可以开始折叠。与全长蛋白质在变性剂稀释后重新折叠相比,以核糖体延伸速率的节奏进行的共翻译折叠是完全不同的折叠起点。调节延长速率的一个关键因素是同义密码子的使用。同义密码子替换不会改变氨基酸序列,但可以使核糖体的延长速率改变10倍以上。高丰度蛋白质的编码序列在同义密码子子集中富集,这些密码子子集也与高同种受体tRNA丰度、全基因组丰度和更快的翻译延伸呈正相关。
密码子优化对水溶性蛋白质折叠的影响
一旦多肽链脱离核糖体,甚至在它仍在核糖体出口通道内时,新生多肽链N端部分氨基酸残基之间的稳定接触就可以开始形成。大型、多聚体或多结构域的蛋白质比接触顺序低的小单结构域蛋白质更容易发生错误折叠和聚集。野生型信使RNA转录本通常含有稀有和常见密码子,以实现高效翻译和功能性蛋白质生成。对更优化(常见)或非优化(稀有)的密码子进行同义密码子替换会改变蛋白质折叠途径,导致错误折叠、聚集和/或降解。

单体蛋白的共翻译折叠
虽然密码子优化可以增加基因表达,但它也会由于共翻译折叠途径的改变而影响蛋白质的最终结构。引入最优密码子并不总是有利于蛋白质功能。例如,使用常用的(在脉孢菌中)NNC密码子替换粗糙脉孢菌中交叉途径控制蛋白-1(CPC-1)的稀有密码子NNU,发现NNC突变体的mRNA和蛋白质水平增加,表明WT NNU密码子抑制基因表达。然而,引入NNC密码子也改变了CPC-1的稳定性和天然结构,导致体内降解率和体外胰蛋白酶消化率出现差异,并对CPC-1活性和脉孢菌生长率产生不利影响。
多聚蛋白质的组装
与单体蛋白质相比,多聚体蛋白质不仅需要正确折叠,还需与其他亚基组装。根据天然结构拓扑结构,组装可能发生在单个多肽链折叠之前、折叠过程中和/或折叠之后。在折叠完成之前发生的组装可促进缠结天然结构的形成,其中每个亚基的天然结构关键取决于与相邻亚基形成的相互作用。在折叠过程中过早或过晚与其他亚基组装都可能导致偏离天然多聚蛋白质组装形成的路径的轨迹,包括错误组装的可溶状态和聚集。
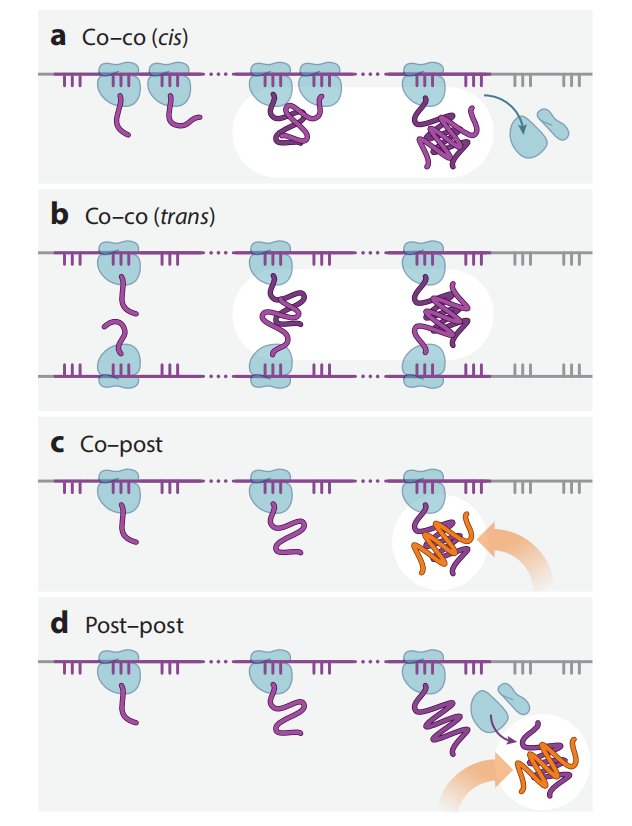
共翻译组装可以协调多聚蛋白质的正确折叠,通过将共翻译蛋白质折叠与组装结合起来,细胞可以增加折叠产量,并抵消多聚蛋白质增强的聚集倾向。多聚体蛋白可分为同聚体和异聚体两类,形成多聚体蛋白质有四种可能的组装机制:Co-co(cis),Co-co(trans),Co-post,Post-post。其中在真核生物中,Co-co(cis)仅与同聚体蛋白质组装兼容。许多多聚体蛋白质(主要是同型二聚体)通过Co-co机制(顺式或反式)共翻译组装。
多聚体蛋白质共翻译组装取决于部分合成的多肽链之间的亲和力以及相互作用片段沿新生链的位置。另一个关键因素是相互作用片段在新生多肽链内的局部浓度,它受延伸率和核糖体密度的影响。同义密码子的改变可以影响多聚蛋白的最终结构和功能,表明同义密码子可能通过调节折叠途径来影响组装过程。
密码子对分泌和跨膜蛋白折叠的影响
分泌途径的蛋白质具有复杂的折叠途径,其中许多蛋白质是共翻译转运的,并且可以开始共翻译折叠,折叠和分泌都可能受到同义密码子使用的影响。成功靶向和折叠分泌蛋白对细胞适应性具有重要意义。
膜靶向和细胞内运输
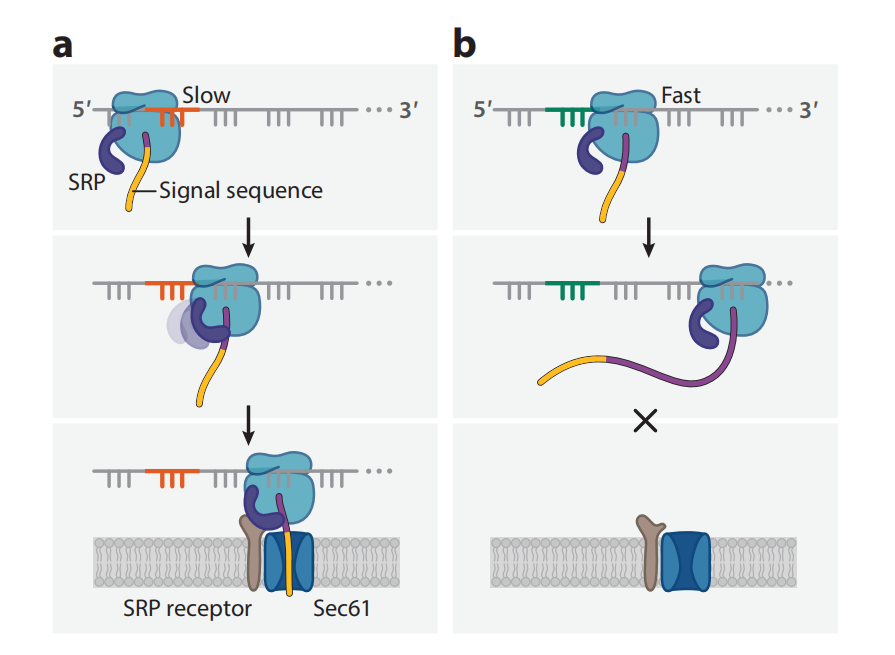
在真核生物中,分泌途径中的蛋白质通过信号识别颗粒(SPR)共翻译靶向内质网(ER)膜,SRP结合通过协调翻译延长和核糖体新生链(RNC)靶向转位子促进细胞内正确的转位、折叠和运输。同义密码子可通过调节蛋白质合成和SRP结合的关键早期窗口期间的核糖体延伸率来改变SRP介导的分泌蛋白和膜蛋白向内质网膜的靶向作用。
许多编码膜蛋白和分泌蛋白的转录本在SRP结合位点后约40个密码子处富集非最佳密码子,该位置的非最佳密码子可能导致延伸速度变慢,这些翻译缓慢的密码子可能是导致延伸停滞的原因,从而使RNC-SRP复合物靶向膜的Sec61转运子。与SRP受体结合后,延长恢复,同时通过Sec61 转位。水溶性蛋白质通过Sec61孔转位到内质网腔,而整合膜蛋白则通过Sec61和其他插入机制转移到磷脂双层。最佳密码子的快速延伸意味着信号序列可能会绕过SRP而不结合。如果没有SRP结合,延伸将不会暂停,RNC将无法与ER膜上的转运蛋白正确结合。
同义密码子还被证实可通过SRP独立途径影响膜靶向和细胞运输,Kesv是一种病毒蛋白,其结构类似于真核钾通道;在真核细胞中表达时,它通常靶向线粒体,但可以通过同义替换转移到内质网。
整体膜蛋白折叠
除了由于SRP结合导致的N端延伸停滞之外,在共翻译整合到膜中的膜蛋白中,在随后的跨膜α螺旋后约70个密码子处也观察到了由于翻译缓慢的密码子而导致的核糖体暂停。但机制不明,跨膜α螺旋和次优密码子之间的间距表明,当预测翻译速度减慢时,螺旋将离开出口通道,因此核糖体暂停可能促进跨膜结构域与双层膜和/或膜插入机制的结合。
囊性纤维化跨膜传导调节器(CFTR)属于ABC转运蛋白类整合膜蛋白,同义密码子的使用已经被证实会影响CFTR的翻译,折叠和功能。CFTR的第一个核苷酸结合结构域1(NBD1)的β片层核心的正确折叠取决于局部延伸率。WT序列的延伸率会延迟β链S6的定位,直到两条后续β链从核糖体出口通道中出现,从而允许β链和上游α亚结构域之间的天然接触协调。该区域常用密码子的同义突变会导致β链错误折叠,从而导致聚集。同义突变还可与非同义突变协同作用,改变CFTR折叠。Thr854的同义突变从ACT变为ACG,当与其他突变同时发生时,会影响共翻译折叠。

密码子对基因组进化的影响
与基因组的所有部分一样,蛋白质编码序列会随着时间的推移而积累突变,这些突变会受到选择压力以优化适应性。因此,同义突变可能会受到自然选择的影响。维持有效的共翻译折叠的选择压力可能导致密码子使用模式的保守性。
未解决的问题
尽管已经取得了很大进展,但仍有几个重大障碍阻碍我们清楚地了解当延伸率发生变化时共翻译蛋白质折叠途径会发生哪些具体变化。
一.缺乏一种实验方法,能够在蛋白质合成的快速时间尺度上选择性地报告新生链折叠中间体的细微结构变化,这阻碍了我们进一步理解密码子替换对蛋白质折叠的影响。
二.由于缺乏一个模型来准确、定量地预测任何感兴趣的信使RNA序列的延伸率,导致依赖不完善的代理,例如将稀有密码子和/或低转移RNA基因拷贝数与缓慢的延伸率等同起来。
三.同义密码子替换可以影响共翻译折叠上游功能性蛋白质生产的很多方面。将折叠特有的影响与蛋白质生产其他方面的影响区分开来可能极具挑战性,尤其是因为这种影响可能是微妙的和/或累积的。从历史上看,大多数全基因组关联研究都忽视了与疾病相关的同义替换,这阻碍了我们认识同义突变对疾病的贡献。
总结
对于许多蛋白质来说,折叠的速率由翻译延伸的速率决定,同义密码子替换可以使延伸率改变10倍,而不会限制编码的氨基酸序列。使用同义密码子可能会导致翻译速率过快,导致错误折叠或聚集,影响蛋白的结构和功能。同义密码子替换可以与非同义替换协同作用,放大或减轻对蛋白质折叠的影响。但是很少有实验方法能够量化细胞中的翻译延伸率和共翻译折叠机制,这对预测生物学如何优化密码子来调节蛋白质折叠的理解的发展提出了挑战。
