背景
天然蛋白质的功能经过高度优化,但由于在异源系统中表达不佳、溶解度有限以及对温度敏感,通常难以以适合生物技术应用的规模生产。因此,需要一种改善天然蛋白质物理特性同时保持功能的通用方法可以广泛应用于基于蛋白质的技术。
2024年1月9日华盛顿大学蛋白质设计研究所的研究人员在Journal of the American Chemical Society上发表了一篇名为“Improving Protein Expression, Stability, and Function with ProteinMPNN”的研究,该研究展示了深度神经网络ProteinMPNN工具为增加蛋白质表达、稳定性和功能提供了一条途径。对于肌红蛋白和烟草蚀刻病毒(TEV)蛋白酶,生成了具有改进表达、升高熔化温度和改进功能的设计。对于TEV蛋白酶,确定了多种与母序列和之前报道的TEV变体相比具有更高催化活性的设计。这种方法未来应该可以广泛用于改善生物技术重要蛋白质的表达、稳定性和功能。
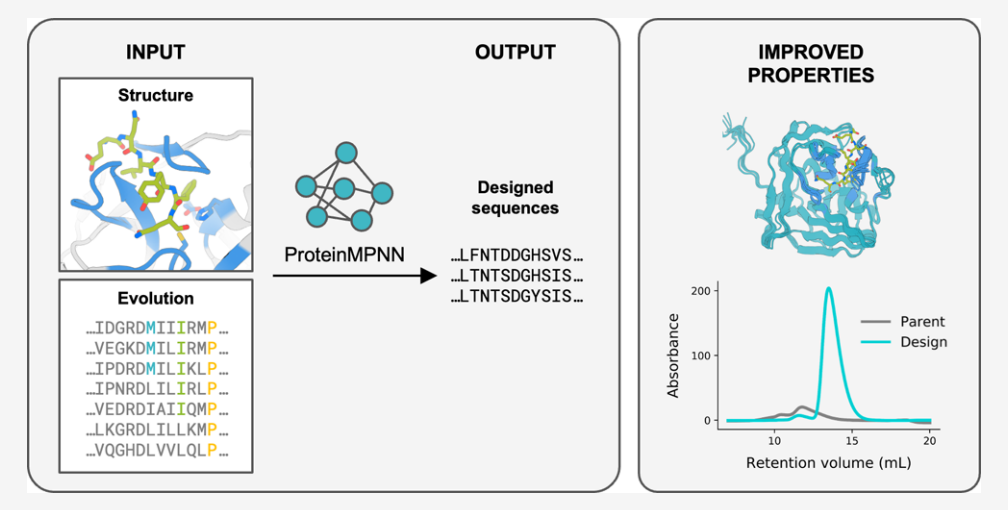
使用ProteinMPNN实现蛋白质稳定
设计空间的选择是通过固定与配体接近的残基和那些在多重序列比对中高度保守的残基的氨基酸特性来保持蛋白质的天然功能。将蛋白质骨架结构和固定位置信息输入到ProteinMPNN中,生成可能折叠到输入结构的新的氨基酸序列。loop区域的主干结构可以选择性地使用RoseTTAfold联合绘图进行重塑,以进一步理想化输入蛋白。

提高稳定性的肌红蛋白变体的设计
作者使用人类肌红蛋白nMb的晶体结构应用了上述ProteinMPNN设计方案。固定血红素结合结构中血红素配体周围的17个位置,以保持肌红蛋白的氧结合功能。使用ProteinMPNN生成了60个序列,并使用AlphaFold2单序列预测评估了它们重现肌红蛋白骨架坐标的可能性。作者还探索了对有序性较差的区域进行有限的骨架重新设计,以进一步稳定蛋白质。选择了这些保守性较低的环路区域,并使用RoseTTAFold技术进行主干重塑,生成了两组不同的结构重塑设计:一组重新设计了连接螺旋E和F的区域,另一组额外包括了CD环区域。从这些重塑的主链中,再次使用ProteinMPNN进行序列设计,血红素结合位点如上所述保持不变。
合成编码设计和亲本序列的合成基因,并将其在大肠杆菌中表达。20个设计中有13个(最高可达4.1倍)的总可溶性蛋白产量高于天然肌红蛋白。八种设计的融化温度高于天然肌红蛋白,其中六种在95°C时仍完全折叠(天然肌红蛋白在80°C时熔化)。dnMb19采用更激进的骨架重塑策略生成,与天然肌红蛋白相比,血红素结合的热稳定性要高得多。RoseTTAFold联合绘图技术和ProteinMPNN的强大功能,可以准确重塑天然蛋白质骨架,同时提高溶解度、热稳定性和功能稳定性。

设计具有改进的稳定性和催化活性的TEV蛋白酶变体
通过将设计策略应用于烟草蚀刻病毒(TEV)的半胱氨酸蛋白酶,这种酶用于特异性地从重组蛋白中移除纯化标签。探索ProteinMPNN序列设计对稳定酶的实用性。生成了四组不同的设计,这些设计仅固定了活性位点残基的氨基酸身份,以及在TEV蛋白酶家族中高度保守的残基。在TEV蛋白酶家族中保守性较低的区域进行骨架重设计。
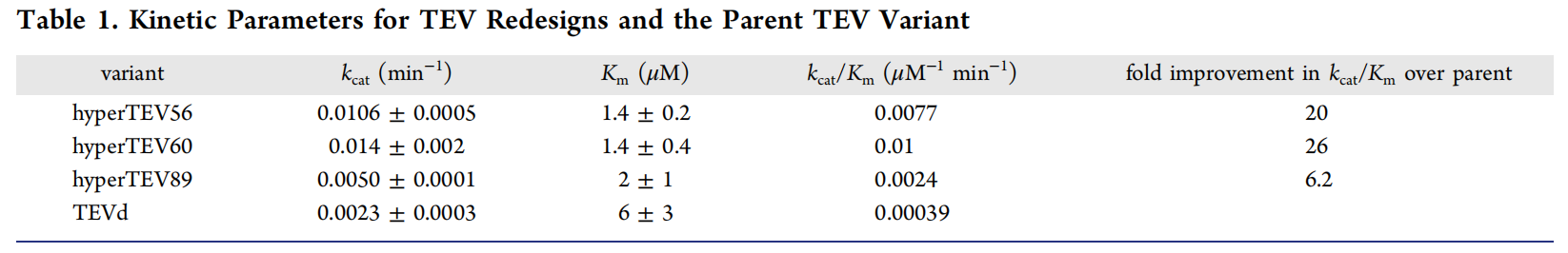
使用ProteinMPNN生成了总共144个序列。144个设计中的134个以可溶性表达的形式被SEC洗脱为单体。144个设计中的129个表现出比TEVd更高的可溶性表达水平。64个设计表现出底物肽切割活性,不固定保守残基的设计具有提高的表达量,但不具备功能活性。对其酶催化活性检测,发现hyperTEV60保留了其原始裂解活性的90%,而TEVd降低到其原始活性的15%,说明设计后的TVE的稳定性显著提高。
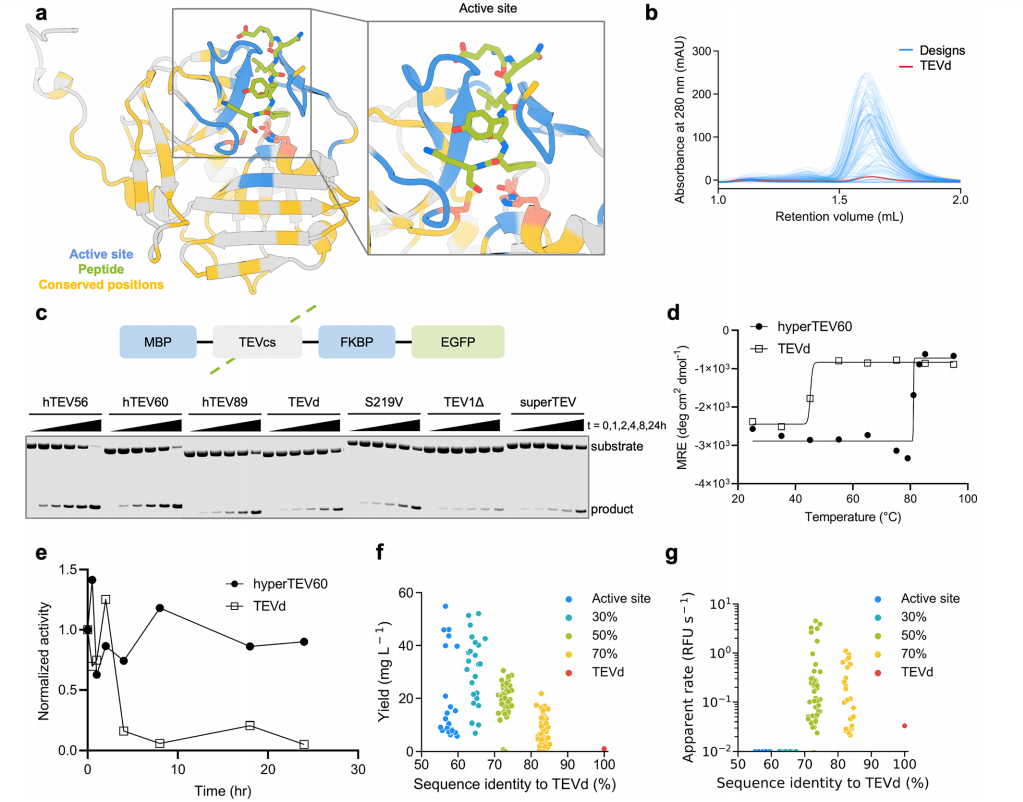
对TEV-肽复合物进行了微秒分子动力学(MD)模拟,以探究引入的突变对整体蛋白质动力学的影响。与TEVd相比,设计中观察到分布在整个结构中的环区域普遍刚性化。这种不直接参与底物结合的远端区域的骨架刚性化可能与底物结合的变构改善有关,这反映在设计的变体测得的K m值降低了两到三倍。
总结
该研究表明在现有序列和结构信息的指导下,可以使用ProteinMPNN改善天然蛋白质的表达、稳定性和功能。虽然维持(或许增强)功能的最佳残基数可能必须根据每种情况凭经验确定,但这种程序简单易行,ProteinMPNN的计算效率和易用性使这一点变得简单,而且需要测试的变体数量远少于典型的实验筛选。未来该技术在蛋白表达上可能会有广泛的应用。
