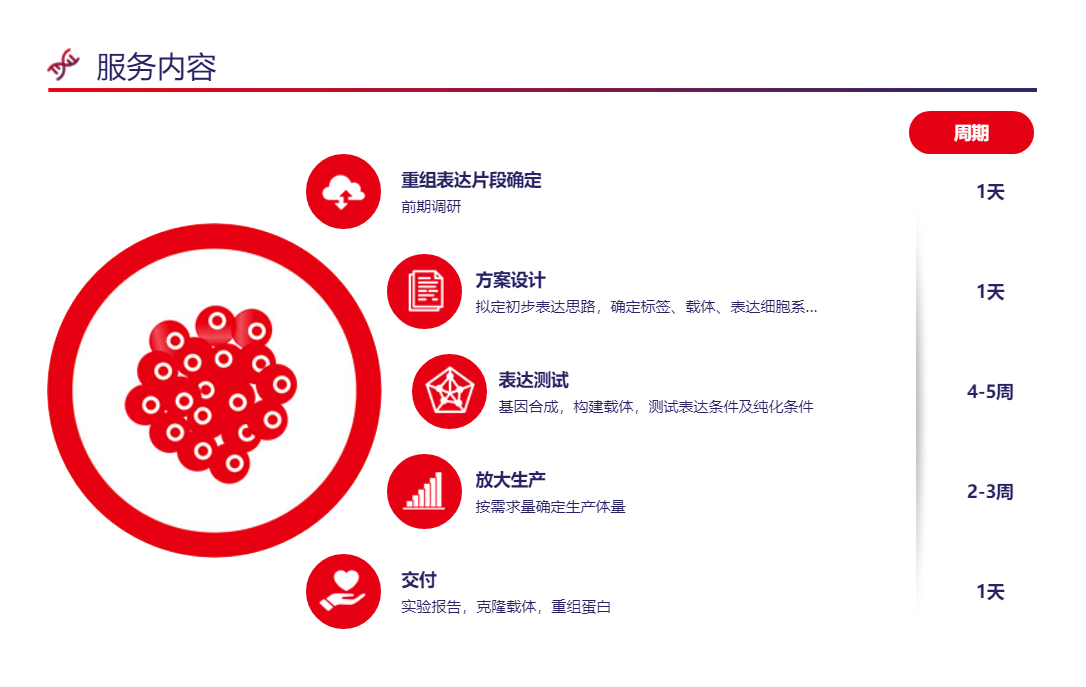
真核哺乳动物表达系统在蛋白表达技术中扮演重要角色,哺乳动物蛋白生产已经成为最先进生物治疗药物生产的标准,也成为用于研究的蛋白质样品生产的常规。哺乳动物细胞系的蛋白质生产具有独特的优势,可产生接近野生型的转录和翻译环境,再加上相关的伴侣、分泌和氧化还原环境以及翻译后修饰,从而产生功能相关和有活性的蛋白质。哺乳动物细胞表达的蛋白质相对稳定,能够长时间保存和存储。相对于原核表达系统,哺乳动物表达系统产生的蛋白质内毒素水平低。
它在在功能蛋白、抗体生产、临床疫苗的研发和生产中发挥重要作用。
(数据来源 Hunter M, et al. Curr Protoc Protein Sci. 2019)
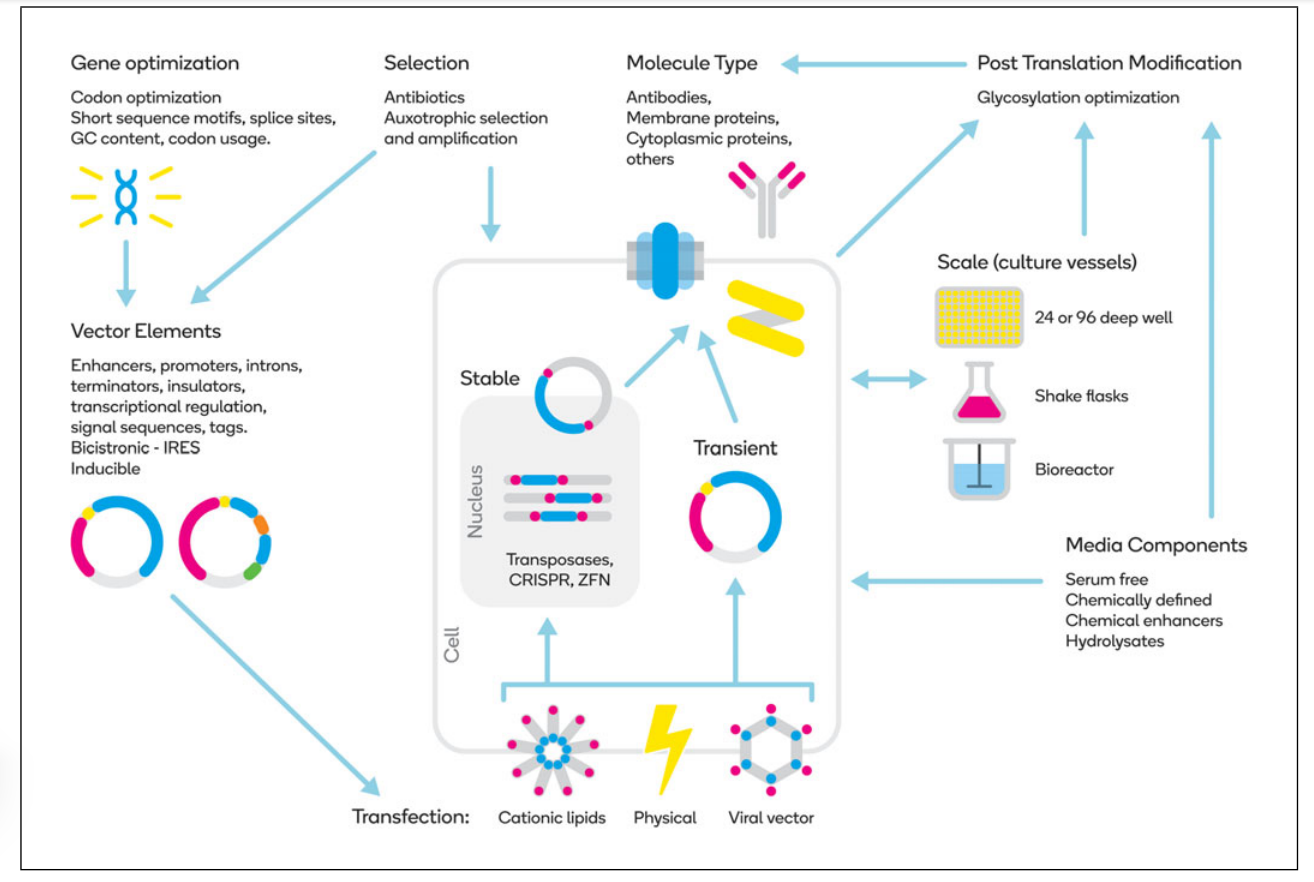
哺乳动物表达系统载体类型
哺乳动物表达系统载体类型分为两类:非病毒载体(质粒)和病毒载体(腺病毒、逆转录病毒、腺相关病毒)等。
非病毒载体:由真核复制信号、启动子、转录单位以及质粒片段组成,不需要包装细胞,比如pSV系列、pCDNA3等。
病毒载体:可分为两类,整合型和游离型。
整合型:整合入宿主染色体随染色体复制而复制,可持续表达外源基因;安全性低,可能会整合到基因编码区导致插入诱变。如:逆转录病毒载体、慢病毒载体。
游离型:不整合、生物安全性高、瞬时表达。如:腺病毒载体。
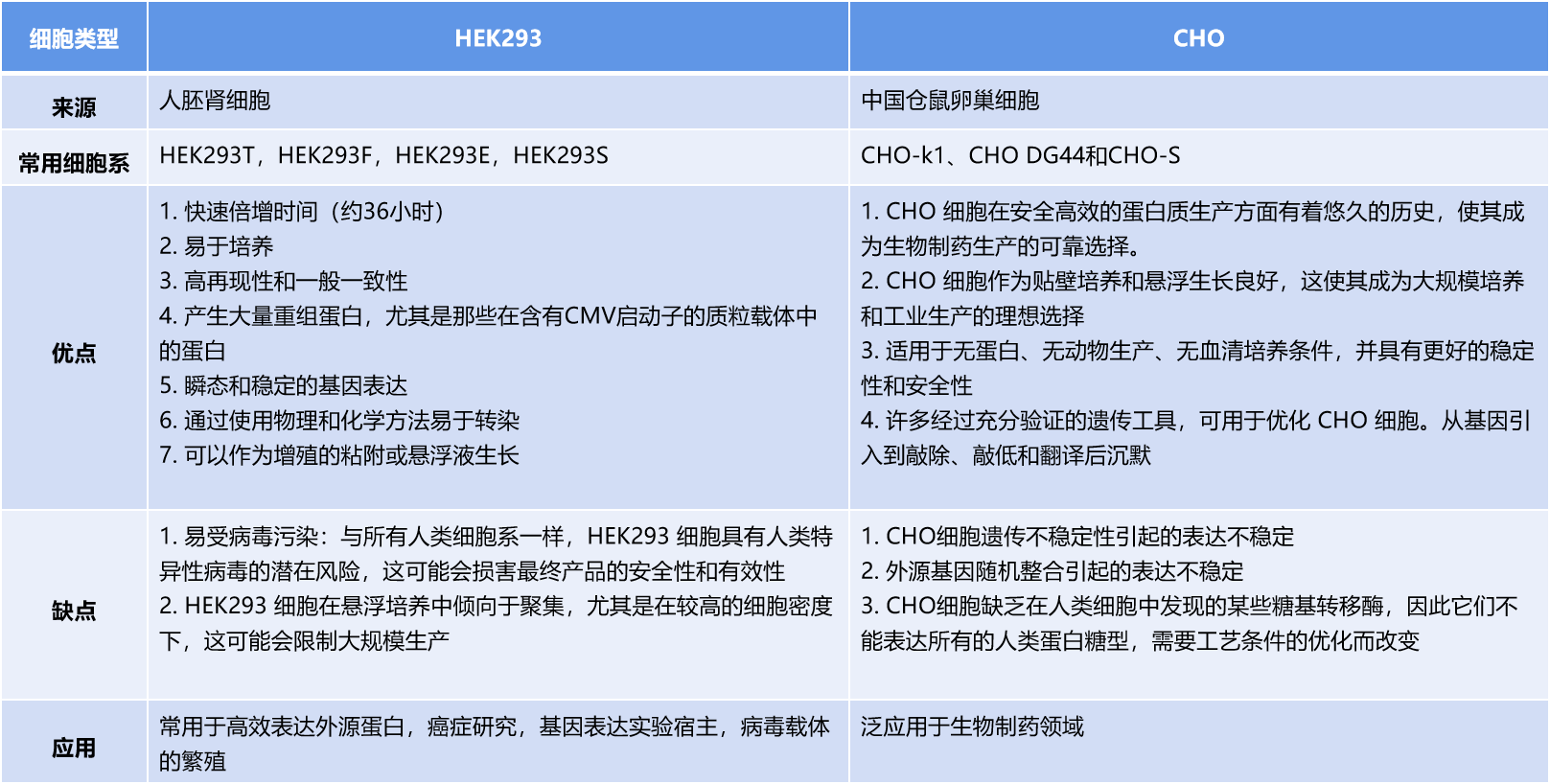
哺乳动物表达系统常用细胞系比较
在研究和工业环境中,用于蛋白质生产的最常用的哺乳动物细胞系是中国仓鼠卵巢细胞(CHO)和人类胚胎肾293细胞(HEK-293)。选择最合适的细胞系是成功表达目标蛋白的关键步骤。在用于重组蛋白表达的CHO和HEK293细胞系之间进行选择时,应根据需求选择合适的表达细胞系,包括蛋白质类型、蛋白质翻译后修饰、生产规模和时间。HEK293细胞擅长快速高效地生产具有复杂翻译后修饰的重组蛋白,CHO细胞是生物制药生产的最终宿主。
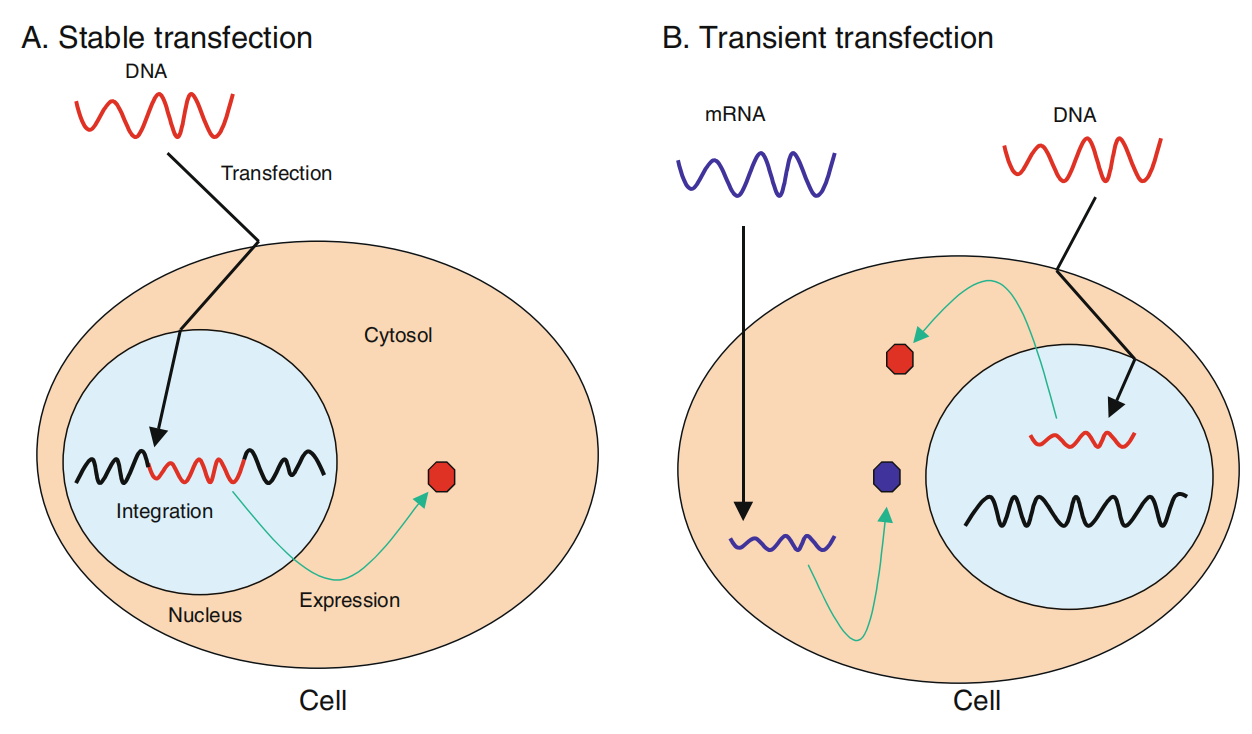
哺乳动物表达系统的转染类型
利用哺乳动物细胞表达系统生产蛋白通常有两种类型:瞬时转染与稳定转染。
稳定转染:载体导入宿主细胞后,目的基因整合到细胞基因组上,不会随着细胞传代而消失,能够长期稳定的生产目的蛋白。
瞬时转染:瞬时转染的细胞中,外源基因可以表达,但是并不会整合到细胞核内的基因组中,也就无法复制传给下一代。细胞中瞬时转染的外源基因表达时间有限,通常仅持续几天,直到外源基因在细胞分裂过程中丢失为止。在项目早期阶段,当需要毫克到克级别的蛋白质时,瞬时转染是首选。
(数据来源 Kim TK, et al. Anal Bioanal Chem. 2010)
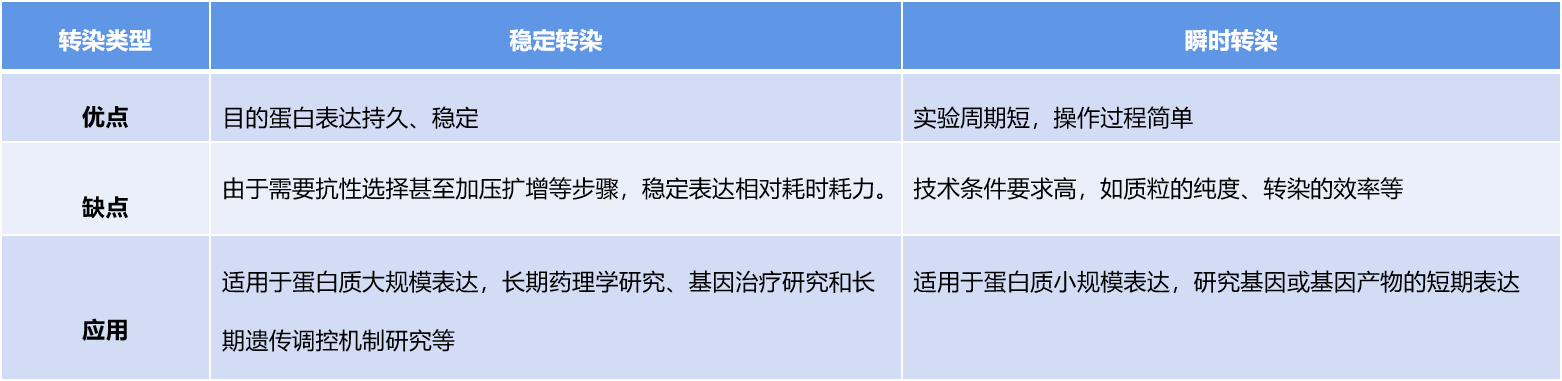
哺乳动物表达系统的转染方式
转染是将外源基因导入宿主细胞的过程。常用的转染方法包括病毒方法,物理方法,化学介导法。选择合适的转染方法可以显著提高转染效率和目的蛋白的表达量。
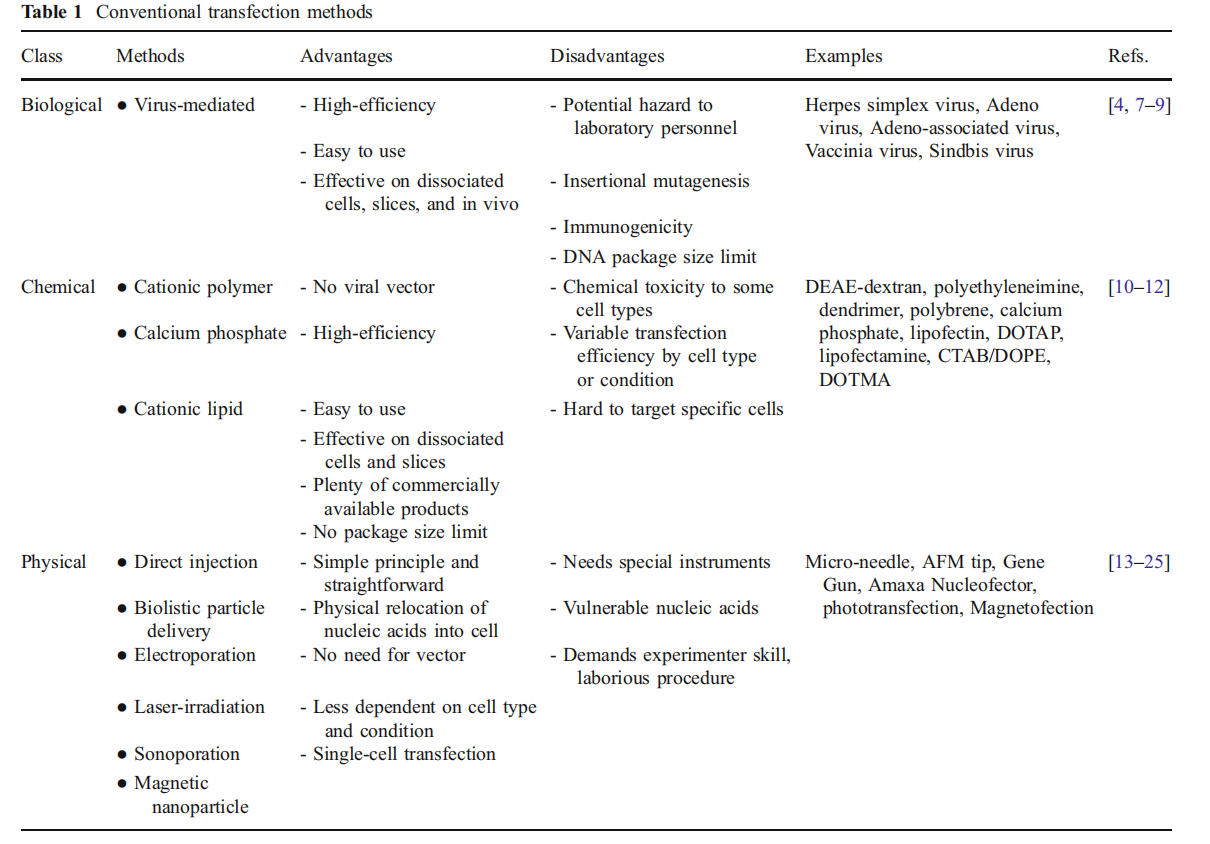
(数据来源 Kim TK, et al. Anal Bioanal Chem. 2010)
我们的平台优势
我们在真核哺乳细胞瞬转和稳转表达方面拥有数十年的经验和专业知识。针对首选宿主细胞类型(HEK293细胞和CHO细胞)开发了一套专有载体,搭配优选无血清培养体系,通过更好的表达和纯化策略进一步提高产量,进一步提高重组蛋白的成本效率。
案例展示
同批次高通量表达了三十多种不同CD系列重组蛋白,客户验证均具备功能活性,高成功率及高产量赢得客户赞誉。
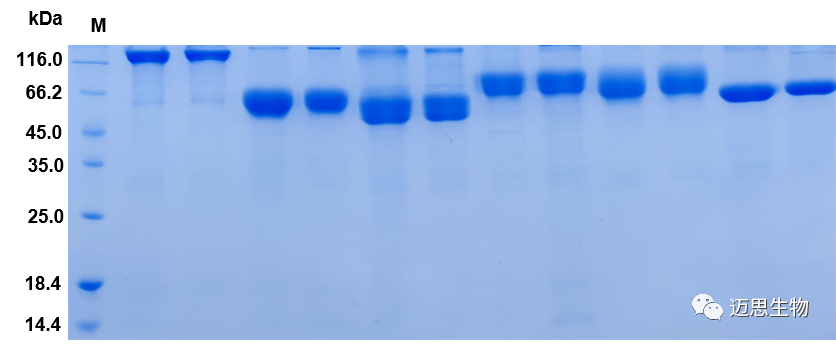
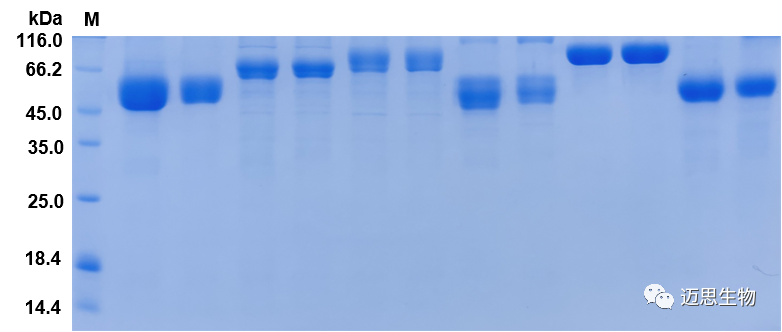
定制化服务
细致的蛋白特性分析(基于蛋白性质,文献资料,结构信息综合评估),通过密码子优化构建至经特殊改造的高表达载体,选择高活率哺乳悬浮细胞表达宿主进行蛋白表达,可通过相关配受体及参照抗体对重组蛋白进行活性验证。