近日,北京药理毒理学研究所在国际顶级期刊《Advanced Materials》(IF=27.4)上发表了题为“Phase-Separated Nano-Antibiotics Enhanced Survival in Multidrug-Resistant Escherichia coli Sepsis by Precise Periplasmic EcDsbA Targeting”的研究论文。该研究创新性开发了一种相分离纳米抗菌药物(NCefoTs),通过将膜识别和破坏脂肽(MLp)、DsbA酶抑制脂肽(ELp)和头孢哌酮共组装,制备了NCefoTs。该药物通过MLp和ELp介导的异质化相分离作用有效渗透外膜,ELp精准靶向DsbA蛋白,释放头孢哌酮,从而抑制β-内酰胺酶水解活性和鞭毛运动,显著增强抗生素的抑菌效果。迈思生物承担了该研究中功能活性蛋白DsbA酶的定制开发。


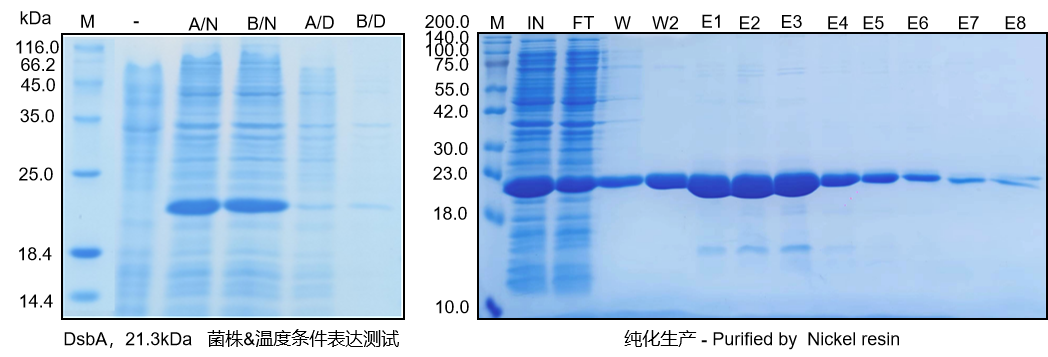
(数据来源 项目活性DsbA酶开发原始数据)
二硫键(Dsb)蛋白在革兰氏阴性杆菌的胞周-氧化蛋白折叠途径中起着至关重要的作用,有助于许多蛋白质的折叠和稳定性。特别是DsbA,对于多种成分的组装(包括宿主细胞粘附素、毒素、III型分泌系统和运动系统)是必不可少的。因此,破坏DsbA/DsbB的稳态从而损害下游β-
内酰胺酶以抑制致病的稳定性是一种替代抗菌疗法,但目前实现穿过细菌多重屏障精确靶向亚细胞内DsbA仍然是一个重要的挑战。
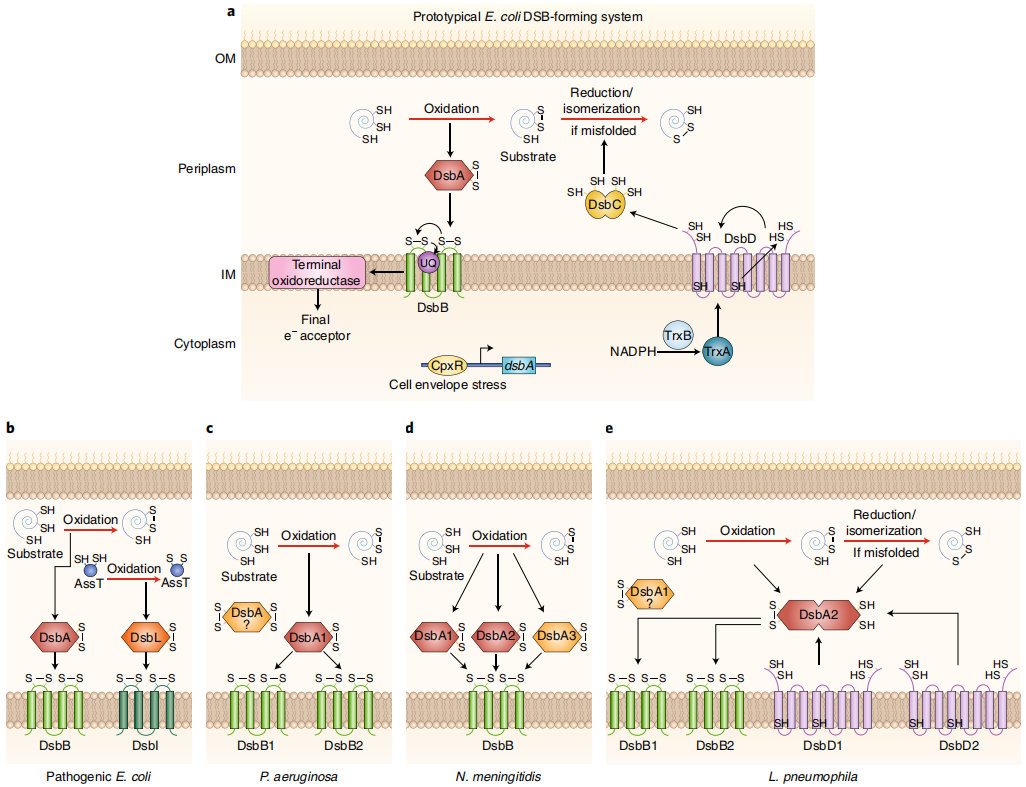
(数据来源 Landeta C, et al. Nat Microbiol)
NCefoTs设计:
NCefoTs通过DsbA酶抑制脂肽(ELp),膜识别和破坏脂肽(MLp)和Cefo共同组装以抗多药耐药(MDR)细菌。ELp设计有四个结构域:疏水基序(棕榈酸),β-sheet组装序列(FFVLA),间隔(GGG)和DsbA抑制肽FS-7 (PFATCDF)。接下来,MLp由三个结构域组成:疏水基序(棕榈酸),剪裁序列(- s - s -),通过二硫键被还原DsbA特异性识别和切割,以及LPS靶向和膜破坏肽序列(KKRAKKFFKKPRVIGVSIPF)。基于MLp和ELp上结构域的疏水和多氢键相互作用的自分选机制,最终稳定的纳米胶束呈现异质相分离表面,从而增强外膜(OM)渗透和DsbA抑制。

增强体外治疗的协同机制:
NCefoTs损害介导的二硫键的形成,酶底物氧化试验测试了其对DsbA介导的阻断效力,使多种β-内酰胺酶不稳定;过表达DsbA大肠杆菌耐药性被NCefoTs严重抑制,生长阻滞,另外形态学明显观察到鞭毛清除和渗漏也证实了这一结论,。

体内高效消除大肠杆菌耐多药耐药:
与PBS、Cefo和NTs相比,NCefoTs显著降低了腹膜炎-脓毒症小鼠模型中细胞因子水平,还原毒素诱导的炎症反应和抑制感染源的扩散传播。。

小结:
为了通过外膜靶向潜在的胞内DsbA并抑制下游β-内酰胺酶的产生,研究人员开发了NCefoTs,一种原位异质相分离纳米抗生素,不仅促进抗菌修饰,而且作为协同对抗耐药细菌的佐剂,在根除大肠杆菌耐多药的抗生素用量显著减少100倍以上的同时,将大肠杆菌耐多药耐多药诱导的脓毒症小鼠的存活率提高至92%,开发了一种可行的方法来解决针对细菌周质/细胞质内药物结构域的候选抗菌药物从体外转化为生存效果时所遇到的挑战。