c-MET,也称为MET或肝细胞生长因子受体(HGFR),是一种属于MET家族的受体酪氨酸激酶。肝细胞生长因子(HGF)是c-MET的特异性配体,与其结合后能够激活细胞内的信号传导途径。调节许多生理过程,包括增殖,散射,形态发生和生存。c-MET的异常激活可导致肿瘤生长和癌细胞的转移进展,使其成为癌症治疗的重要药物靶点。
c-MET的表达分布
c-MET主要表达在腺细胞和腔细胞、唾管细胞、2型肺泡细胞、细胞滋养层细胞、间皮细胞中。
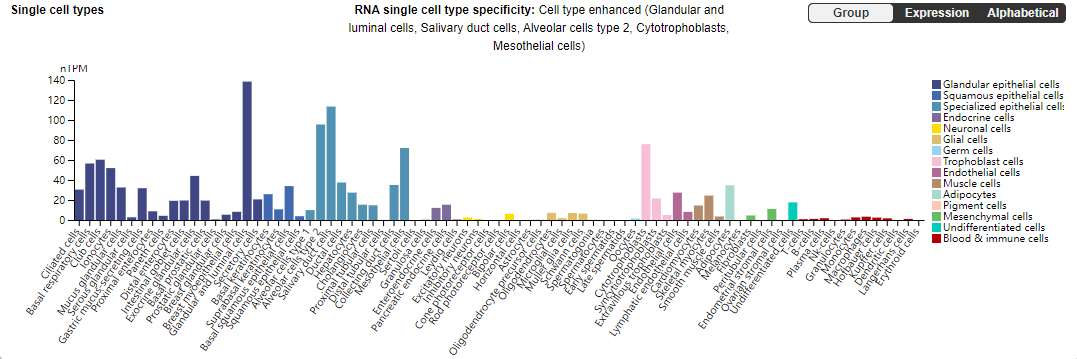
(数据来源 uniprot)
c-MET的结构
c-MET是一种I型膜蛋白,c-MET受体由一个信号素(SEMA)结构域、一个丛状信号素整合素(PSI)结构域、细胞外区域的4个连续免疫球蛋白-丛状信号素转录因子(IPT1-4)结构域、一个跨膜螺旋(TM)和一个细胞内KD组成。c-MET最初表达为一个150 kDa的单链前体,经过furin蛋白酶在Arg307和Ser308之间的蛋白水解作用转变为成熟形式。成熟形式含有α-(32 kDa)和β-亚单位(120 kDa),它们至少由三个二硫键连接。与c-MET类似,HGF的Arg494和Val495之间的蛋白水解裂解产生α和β亚基(分别为57和26 kDa),pro-HGF和裂解的HGF都能与c-MET高亲和力结合,但只有裂解的HGF才能激活c-MET信号通路。
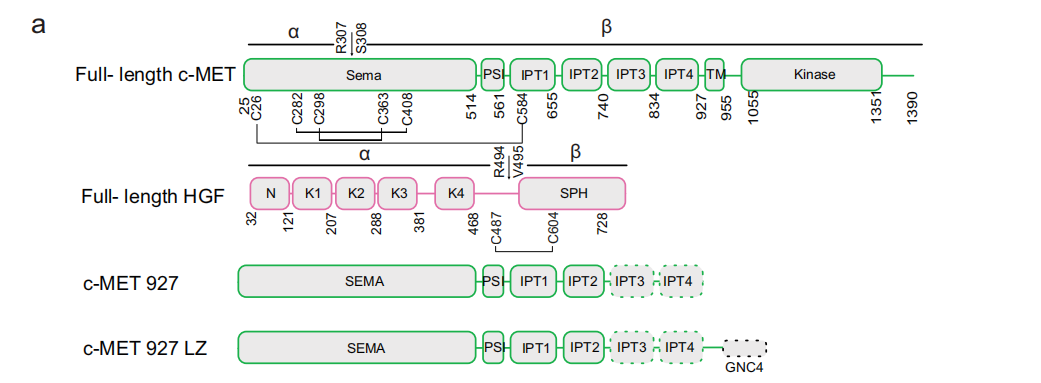
c-MET与HGF形成一个非对称的2:2复合物结构。其中一个HGF分子能够将两个c-MET分子连接在一起,形成最小的2:1 c-MET:HGF活性复合物。这个最小的活性复合物进一步被第二个HGF分子和肝素稳定,形成更加稳定的2:2复合物,从而增强了c-MET的激活。

(数据来源 Uchikawa E, et al. Nat Commun. 2021)
c-MET的信号通路和调控
经典途径中,HGF结合后诱导两个c-Met分子二聚化,从而导致酪氨酸残基的自磷酸化,进而激活许多下游信号通路,如MAPK/ERK、STAT3、PI3K/AKT信号通路。JNK也被磷酸化并激活多种下游底物,包括转录因子如AP-1以及与凋亡相关的Bcl-2、Bax等。所有这些基本上驱动了大量的细胞表型,如形态发生、生存、增殖、运动、侵袭和转移。当c-Met与其他受体(EGFR、MUC-1、VEGFR、CD44、Plexin B1、HER、Integrin)结合时,非经典通路被激活。
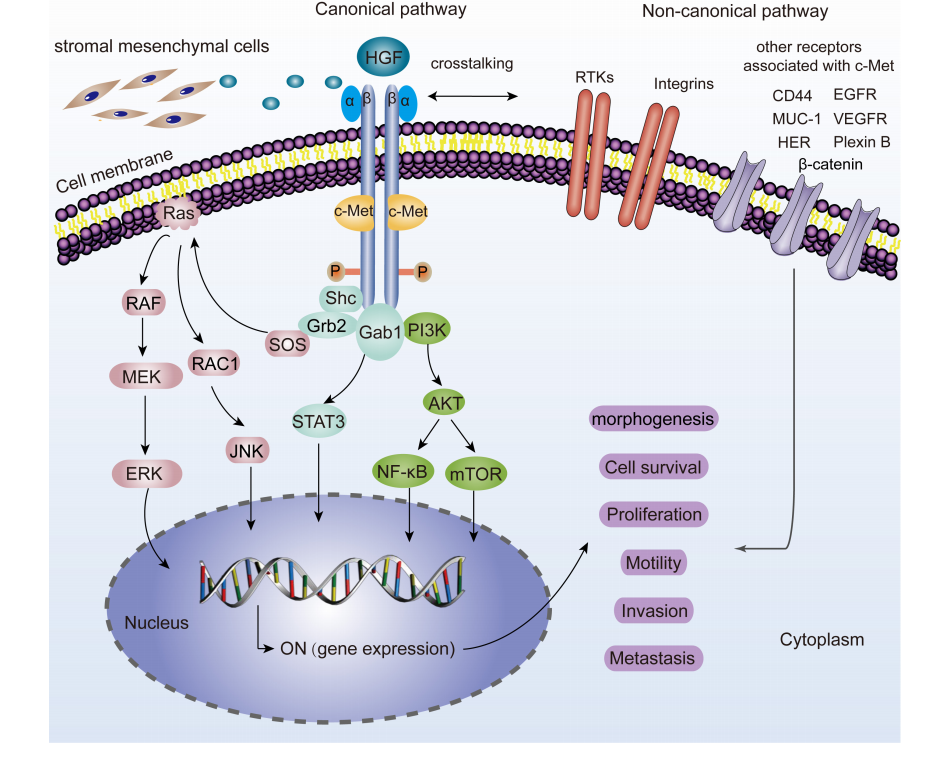
(数据来源 Liu X, et al. Front Cell Dev Biol. 2020)
c-MET的靶向治疗
阻断和抑制MET受体致癌信号级联的治疗干预策略包括阻断配体-受体相互作用、阻止受体二聚化、阻断MET激酶内在活性和抑制特异性下游信号转导通路。目前有许多靶向c-MET的单克隆抗体,双特异性抗体,ADC药物在临床研究中,用于治疗非小细胞肺癌,结直肠癌,胃肠道肿瘤等疾病。
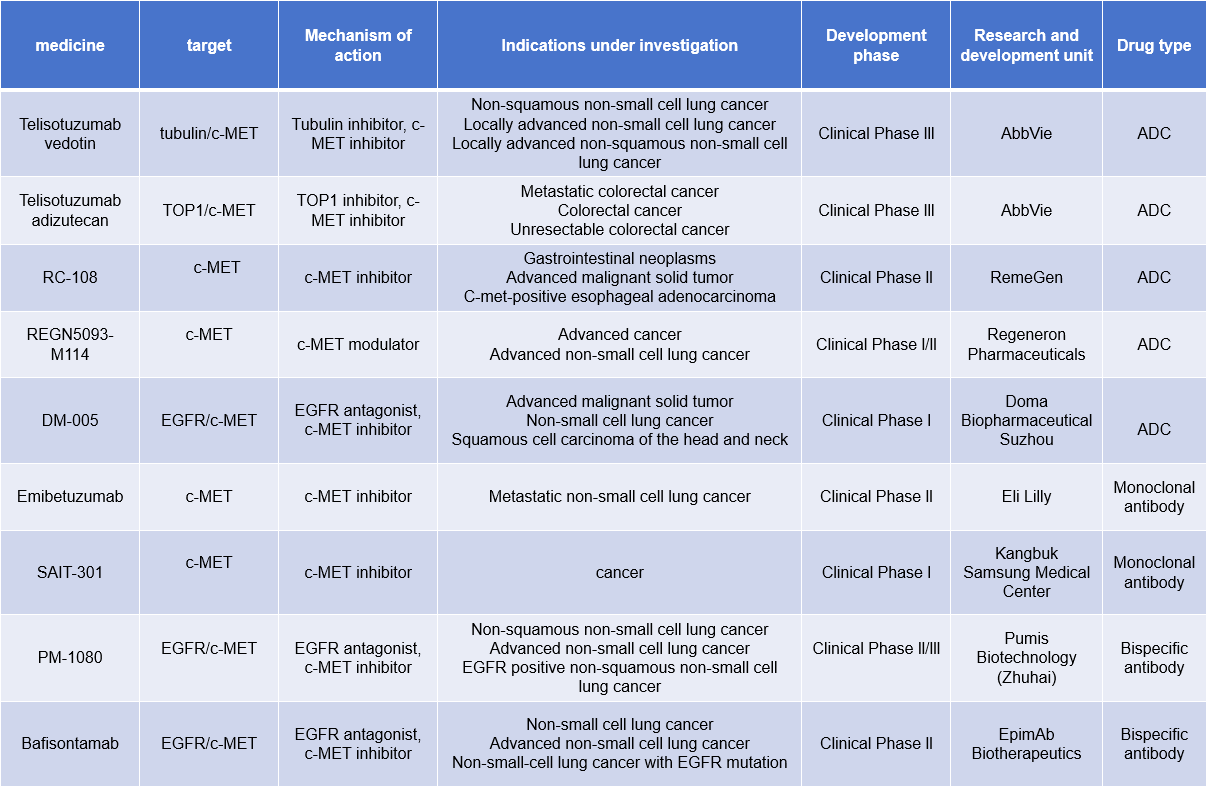
(数据来源 新药情报库)
Telisotuzumab vedotin(ABBV-399)是一款由AbbVie公司开发的一款靶向c-MET的抗体药物偶联物,目前处于3期临床研究阶段,用于治疗非小细胞肺癌。
AbbVie研究的另外一款ADC药物Telisotuzumab adizutecan(ABBV-400)携带TOP1抑制剂作为其有效载荷,处于临床3期研究阶段用于治疗转移性结直肠癌,结直肠癌,不能切除的大肠癌等疾病。ABBV-400使用c-Met向过度表达的细胞递送拓扑异构酶抑制剂,从而抑制DNA复制;这有助于阻止细胞增殖并诱导细胞毒性。

(数据来源 abbvie官网)
Emibetuzumab是一款是一种人源化双价抗c-Met IgG4单克隆抗体,由Eli Lilly开发,用于治疗转移性非小细胞肺癌,处于临床2期研究阶段。它通过阻断肝细胞生长因子(HGF)与c-Met的结合来发挥作用。这种阻断作用抑制了HGF依赖性和非依赖性的MET信号通路的激活,从而抑制肿瘤生长。
Bafisontamab是一款由EpimAb Biotherapeutics公司开发的靶向EGFR/c-MET的双特异性抗体,用于治疗非小细胞肺癌,晚期非小细胞肺癌,EGFR突变的非小细胞肺癌,处于临床2期研究阶段。
我们收集整理一批c-MET相关抗体序列信息。文档可关注公众号“迈思生物 ”,号内回复“c-MET ”下载。

