背景
重组融合蛋白除了在蛋白质纯化、成像等生物研究中广泛应用外,也成为生物制药的一个重要类别,例如许多蛋白质药物与抗体的Fc融合或与载体蛋白融合,以延长其血浆半衰期并达到增强的治疗效果。除此之外它还可以用于药物靶向和药物递送。随着生物技术的快速发展,融合蛋白技术在创造新型蛋白质疗法和改善现有蛋白质药物的性能方面将变得越来越重要。重组融合蛋白的成功构建需要两个不可或缺的要素:融合蛋白和linker。选择合适的linker将蛋白质结构域连接在一起可能很复杂,并且在融合蛋白的设计中经常被忽视。没有linker的功能域直接融合可能会导致许多不良结果,包括融合蛋白的错误折叠、蛋白质产量低或生物活性受损。因此,选择或合理设计连接融合蛋白结构域的linker是重组融合蛋白技术中一个重要但尚未充分探索的领域。

Adv Drug Deliv Rev上一篇名为“Fusion protein linkers:property, design and functionality”的文章,概述了天然存在的多结构域蛋白质中的linker特性,并结合实例讨论已应用于成功构建重组融合蛋白的经验linker。最后,介绍利用重组融合蛋白中的linker可以实现的各种功能,包括改善折叠和稳定性、促进蛋白质表达、增加内在生物活性、能够靶向体内特定位点以及改变药代动力学(PK)融合蛋白的概况。

天然多域蛋白的linker的一般性质
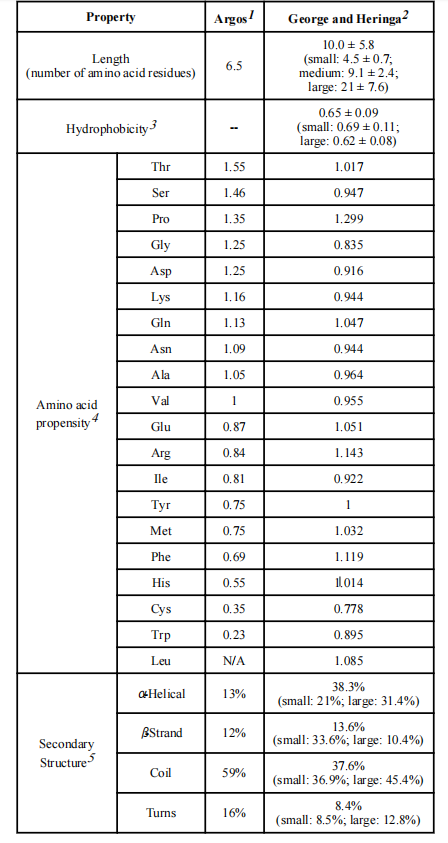
天然存在的多结构域蛋白由两个或多个通过连接肽连接的功能结构域组成。这些连接肽用于连接蛋白质部分,并且还提供许多其他功能,例如维持协同的结构域间相互作用或保留生物活性。研究发现随着连接体长度的增加,溶剂可及性更高。linker的平均疏水性随着长度的增加而降低,表明较长的linker更亲水。
天然linker中氨基酸残基的偏好:优选的氨基酸是极性不带电或带电残基,脯氨酸(Pro)、苏氨酸(Thr)和谷氨酰胺(Gln)是天然linker的理想氨基酸。脯氨酸是一种独特的氨基酸,具有环状侧链,导致其构象非常受限。脯氨酸缺乏酰胺氢可能阻止与其他氨基酸形成氢键,从而减少了linker与蛋白质结构域之间的相互作用。因此,包含脯氨酸残基可能会增加linker的刚性和结构独立性。
天然linker在二级结构中的构象:采用各种构象,如螺旋、β链、卷曲/弯曲和转角,以发挥其功能。基于George和Heringa的二级结构分析,linker被分为两类:螺旋和非螺旋。α-螺旋结构的linker可能作为刚性间隔物有效地分离蛋白质域,并减少它们的不利相互作用。因此,这种构象被许多天然和经验性的linker普遍采用。富含Pro序列的非螺旋linker可以表现出相对刚性的结构,并有助于减少域间干扰。
重组融合蛋白中的经验linker
重组融合蛋白中的经验linker主要分为柔性linker、刚性linker和可切割linker,它们再融合蛋白构建中发挥不同的功能。

柔性linker
柔性linker一般由小型的非极性(甘氨酸)或极性(丝氨酸或苏氨酸)氨基酸组成。这些氨基酸的小尺寸提供了灵活性,使连接的功能域具有流动性。加入丝氨酸或苏氨酸可以保持linker在水溶液中的稳定性,从而减少了linker和蛋白质部分之间的不利相互作用。加入极性氨基酸,如赖氨酸和谷氨酸,以提高溶解度。
常用的柔性linker:例如(GGGGS)n;(G)n;KESGSVSSEQLAQFRSLD和EGKSSGSGSESKST;GSAGSAAGSGEF。
柔性linker的优点:可以用来保持功能域之间的距离,柔性linker的长度可以调整,以便适当折叠或实现融合蛋白的最佳生物活性。
柔性linker的缺点:linker缺乏刚性,由于由于柔性linker相对较短且灵活,连接的蛋白质结构域之间可能发生不希望的相互作用或干扰,可能会致表达产量低或生物活性丧失。
刚性linker
刚性linker通常采用α-螺旋结构或包含多个Pro残基显示出相对刚性的结构。在许多情况下,它们比柔性linker更能有效地分离功能域。通过改变拷贝数可以很容易地调整linker的长度,以实现域之间的最佳距离。当域的空间分离对于保持融合蛋白的稳定性和生物活性至关重要时,会选择刚性linker。
常用的刚性linker(EAAAK)n序列;A(EAAAK)n A(n=2-5)是α螺旋构象;富含脯氨酸的序列(XP)n,其中X代表任何氨基酸,优选为丙氨酸、赖氨酸或谷氨酸,非螺旋连接器中脯氨酸的存在可以增加刚度,并允许有效分离蛋白质结构域。
体内可切割linker
体内可切割linker利用独特的体内过程,并在特定条件下被切割,如还原剂或蛋白酶的存在下。这种类型的连接剂可能减少空间位阻,提高生物活性,或在连接剂切割后实现重组融合蛋白各功能域的独立作用/代谢。
二硫键的还原:利用二硫键的可逆性设计的二硫键linker(LEAGCKNFFPR↓SFTSCGSLE)基于一个含有两个半胱氨酸(Cys)残基之间形成的内部二硫键的二硫环肽,以及两个Cys残基之间的凝血酶敏感序列(PRS)。
特定蛋白酶切割:重组融合蛋白中linker的体内切割也可以通过在病理条件下(例如癌症或炎症)、特定细胞或组织中或在某些细胞区室内表达的蛋白酶来完成,在体内释放自由的活性域。

linker在融合蛋白中的功能
重组融合蛋白中linker最基本的功能是以共价键连接功能域(柔性连接器或刚性连接器)或在所需条件下释放它们(可切割连接器)。连接器还可以在蛋白质药物设计中提供许多衍生的功能,如提高生物活性、增加产量、实现受控或靶向的药物传递,以及实现融合蛋白的可取药代动力学特征。

linker提高融合蛋白的折叠和稳定性
柔性GSlinker:可以用来构建单链可变片段(scFv),由于它的高灵活性允许VH和VL域正确定位,并且不会干扰蛋白域的折叠。通过调整GSlinker的长度,可以优化VH和VL域之间的距离,从而实现功能域的正确折叠和必要的相互作用。
(G)nlinker:(Gly)8linker插入到Myc表位标签和感兴趣的蛋白(Est2p)之间,显著提高了表位标记Est2p的功能。这种改善归因于linker插入后的正确折叠,以及减少了功能域之间的空间位阻。
α螺旋linker:例如(EAAAK)n,可以提供足够的距离,允许蛋白域独立折叠,并且有助于病毒粒子的正确组装。
linker长度和结构对稳定性的影响:随着柔性linker长度增加,融合蛋白的稳定性得到了改善。与柔性linker相比,α-螺旋linker在提高热稳定性方面似乎更有效,这可能是由于α-螺旋linker的刚性结构为蛋白域提供了足够的空间以独立折叠和功能。
linker提高融合蛋白的表达
linker可以减少融合蛋白中不同功能域之间的干扰,促进各个结构域的独立折叠,从而提高融合蛋白的整体表达水平。linker通过提供适当的空间和结构,使得融合蛋白能够在内质网中正确折叠和稳定,减少了由于结构域干扰导致的错误折叠和不稳定性,从而提高了表达量。
linker可以提高融合蛋白的生物活性
融合蛋白中linker可以在结构域之间提供适当的距离,以减少其干扰,恢复或改善折叠,或允许体内释放游离蛋白质药物结构域,最终提高生物活性。例如,粒细胞集落刺激因子(G-CSF)与转铁蛋白(Tf)的融合蛋白,通过插入α-螺旋linker(如A(EAAAK)4ALEA(EAAAK)4A),显著提高了G-CSF的体外生物活性,并且通过口服给药在动物模型中显示出更高的体内疗效。

连接体可以将融合蛋白靶向体内特定位点
linker可以通过增加靶向蛋白域与其受体的结合亲和力,或者通过在特定位点的特异性切割来释放活性蛋白域,从而提高融合蛋白的靶向性。
生理或病理条件下的靶向:对在某些生理或病理条件下变得活跃的蛋白酶敏感的体内可裂解linker是药物靶向的理想选择。例如,凝血因子IX(FIX)与白蛋白融合,通过在凝血过程中被激活的蛋白酶特异性切割linker,从而在凝血位点释放活性FIX。
过度表达的疾病特异性靶向:linker可以包含在疾病部位过表达的蛋白酶的切割位点,使得融合蛋白在疾病部位被特异性切割并释放活性蛋白域。例如,基质金属蛋白酶(MMPs)在多种疾病中过表达,通过在融合蛋白中插入MMP敏感的linker,可以实现在疾病部位的特异性激活。
特异性表达的疾病特异性靶向:linker可以设计成包含特定病原体表达的蛋白酶的切割位点,使得融合蛋白在遇到特定病原体时被激活。例如,通过将抗毒素MazE与毒素MazF融合,并在linker中插入HIV或HCV蛋白酶敏感的切割位点,可以实现在病毒存在时特异性释放毒素。
细胞内靶向:除了细胞外空间外,体内可切割linker的靶向/激活位点也可以位于细胞内部。例如,利用在内质网或溶酶体中活跃的蛋白酶如furin或cathepsin B,可以在融合蛋白进入细胞后在特定位置被切割,释放活性蛋白域。

linker影响融合蛋白的PK
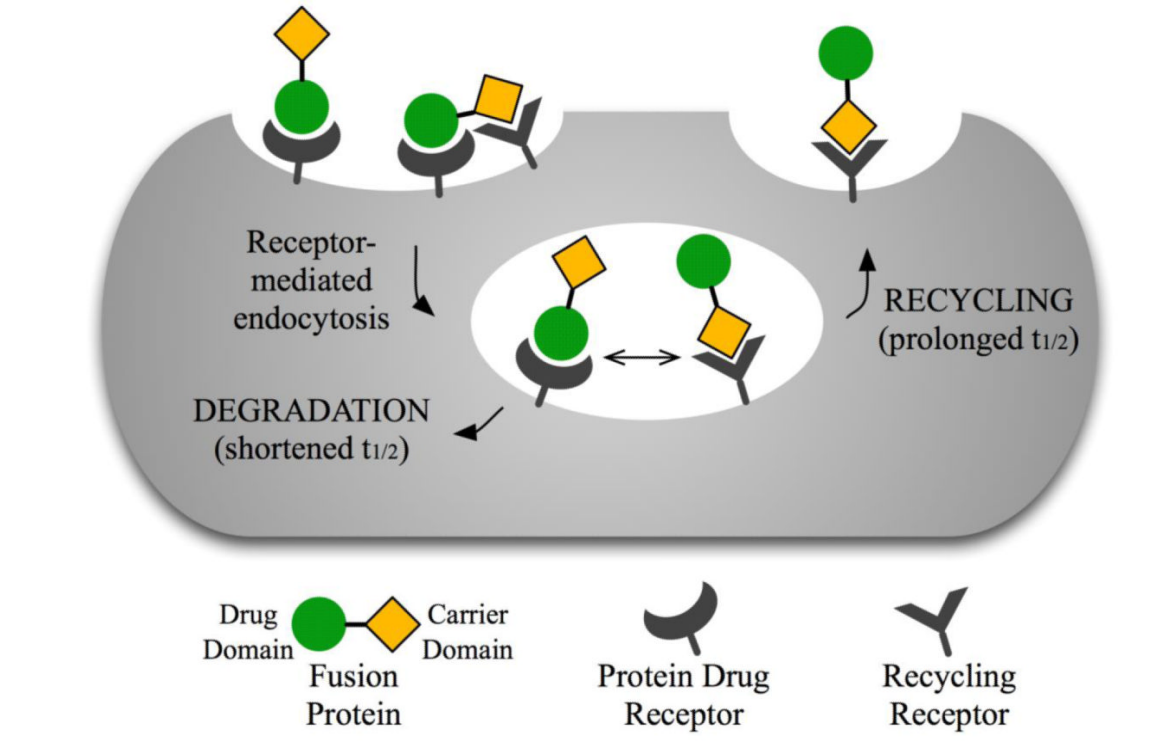
双功能融合蛋白的分布受到两个不同结构域/结合位点的影响,因此它们的PK/PD特性要复杂得多。由于linker插入可能会改变每个蛋白结构域的受体结合亲和力,因此可能会影响融合蛋白的体内处置并增加PK研究的复杂性。
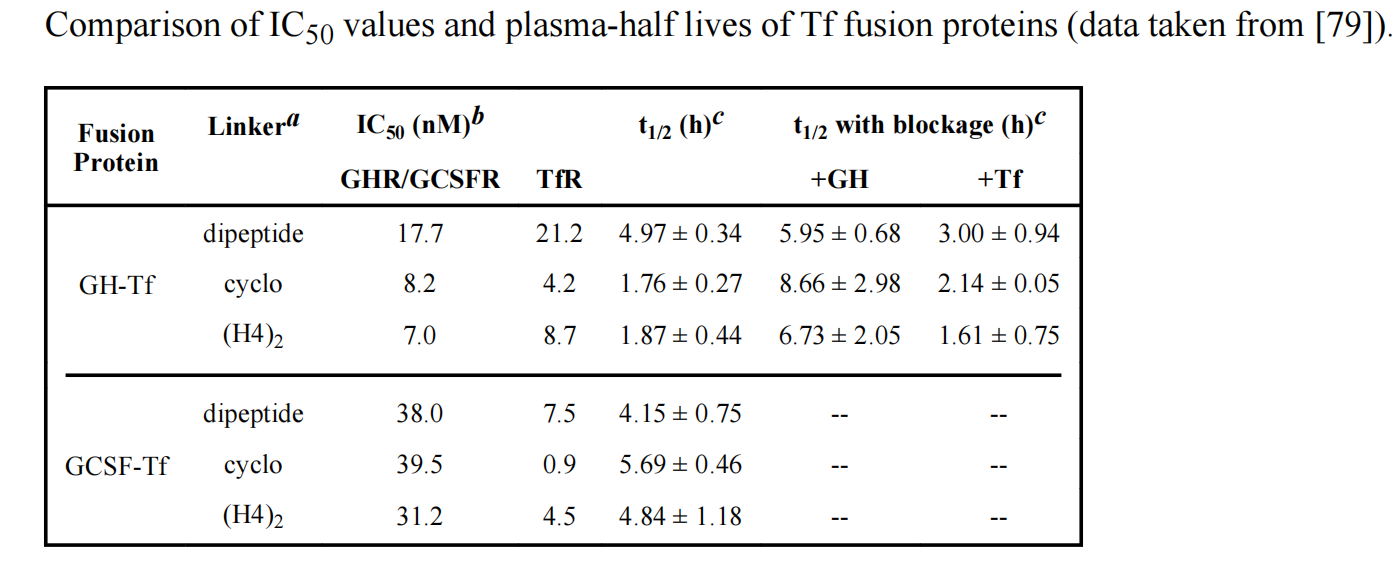
每个蛋白质结构域与其受体的相对结合亲和力(会因不同的linker而改变)会影响融合蛋白的半衰期。
总结
Linker主要有柔性linker,刚性linker,体内可切割linker,最佳linker可以为融合蛋白的生产提供许多优势,包括提高结构稳定性、增强生物活性、提高表达水平、改变PK配置文件以及实现体内融合蛋白的靶向。随着蛋白质科学和生物技术的快速发展,融合蛋白中linker的设计变得比以往任何时候都更加重要。随着未来生物医学研究对其结构、构象和功能的透彻了解,linker的掺入将极大地促进构建用于药物输送应用的稳定且具有生物活性的重组融合蛋白。
