背景
人上皮生长因子受体2(HER2)是一种跨膜糖蛋白,包含细胞外、跨膜和细胞内结构域。HER2过度表达与乳腺癌预后不良相关,并抑制免疫细胞活性,从而抑制抗肿瘤免疫。曲妥珠单抗DB00072)是一种人源化重组全尺寸抗体,可与HER2胞外域IV结合,对乳腺癌具有诊断和治疗功效。但其血液停留时间长、肿瘤穿透速度慢限制了其在某些场景下的应用。
2024年7月16日,研究人员在Biotechnology journal上发表了一篇名为“ Efficient generation of recombinant anti-HER2 scFv with high yield and purity using a simple method”的研究成果,该研究开发了一种在大肠杆菌中生产可溶形式的靶向人上皮生长因子受体2(HER2)的单链片段(scFv)方法。通过优化可变重域(VH)和可变轻域(VL)以及His标签的方向,鉴定出了具有最高HER2结合活性的HL-His型抗体。

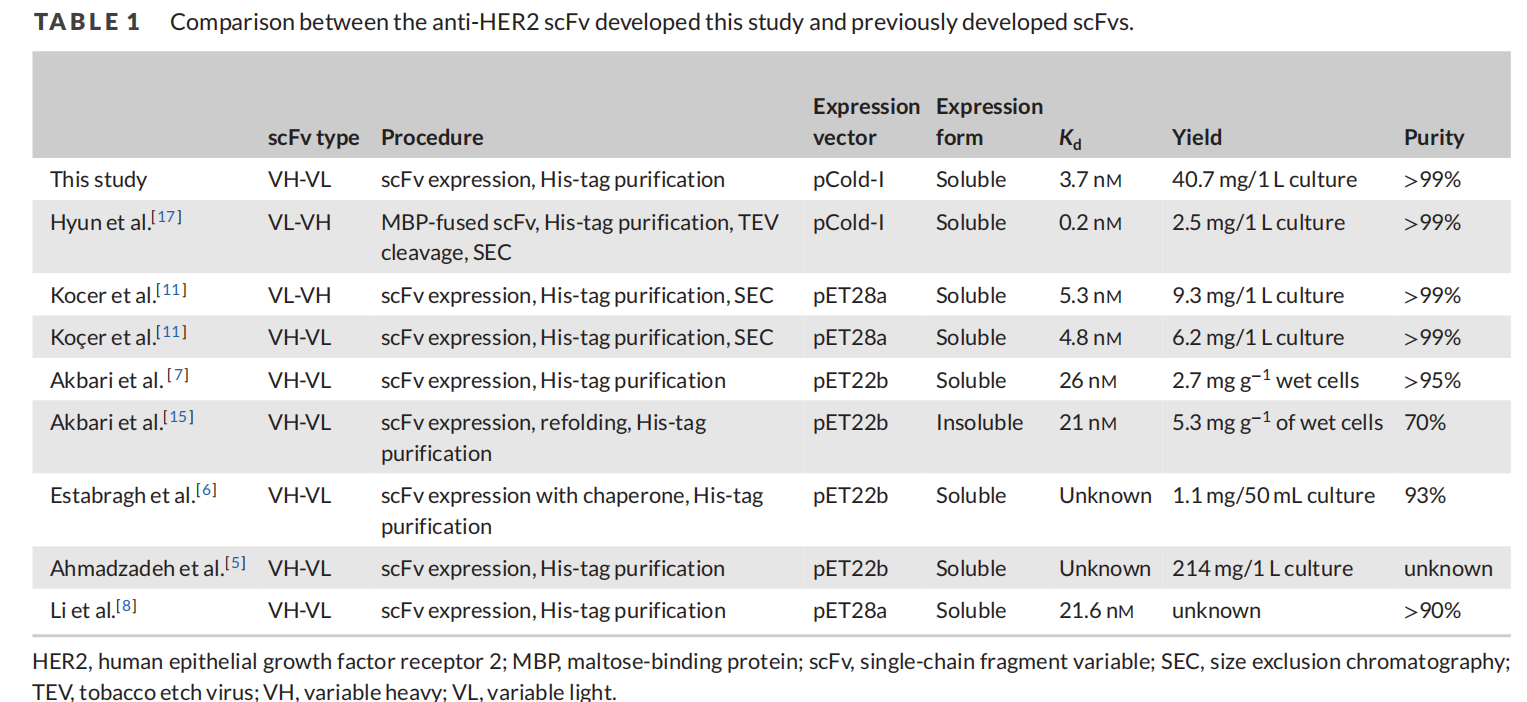
scFv 质粒的构建
基于单抗scFv的结构域取向对于产量和HER2结合效率的重要性以及His标签的位置可以影响蛋白质的三维结构、溶解度和功能,构建了四种具有不同可变结构域方向和His标签位置的scFv,设计了四种质粒:LH-His、His-HL、HL-His和His-HL。
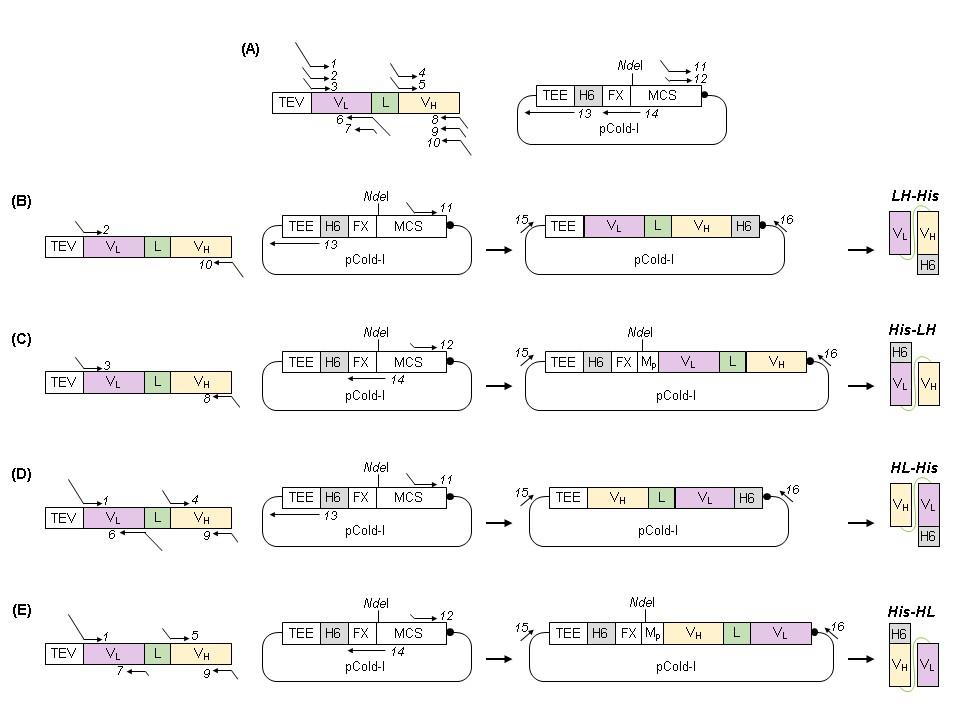
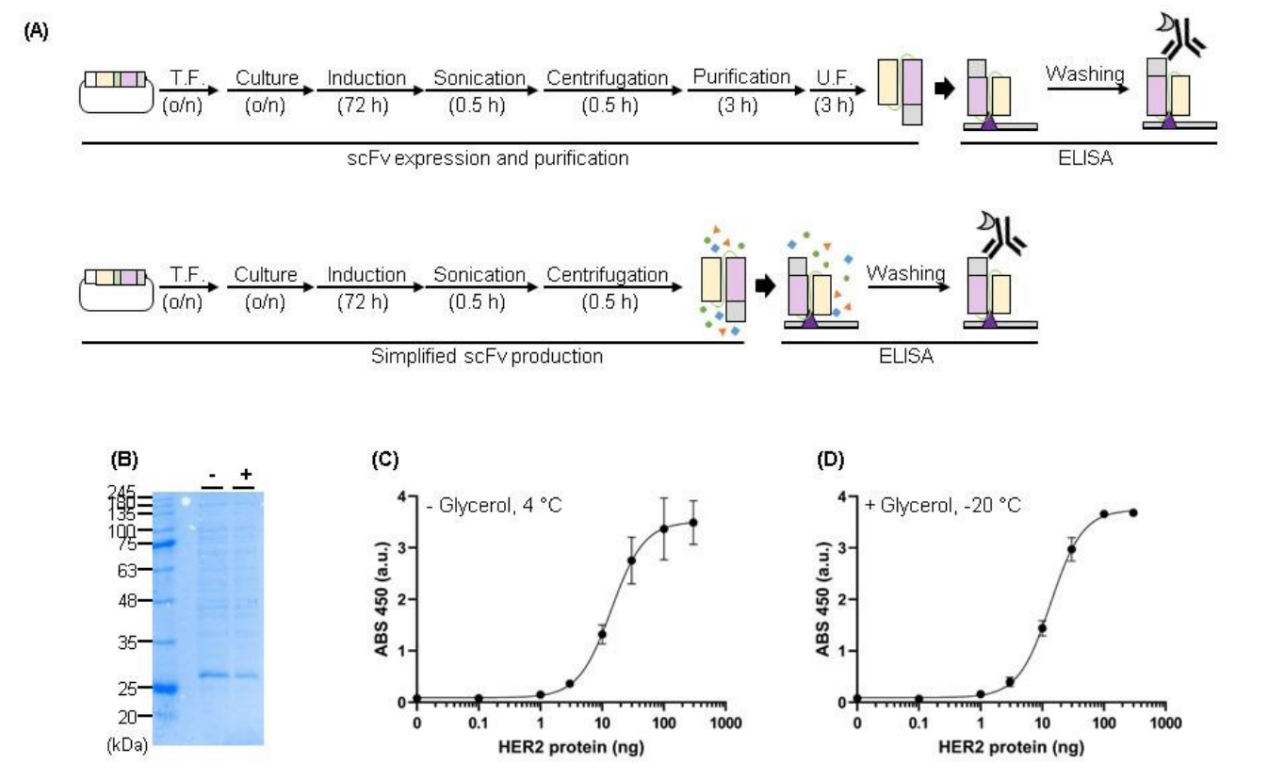
scFv的表达和纯化
使用BL21(DE3)大肠杆菌细胞进行表达,scFv以可溶形式表达,LH-His、His-HL、HL-His和 His-HL的预期大小分别为27.5、28.2、27.5和28.2kDa,1L培养物中LH-His、His-HL、HL-His和His-HL的产量分别为20.3、40.8、40.7和36.9 mg。并且蛋白仅在Ni-NTA纯化后,所有四种蛋白质的纯度就达到了99%以上,无需进一步的纯化步骤,例如尺寸排阻色谱或额外的IMAC技术。
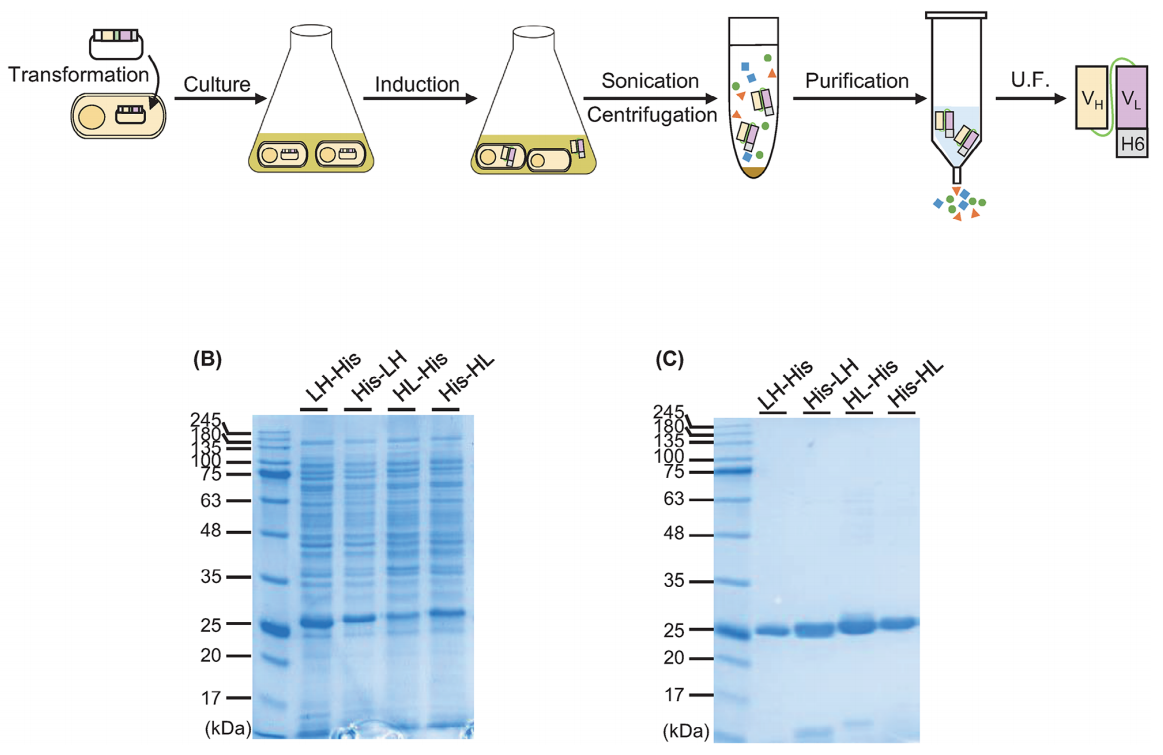
HER2蛋白与scFvs的结合
使用HER2蛋白作为抗原进行ELISA验证不同His标签方向的scFv的抗原结合效率,LH-His、HL-His和His-HL表现出抗原浓度依赖性吸光度信号,未观察到His-LH信号增强。HL-His在这四个scFv中的亲和力最高。这可能是因为N末端His标签可能接近抗体的结合位点,从而阻碍了抗体与抗原的相互作用或者是因为虽然scFv与抗原结合,但二抗(HRP标记的抗His标签抗体)无法与His标签结合。
简化scFv生产
用于生成纯化scFv的整个过程包括蛋白质表达、纯化和超滤,持续时间为5天。为了加快流程,选择直接使用scFv进行ELISA,不进行纯化或UF步骤。20%甘油的scFv在-20°C下冷冻储存后,其抗原结合效率没有显著变化,它能在冷冻循环中保持稳定。甘油的加入不会对scFv的抗原结合效率产生不利的影响,在使用甘油储存时蛋白需要高浓度。未纯化的scFv和His -tag纯化的scFv均保持了抗原结合效果,表明在ELISA过程中洗涤步骤可以去除额外的蛋白质和试剂,并且不影响抗原-抗体结合效率。
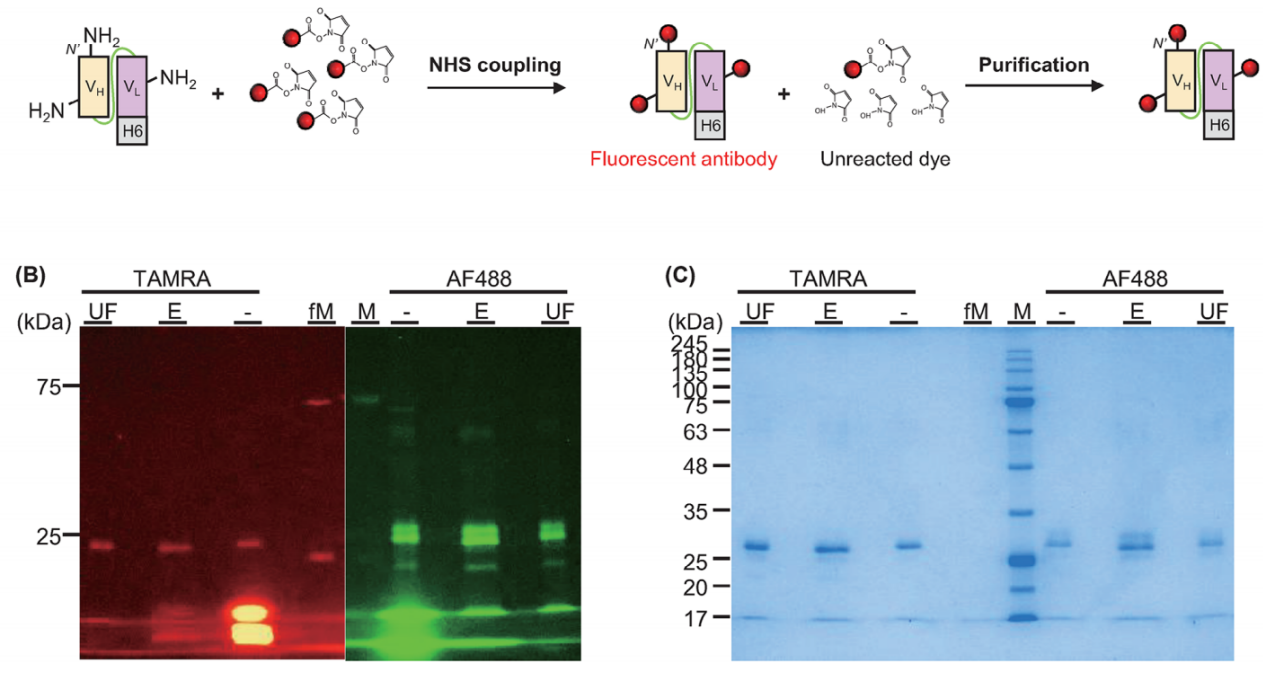
scFv与乳腺癌细胞的结合
使用荧光标记的scFv来可视化scFv与HER2+乳腺细胞的结合活性,结果表明产生的HL-His对细胞表面的HER2具有结合功效。这凸显了荧光scFv在精确检测HER2过表达乳腺癌细胞方面的潜力,从而为准确识别患者中HER2+乳腺癌细胞提供了一种有前途的方法。

总结
在这项研究中,作者开发了一种通过大肠杆菌表达的抗HER2 scFv,C端His标签的HL形式的 scFv,具有较高的HER2结合效率。scFv生产的整个过程可以在4-5天内完成,并且流程简单,不需要多个纯化步骤,其产量超过了以前发表的具有相同可变结构域序列的其他抗HER2 scFv 的产量。本研究中产生的抗HER2 scFv应用广泛,有可能提高现场乳腺癌诊断的准确性。这种scFv通过简单的工艺产生,具有高HER2结合活性,在免疫测定中具有巨大的潜力,可以作为检测HER2阳性乳腺癌的诊断剂,也可以作为免疫治疗中的乳腺癌特异性药物。