间皮素(MSLN)是一种细胞表面结合的糖基磷脂酰肌醇(GPI)锚定蛋白。膜锚定形式可能在细胞粘附中起作用,它又称为巨核细胞增强因子(MPF)促进体外巨核细胞集落形成。MSLN通常局限于身体的间皮表面,但在广泛的实体瘤中显著过表达。因此,MSLN已成为开发新型免疫疗法的重要靶标。
MSLN的表达分布
MSLN主要表达在腹膜、胸膜腔和心包的间皮细胞中。MSLN在多种实体肿瘤中呈现高度过表达,如间皮瘤、上皮性卵巢癌、胰腺癌、胆管癌、胃癌、肺癌、食管癌、宫颈癌以及卵巢癌等。特别是在间皮瘤中,其表达水平显著且与肿瘤的恶性程度相关。
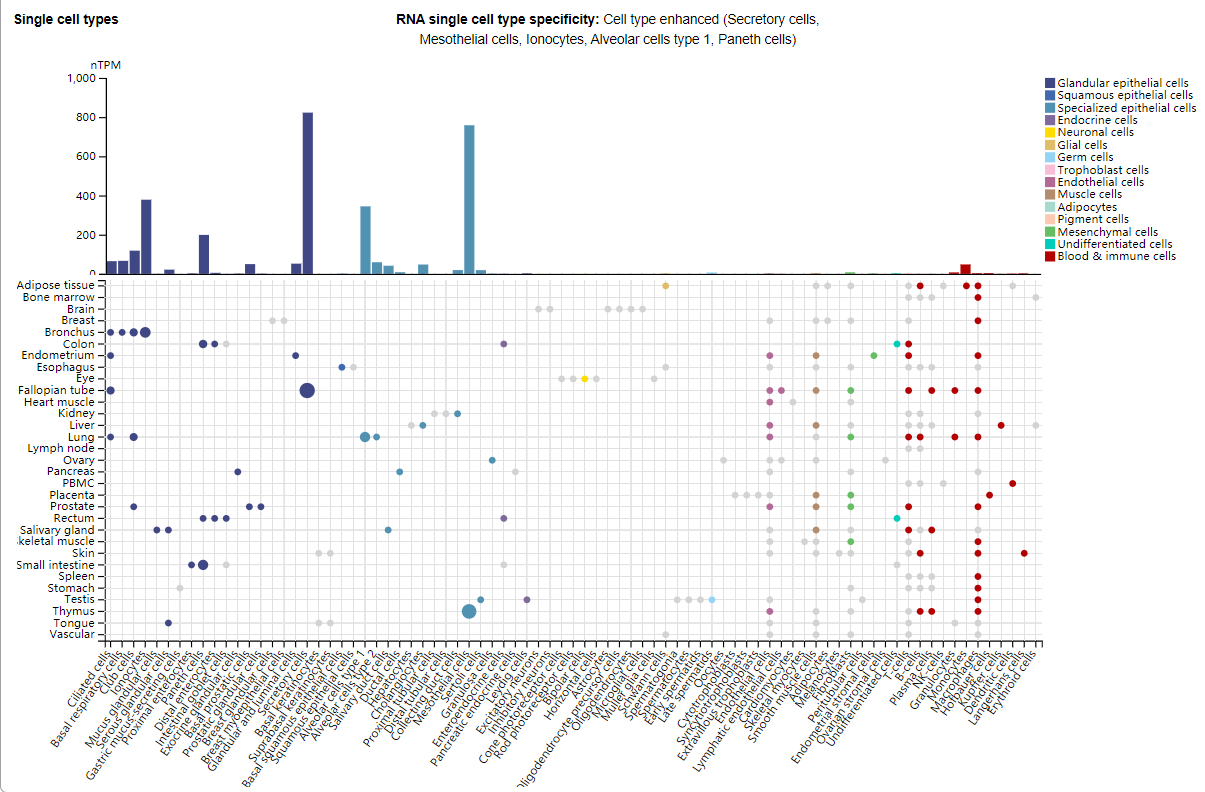
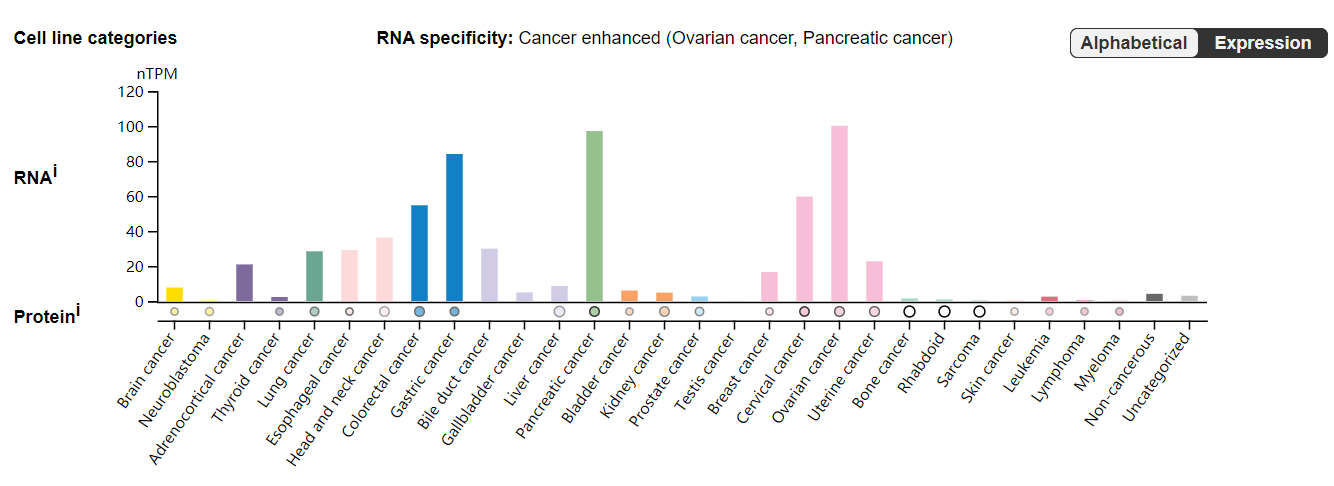
(数据来源 uniprot)
MSLN的结构和成熟
MSLN是一种71kDa的前体蛋白,可被furin蛋白酶水解为两个部分:40kDa大小的GPI锚定的膜结合蛋白的间皮素和31kDa大小的分泌片段巨核细胞集落刺激因子(MPF)。MSLN由脱落酶(如ADAM家族成员)从细胞膜上脱落。MSLN在体内有3种类型:前体蛋白,成熟的MSLN和MPF,以及可溶性MSLN。
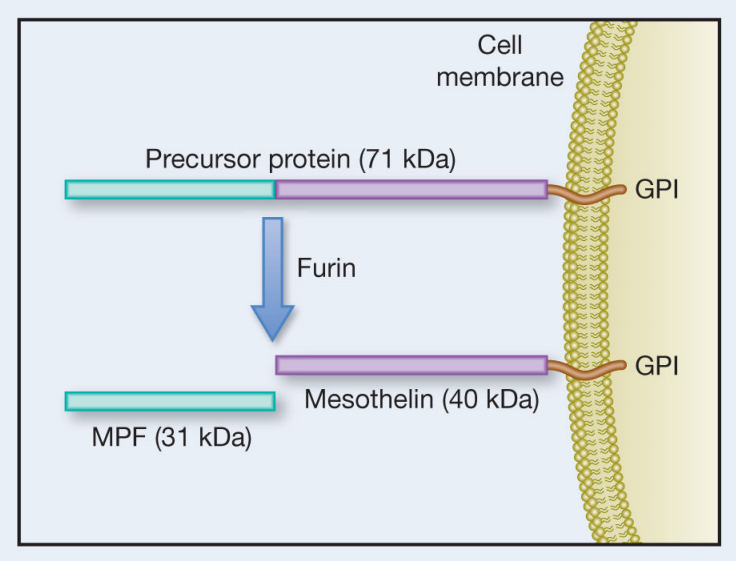
(数据来源 Pastan I, et al. Cancer Res. 2014)
MSLN在癌症中的信号转导
间皮素没有激酶结构域,但通过未知的机制激活下游的致癌途径,促进细胞增殖、细胞存活、侵袭和转移。在OC、PDAC、上皮样Meso、腺NSCLC、CRC和GC中,CA125结合间皮细胞上间皮素的N端,导致SGK3/FOXO3活化,随后抑制DKK1。在PDAC模型中,CA125/MSLN相互作用还通过p38/MAPK通路增加了MMP7的表达。
SMRP与膜相关间皮素的结合通过激活ERK1/2,AKT和JNK途径上调MMPs,导致细胞黏附丧失、肿瘤细胞获得成纤维细胞表型,这标志着内皮-间充质转化的发生,与细胞侵袭、迁移以及对化疗的耐药性有关。
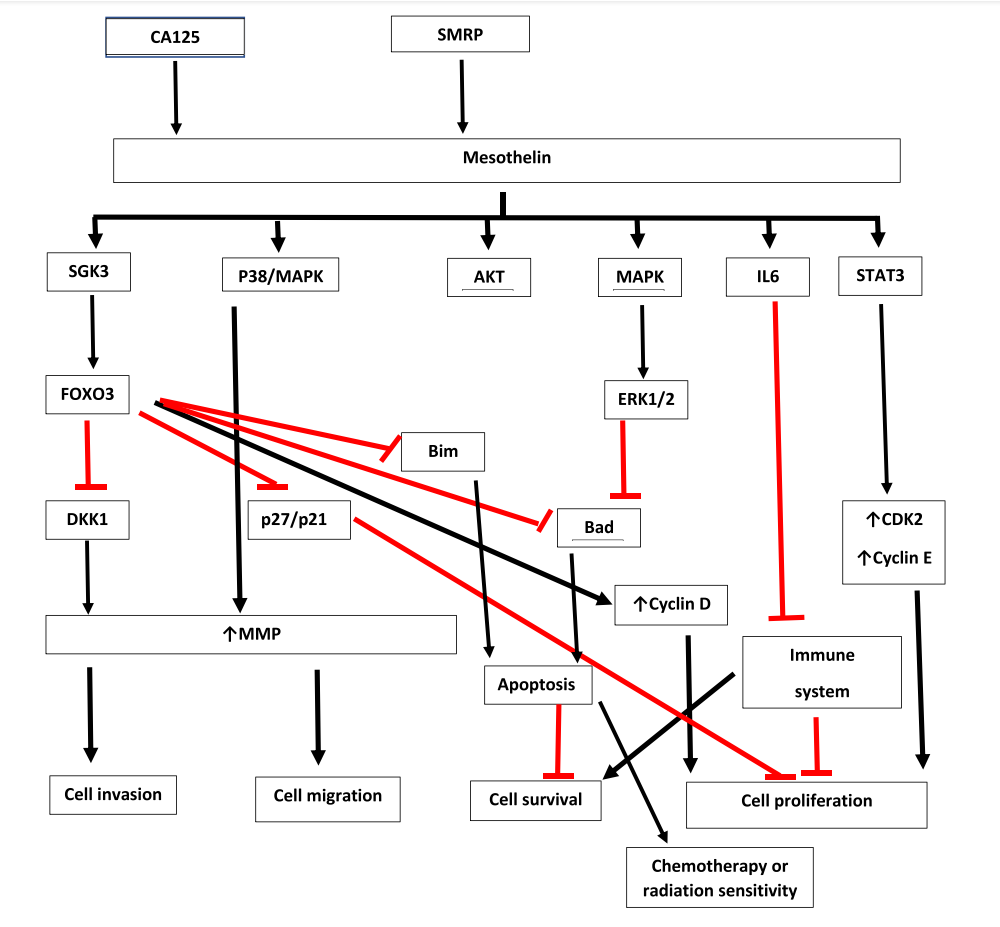
(数据来源 Chu Q. Curr Oncol Rep. 2023)
MSLN的靶向治疗
MSLN 在正常组织中的有限表达及其在多种肿瘤中的过表达使MSLN成为有吸引力且有前途的治疗靶点。目前已经开发了各种类型的抗间皮素疗法,包括抗体、抗体药物偶联物(ADC)、免疫毒素、癌症疫苗和CAR-T细胞免疫疗法。
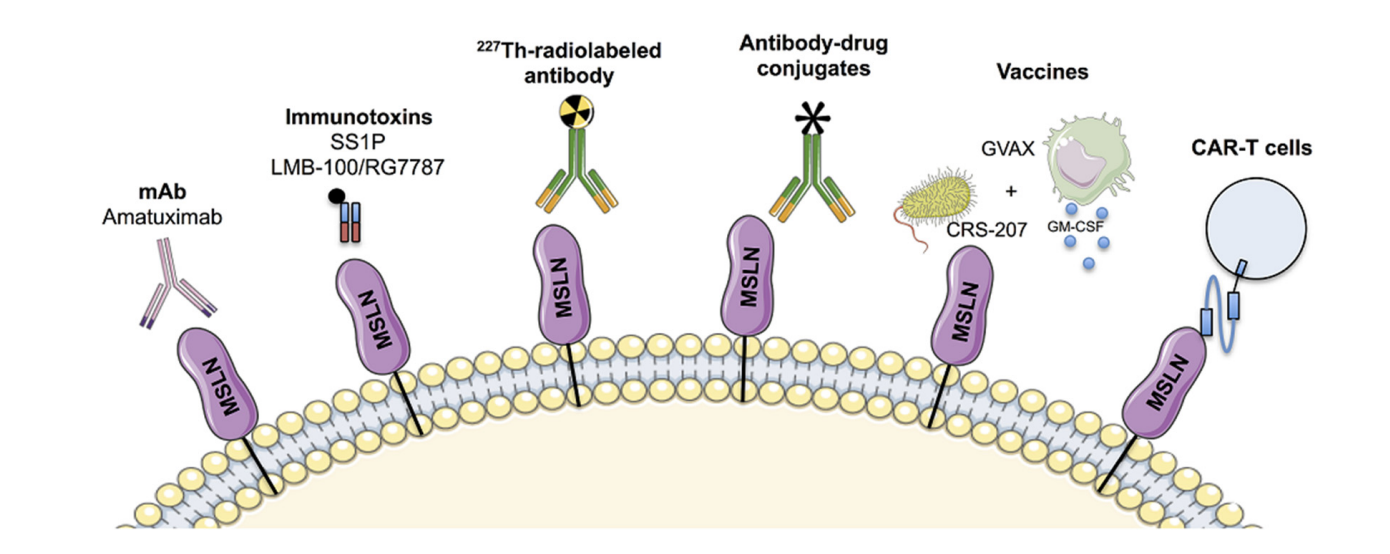
(数据来源 Montemagno C, et al. Int J Mol Sci. 2020)
Amatuximab(MORAb-009)是一种靶向MSLN的嵌合高亲和力单克隆抗体,可抑制MUC16/MSLN相互作用。Amatuximab通过抗体依赖性细胞毒性根除肿瘤细胞。
Anetumab ravtansine是一种ADC,全人源IgG1单克隆抗体,通过二硫键与DM4连接,能特异性结合MSLN的N端,而不干扰MSLN与CA125的相互作用。在纳米摩尔浓度下,它可被高表达MSLN的肿瘤细胞优先摄取,经内吞作用后,DM4干扰微管蛋白的形成,诱导肿瘤细胞凋亡,同时DM4 或其代谢产物可扩散到邻近细胞,产生旁观者杀伤效应。Ⅰ期临床试验显示,Anetumab ravtansine 在间皮素阳性的恶性胸膜间皮瘤和卵巢癌患者中具有一定的抗肿瘤活性,但也会引起一些不良反应,如疲劳、恶心、腹泻等。在一项随机Ⅱ期临床试验中,Anetumab ravtansine与长春瑞滨相比,在previously treated Meso患者中的mPFS和mOS并无显著优势,但事后分析表明,高表达MSLN的患者在Anetumab ravtansine组的预后更好。
ABBV-428可同时靶向MSLN和CD40。CD40是肿瘤坏死因子受体超家族成员,在临床试验中,ABBV-428在部分患者中显示出一定的抗肿瘤活性,但由于未达到最大耐受剂量,且未观察到明显的免疫激活变化,其临床开发已被终止。
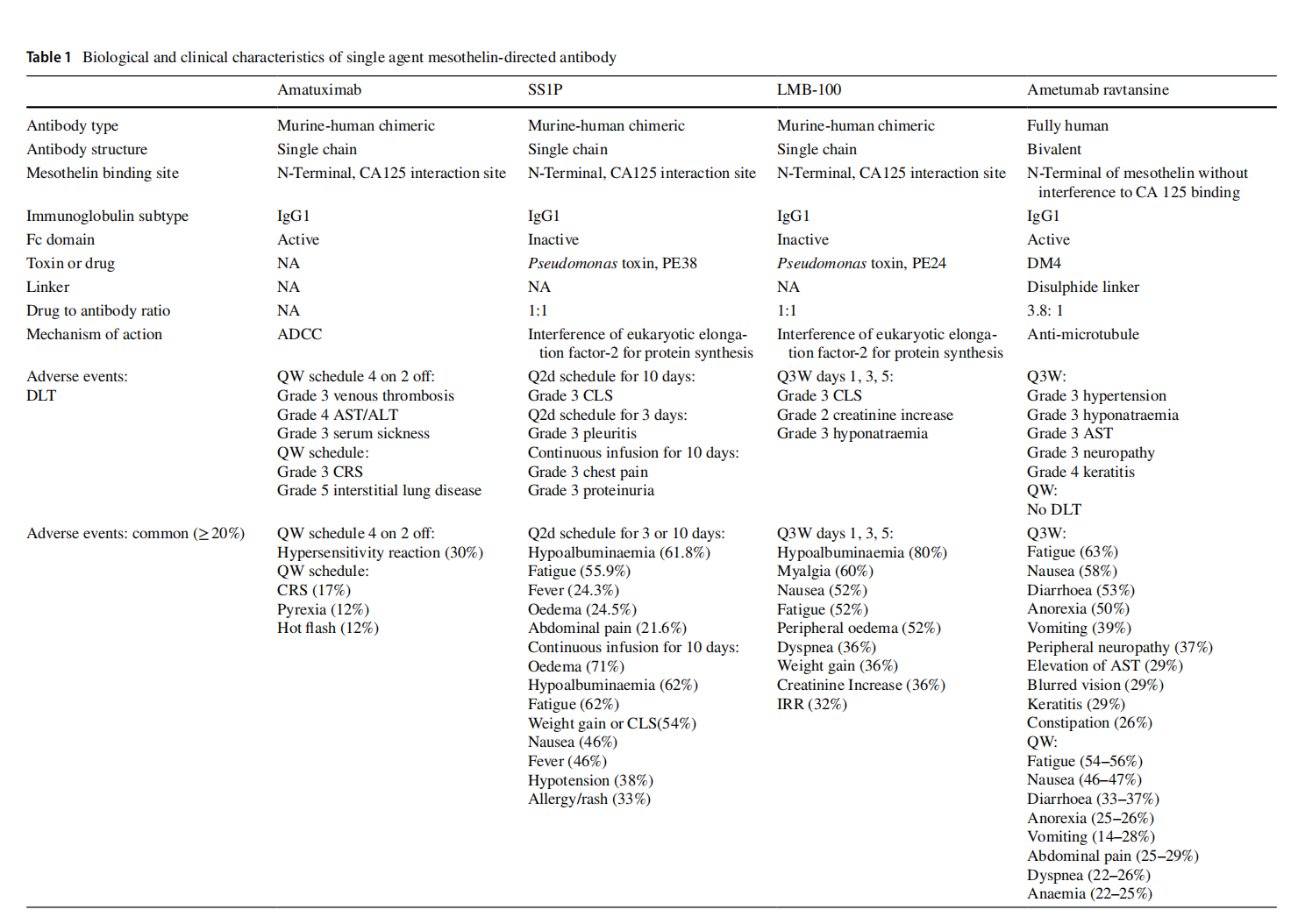
(数据来源 Chu Q. Curr Oncol Rep. 2023)
CAR-T 细胞疗法已成为治疗MSLN高表达的实体瘤的一种有效策略,目前针对MSLN的十几项 CAR-T,CAR-NK细胞疗法的安全性、作用和最大耐受剂量正在临床试验中进行评估。
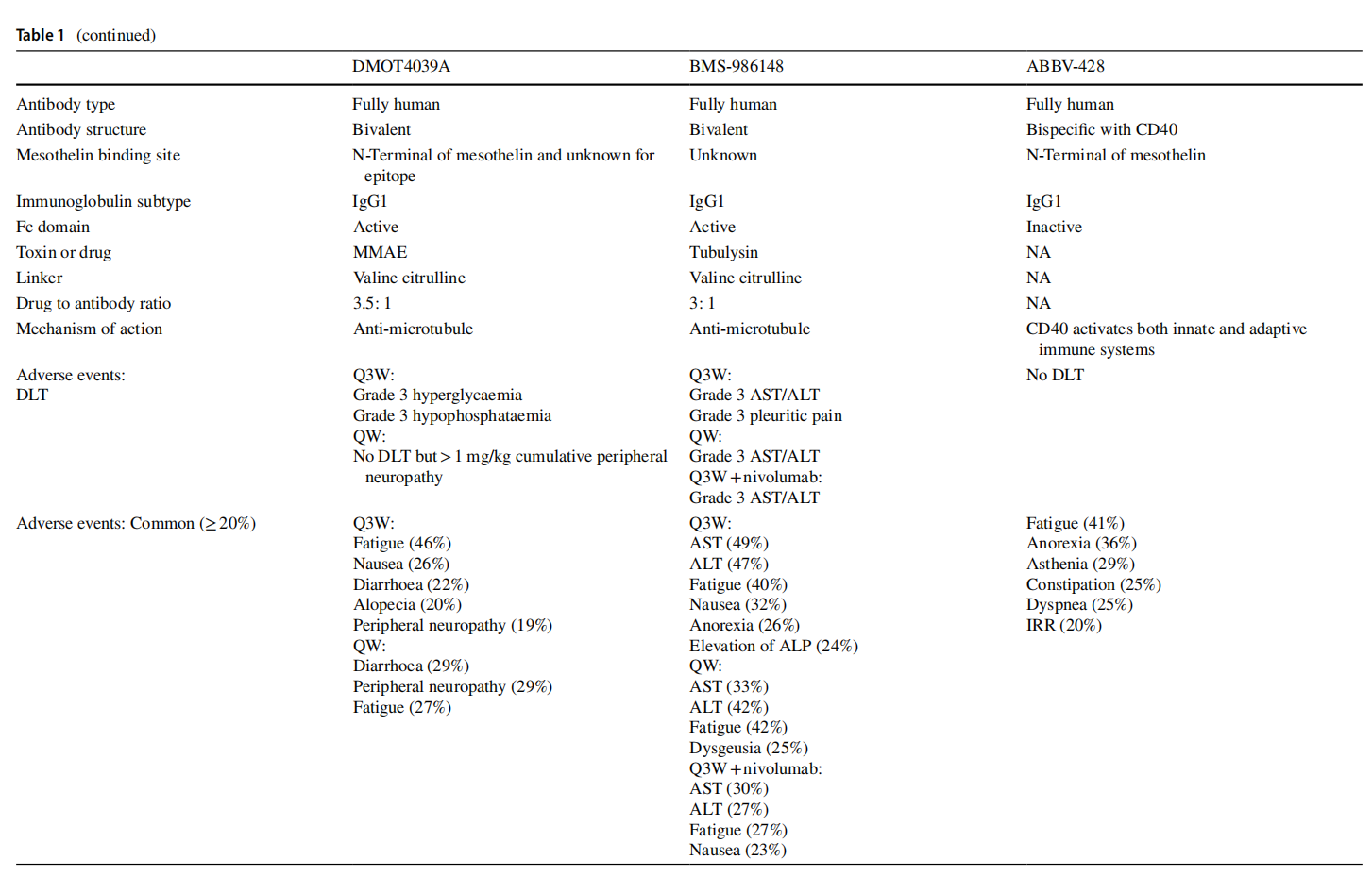
(数据来源 Klampatsa A, et al. Expert Opin Biol Ther. 2021)
我们收集整理一批MSLN相关抗体序列信息。文档可关注公众号“迈思生物”,号内回复“MSLN”下载。

