背景
使免疫球蛋白G(IgG)型抗体自主内化并定位于靶细胞的胞质(称为胞质穿透抗体,CT)具有挑战性,但具有很高的前景。CT进入细胞质的主要障碍是有限的内体逃逸。
2025年4月11日韩国首尔国立大学金勇晟教授在J Control Release上发表了一篇名为“Engineering IgG antibodies for intracellular targeting and drug delivery”的文章,研究人员开发了第二代(2G)CT,命名为in2CT4.1,它具有一个含有精氨酸-色氨酸对的核内体酸性pH响应的核内体逃逸基序(R-W/E基序)和一个位于IgG1/k抗体CH3和CL结构域的Glu补丁。这一基序在酸性的内体pH下选择性地破坏内体膜,以促进胞质进入,而在中性pH下保持无活性。2G CT,in2CT4.1,在纳摩尔浓度下实现了有效的胞质定位,表明与第一代CT相比,约高3倍的内体逃逸效率。2G CT的潜力是通过在in2CT4.1中通过α-微管蛋白特异性可变结构域构建细胞溶质α-微管蛋白靶向CT来验证的。

在HC的CH3结构域设计pH响应的内体逃逸基序
在CH3结构域的底部尖端确定了三个关键突变区域用于在IgG的CH3结构域中创建pH响应的内体逃逸基序(R-W/E基序)。AB环(残基353-362aa);EF环(残基411-423aa);G股(残基439-437aa)。这些区域可以增强同二聚体CH3结构的亲和力,对这些区域突变不会影响Fc的功能。
E-patch在R-W/E基序的pH依赖行为中的关键作用。基于MD模拟结果,作者提出核内体酸性pH响应的R-W/E基序的工作机制:在中性pH值下,E-patch的负电荷排斥质膜,阻止相邻的R-W对结合。相反,在酸性内体环境中,E-patch的部分质子化减少了其负电荷,使R-W对能够与内体膜相互作用并破坏其稳定性,从而促进内体逃逸。

在CH3结构域内具有R-W/E基序的CTs的细胞质定位
用分裂GFP互补实验,所有六种设计的CT变体(in2CT1.N)均显示出比1G CT更高的GFP互补荧光,in2CT1.1和in2CT1.9表现出最高的信号,表明in2CT1具有穿透细胞质的能力。缺乏内体逃逸能力的对照抗体(如inCT(AAA)和传统治疗性抗体)未观察到GFP互补荧光。使用SLEEQ分析方法评估内体的逃逸效率,in2CT1.1和in2CT1.9 CT在0.5μM下作用12小时显示出显著增强的逃逸效率,表明R-W/E基序显著提高了CTs的内体逃逸能力。in2CT1.1和in2CT1.9对台肽类蓝的摄取比用inCT对台肽类蓝的摄取高3倍,这与在GFP和荧光素酶互补实验中观察到的2倍增强一致。in2CT1.1 w/o E在pH 5.5和pH 7.4下都允许染料摄取,表明E-patch在酸性条件下选择性胞内体逃逸中的关键作用。

将R-W/E基序并入CL结构域赋予CT穿透细胞溶胶的能力
CL结构域在AB和EF环中具有较短的α-螺旋,与CH3结构域相似。将in2CT1.1和in2CT1.9的CH3结构域的R-W/E内体逃逸基序整合到inCT(AAA)的CL中结构域中的结构等效位置,创建了in2CT2.1和in2CT2.2变体。在细胞质穿透试验中,in2CT2.1的细胞质穿透效率与inCT相当,但比in2CT1.1低约2倍。in2CT2.1在Ramos细胞中表现出pH依赖性的膜成孔活性。R-W/E 内体逃逸基序可以有效地整合到CL结构域中,赋予CTs细胞质渗透能力,同时不损害其生物物 理特性。

在CH3和CL结构域均含有R-W/E基序的in2CT4.1的特性
在CH3和CL之间引入R-W/E基序构建2G CTs,in2CT4.1在MDA-MB-231/SA-GFP1-10细胞中显示出显著的GFP互补荧光,in2CT4.1与前体克隆in2CT1.1和in2CT2.1相比,细胞质穿透效率显著提高,约提高了2.6倍。
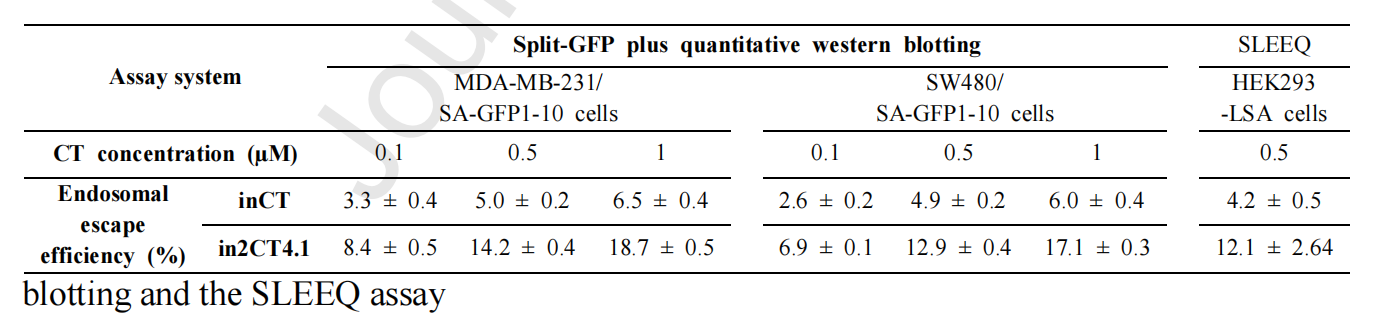

通过脉冲追踪实验发现in2CT4.1从内吞体逃逸主要发生在酸化程度更高的晚期内吞体,而非早期内吞体。in2CT4.1仅在弱酸性pH下与膜相互作用并诱导膜孔用于胞内体逃逸。

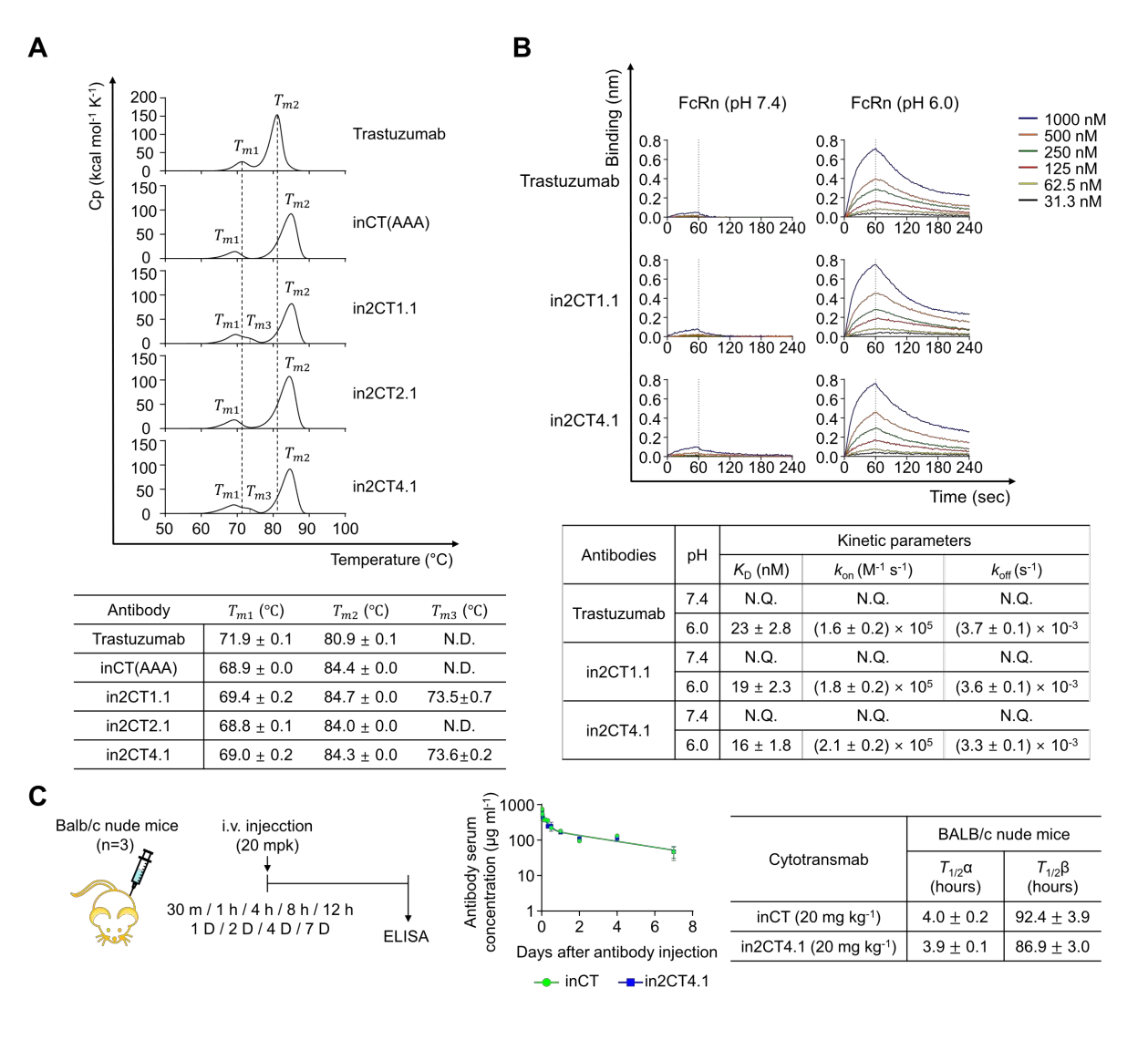
使用差示扫描热量法评估in2CT4.1的热稳定性,发现CH2结构域的热变性中点(Tm1)和Fab/CH3结构域的热变性中点(Tm2),分别约为70° C和81° C,与全长IgG1/κ抗体的特征相符。in2CT4.1的CH3和CL结构域环中的R-W/E基序突变并不影响其与FcRn的相互作用,FcRn 主要与Fc区的CH2-CH3接口结合。2G CT(in2CT4.1)保留了FcRn结合能力,其血清半衰期与野生型IgG1/κ抗体相当,说明2G CT保留了抗体的固有特性。
2G CT平台的优势
它可以通过结合特异性VH/VL结构域直接靶向细胞溶质蛋白,或整合到受体靶向抗体的CH3/CL恒定结构域,从而在保持抗原特异性的同时赋予细胞溶质穿透能力。这种通用性与1G CT相比具有显著优势,在1G CT中,内体逃逸基序局限于VH/VL结构域,限制了靶向的灵活性。2G CT它可以有效地将细菌毒素传递到肿瘤细胞的细胞质中,杀死目标肿瘤。

总结
本研究通过在重链的CH3结构域和轻链的CL结构域中引入pH响应性内体逃逸基序,构建了2G CT,它是一种具有内在细胞质穿透能力的全长IgG1/κ。2G CT平台能够开发出针对此前难以成药的细胞质蛋白的治疗性抗体,并且是需要将功能性有效载荷精确递送至细胞质的应用中的宝贵 工具。它可以有效地将细菌毒素传递到肿瘤细胞的细胞质中,杀死目标肿瘤。与1G CT相比,2G CT的内体逃逸效率提高了3倍,同时保持了理想的生物物理特征,包括热稳定性和FcRn结合亲和力,和典型的IgG/κ抗体一致。未来的研究应集中于扩展2G CT平台的应用,以递送包括核酸和酶在内的一系列治疗载荷,并优化内体逃逸基序以提高效率。此外,评估基于2G CT的治疗在临床环境中的长期稳定性和免疫原性对于将该技术转化为有效的治疗至关重要。
