转化生长因子β(TGF-β、TGFB),它是一种多功能细胞因子,TGF-β信号传导是胚胎发生、组织稳态和癌症进展中的关键途径。TGF-β包括3种亚型,TGF-β1、TGF-β2和TGF-β3。其中TGF-β1是研究的最广泛的亚型。只有活化的TGF-β才能与TGF受体复合物结合,并诱导TGF-β信号转导的经典和非经典途径。
TGFB的表达分布
TGFB主要表达在绒毛外滋养层,NK细胞,树突状细胞,T细胞,单核细胞中。在B细胞,浆细胞,巨噬细胞,朗格汉斯细胞中也有少量表达。

(数据来源 uniprot)
TGFB的生物合成和活化
每个TGF-β多肽单体最初是以前体多肽的形式合成,在内质网中,TGF-β前体失去信号肽并通过二硫键二聚化。二聚体然后转运到高尔基体,在那里它们被蛋白酶furin切割成成熟的细胞因子片段和潜伏相关肽(LAPs),形成小潜伏复合体(SLCs)。分泌的SLCs可以进一步与潜伏的TGF-β结合蛋白(LTBPs)连接,LTBPs将SLCs靶向到细胞外基质(ECM)中储存,或者可以与糖蛋白A重复优势蛋白(GARP)或富含亮氨酸重复蛋白33(LRRC33)连接,将SLCs固定在细胞表面。酸、碱、活性氧(ROS)、血小板反应蛋白-1(TSP-1)、某些蛋白酶和整合素等多种因子可从潜伏复合物中释放成熟细胞因子,因此被称为TGF-β激活剂。

(数据来源 Deng Z, et al. Signal Transduct Target Ther. 2024)
TGFB的信号通路和调控
在LAP释放后被激活,TGF-beta-1通过与TGF-beta受体(TGFBR1和TGFBR2)结合来发挥作用,这些受体传递信号。活化的TGF-B1通过SMAD依赖和/或SMAD非依赖途径发挥作用。
SMAD依赖途径:TGF-B1与细胞表面特异性受体结合后,磷酸化的TbR-I募集并磷酸化SMAD2和SMAD3。磷酸化的SMAD2和/或SMAD3与SMAD4结合形成三聚体复合物,可调节细胞核内的基因表达。
非SMAD依赖通路:TGF-B1与受体结合后,磷酸化的TbR-I募集并磷酸化PI3K-AKT、p38 MAPK、NF-kB、ERK等信号分子,参与基因表达的调控。
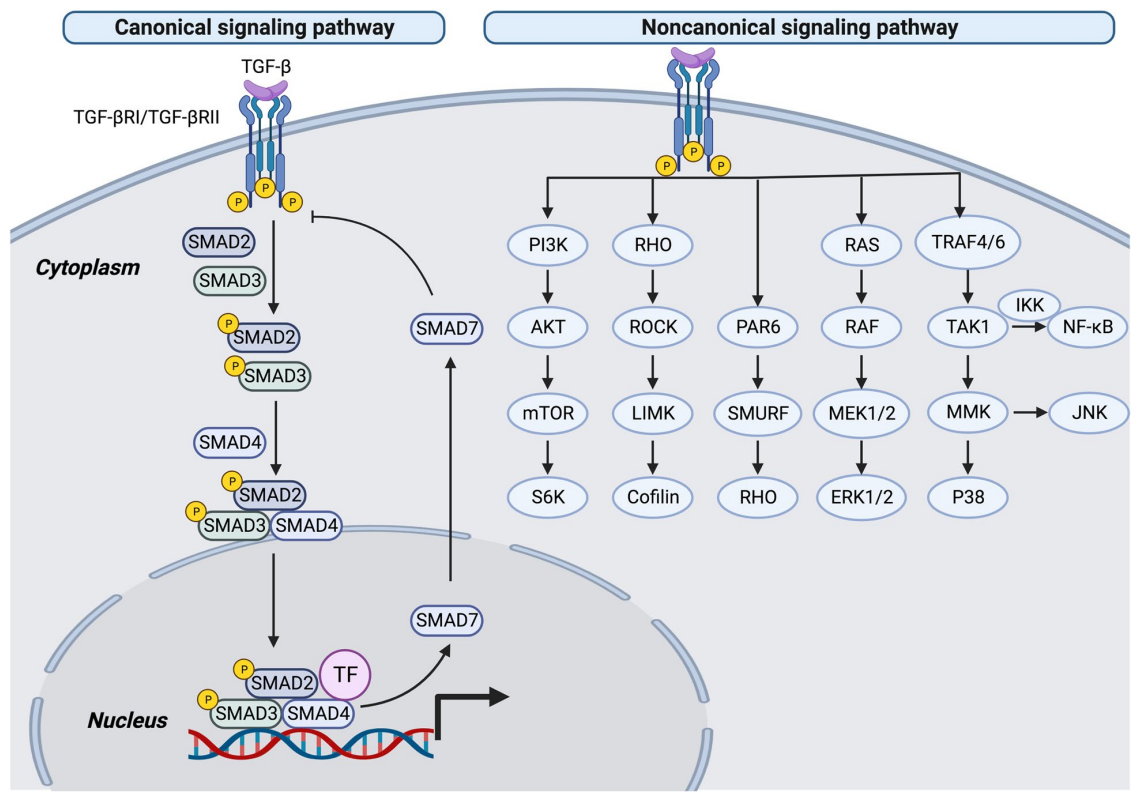
(数据来源 Tie Y, et al. Mol Biomed. 2022)
TGFB在疾病中的功能
TGF-β信号在调节TME中起着关键作用,对癌症的进展有复杂的影响。TGF-β在肿瘤进展过程中具有双重作用,在癌症的早期阶段作为肿瘤抑制因子,在癌症的晚期阶段如乳腺癌、肝细胞癌、肺癌和胰腺癌中作为肿瘤促进因子。TGF-β抑制免疫抑制的髓系细胞的增殖,尤其是在早期癌症中。在晚期肿瘤中,髓系细胞产生的TGF-β抑制抗肿瘤免疫,从而促进肿瘤转移。肿瘤细胞、内皮细胞、间充质干细胞、癌相关成纤维细胞和巨噬细胞可以诱导TME中TGF-β的生产和分泌。TGF-β通过调节TME中免疫细胞的多种功能来抑制肿瘤免疫反应。
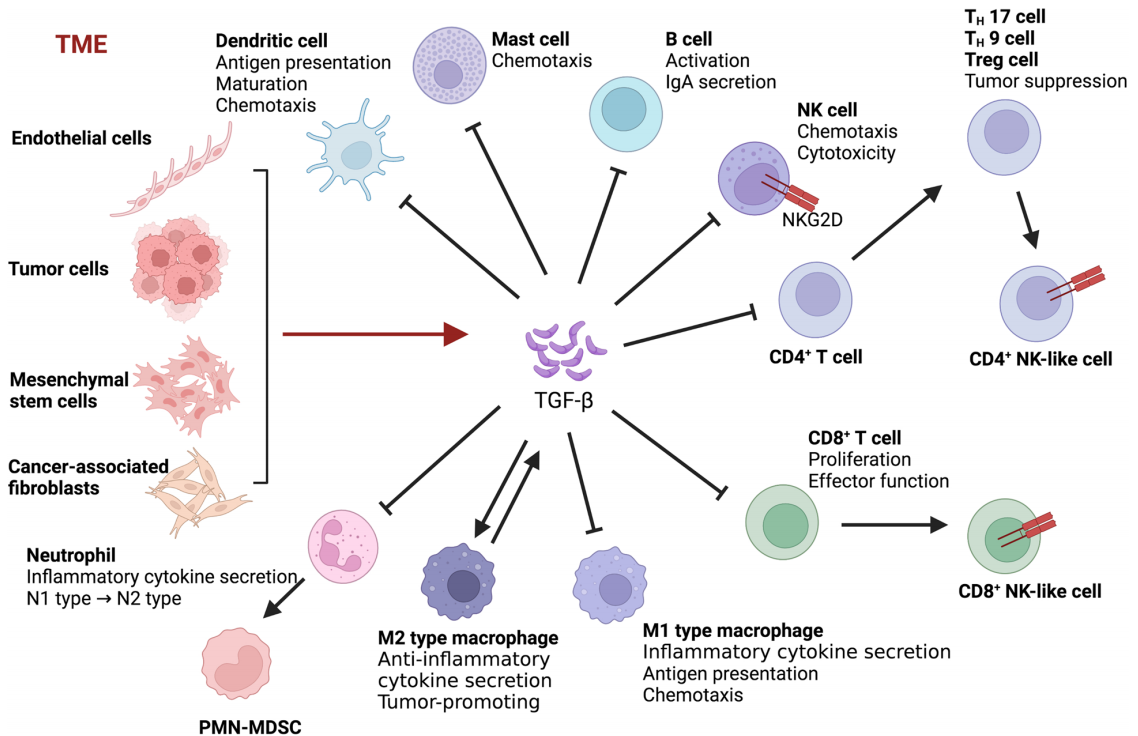
(数据来源 Tie Y, et al. Mol Biomed. 2022)
过度表达的TGF-β与纤维化形成和发展的纤维化疾病(如肺纤维化、肝纤维化、肾纤维化、心纤维化和系统性硬化病)有关。TGF-β在调节纤维化病灶中巨噬细胞的募集和功能方面至关重要。它作为巨噬细胞的趋化因子,导致巨噬细胞向纤维化病灶募集。反过来,TGF-β诱导巨噬细胞分泌促纤维化细胞因子,从而增强TGF-β的活性。此外,TGF-β还刺激巨噬细胞表达ECM蛋白。
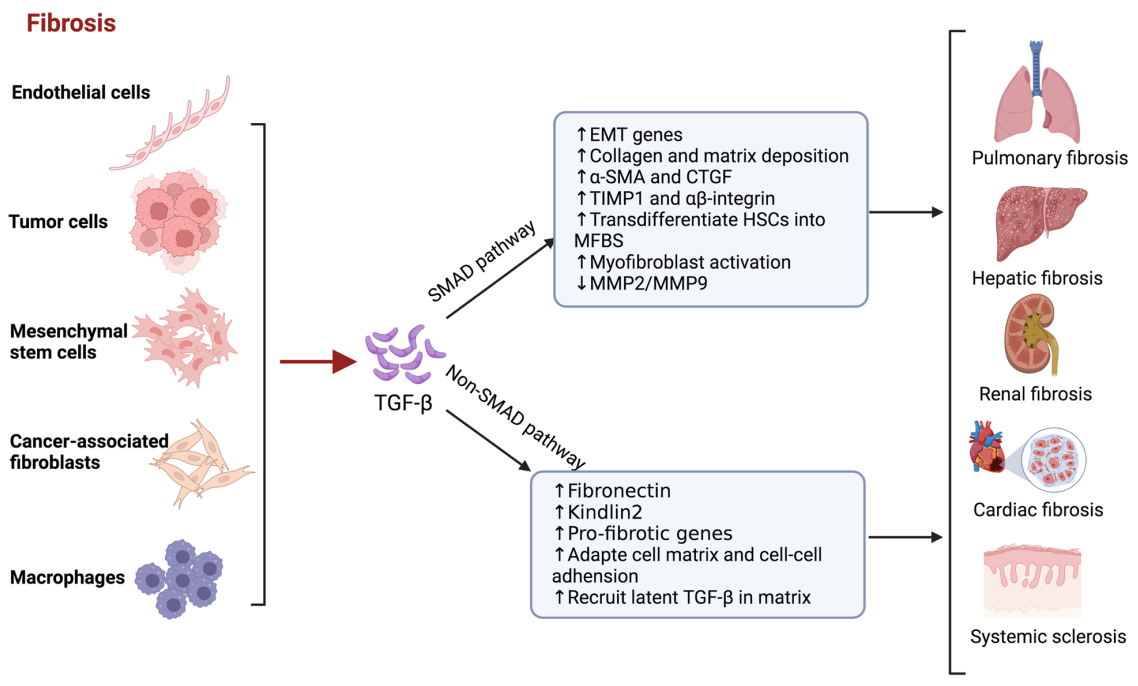
(数据来源 Tie Y, et al. Mol Biomed. 2022)
TGFB的靶向治疗
靶向TGFB的治疗方式有很多策略,例如改变TGFβ合成,靶向TGFβmRNA,靶向furin。改变TGFβ激活,靶向潜伏TGFβ复合物,靶向GARP,靶向αV整联蛋白。改变TGFβ信号传导,例如靶向TGFβ受体,靶向SMADs。
SRK-181是一种选择性结合潜伏TGFβ1以抑制其激活的抗体。在小鼠模型中,SRK-181与抗PD-1抗体联合使用可诱导显著的抗肿瘤反应和生存益处,且不会导致类似泛TGFβ抑制剂的心脏瓣膜病变等不良反应。
一项1期研究(NCT02947165)中,另一种称为NIS793的抗TGFβ单克隆抗体单独或与抗PD-1抗体联合治疗晚期实体瘤患者的耐受性良好。研究中所有患者的治疗相关不良事件多为皮肤毒性和胃肠道事件,在剂量递增过程中未观察到剂量限制性毒性。
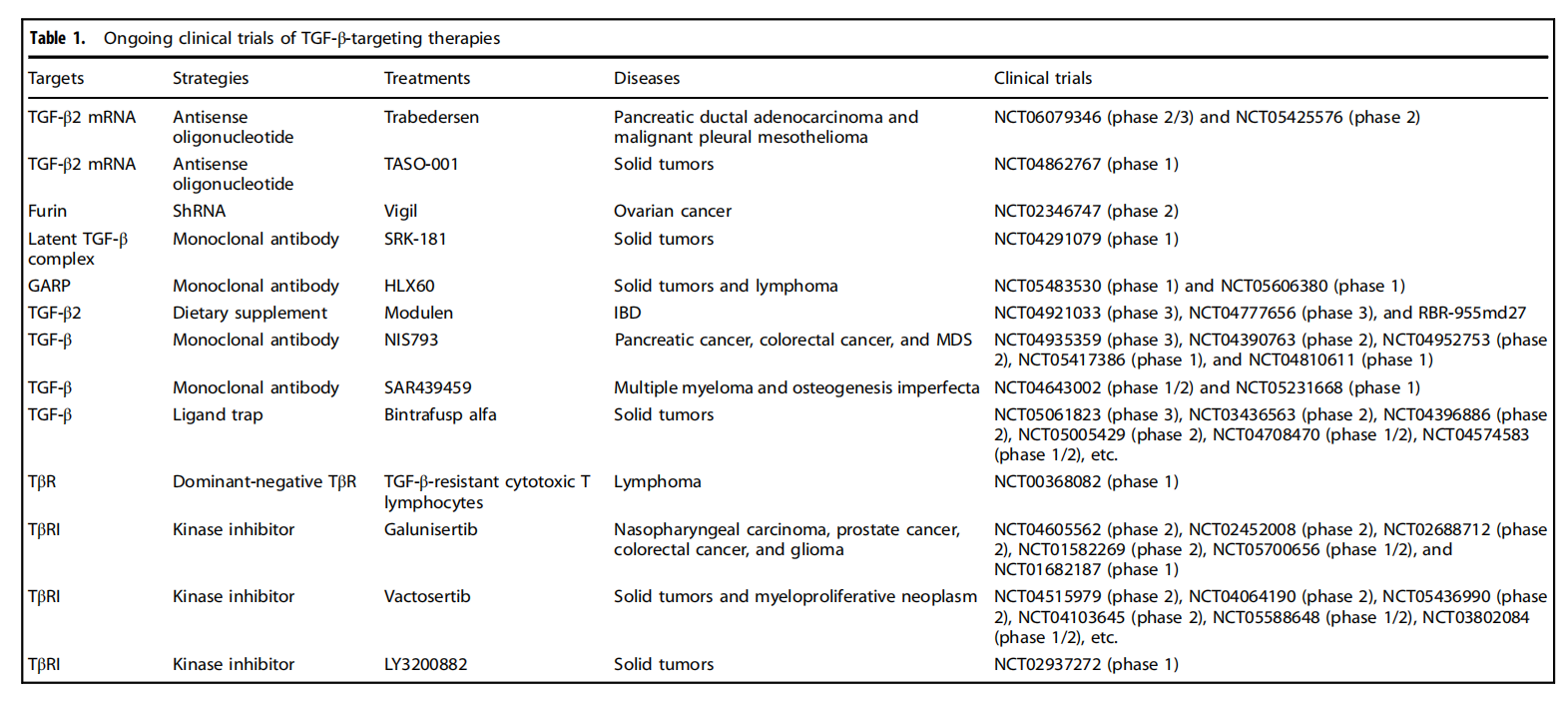
(数据来源 Deng Z, et al. Signal Transduct Target Ther. 2024)
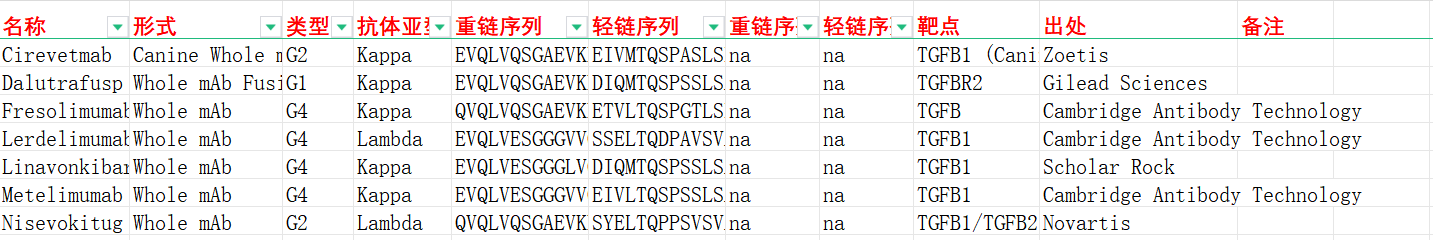
我们收集整理一批TGFB相关抗体序列信息。文档可关注公众号“迈思生物”,号内回复“TGFB”下载。