背景
在临床前模型中测试候选单克隆抗体疗法是药物开发的关键步骤。识别与人类靶点结合并与小鼠同源物发生交叉反应的抗体治疗候选物通常具有挑战性,特别是对于序列同源性低的靶点。在这种情况下,必须使用结合小鼠同源物的替代抗体。与小鼠CTLA-4结合的抗体9D9是小鼠癌症模型中CTLA-4检查点阻断研究的常用替代指标。
2025年1月24日Brett Robison团队在MAbs上发表了一篇名为“Engineered ipilimumab variants that bind human and mouse CTLA-4”的文章,这项工作中,利用噬菌体和酵母展示技术设计与mCTLA-4结合的ipilimumab变体。经过工程改造的变异体与小鼠和人CTLA-4均表现出不依赖于pH值的交叉反应性结合。一种与小鼠和人CTLA-4形成复合体的变异体的晶体结构证实,它与ipilimumab靶向相同的表位。这些交叉反应性伊匹单抗变异体可能有助于提高可翻译性,并有助于未来在小鼠模型中开展抗CTLA-4靶向作用机制研究。

9D9和ipi对各自的CTLA-4靶点具有不同的亲和力和表位
9D9在与mCTLA-4结合时表现出强烈的pH依赖性,随着pH值的降低,其结合力减弱。在溶酶体的较低pH环境和鼠癌模型肿瘤微环境(TME)中,9D9对mCTLA-4的结合能力较差。ipilimumab在pH 6.0到7.4的范围内与hCTLA-4的结合不受pH影响,表现出pH独立性。以3.1 Å分辨率解析的晶体结构显示,9D9靶向位于mCTLA-4膜远端的表位,这个表位主要由mCTLA-4的BC和FG环组成,同时在C'C''环和N端附近的A链内也观察到额外的接触点。ipilimumab结合的表位主要位于hCTLA-4的C、G和F链,与tremelimumab的结合表位相似。这一表位与B7配体的结合位点不同,表明ipilimumab通过阻断CTLA-4与B7配体的结合来发挥作用。

利用噬菌体和酵母展示技术构建结合mCTLA-4的ipi
通过噬菌体和酵母展示系统的两步法构建结合mCTLA-4的ipi。首先构建一个结构引导的ipilimumab单链可变片段(scFv)噬菌体库,通过Sanger测序单个富集克隆,识别出能够增加对mCTLA-4亲和力的突变。这些突变被用于后续的酵母展示优化。
通过构建两个酵母表面展示库(分别针对重链和轻链的互补决定区,CDR),这些库设计为在每个CDR位置包含单个退化NNK密码子,使得每个库成员仅包含一个突变。并进行荧光激活细胞分选(FACS)选择,最终获得了对mCTLA-4具有更高亲和力的变体。
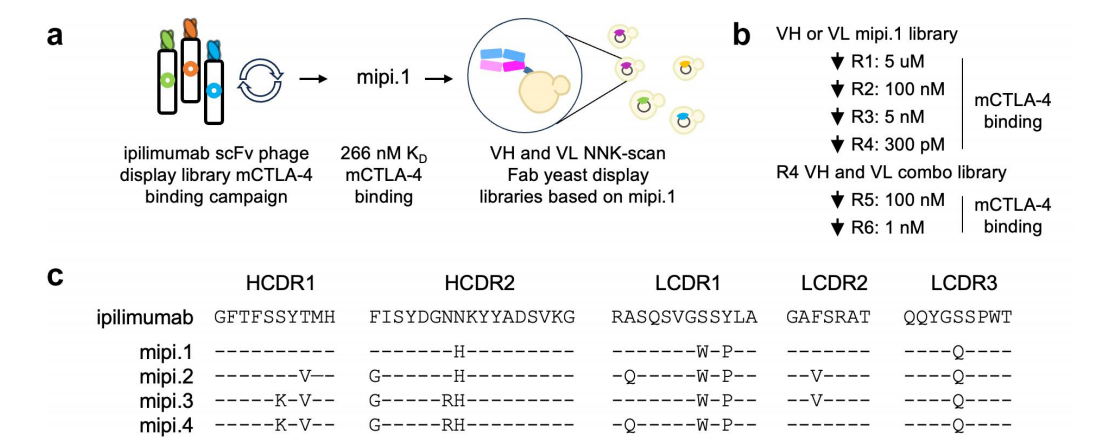

工程化mipi变异体结合表征
工程化mipi变体(特别是mipi.4)成功实现了对hCTLA-4和mCTLA-4的高亲和力结合,且在不同pH条件下均保持稳定的结合能力。

作为二价IgG,与pH 6.0和7.4下的亲本ipi结合相比,mipi变体与hCTLA-4细胞的结合显示出更好的结合。作为Fab,在pH 6.0和7.4下,mipi变体与hCTLA-4细胞的结合亲和力都比ipi高得多。作为IgG,mipi变体以大于或等效的亲和力结合mCTLA-4细胞。表明工程化mipi变体与mCTLA-4紧密结合,同时也改善了与hCTLA-4的结合。
阻断CTLA-4使CD28依赖性共刺激能够反映在更高的荧光素酶表达上。与ipi相比,IgG和Fab格式的mipi变体具有更有效的剂量依赖性刺激,这与它们的结合活性一致。
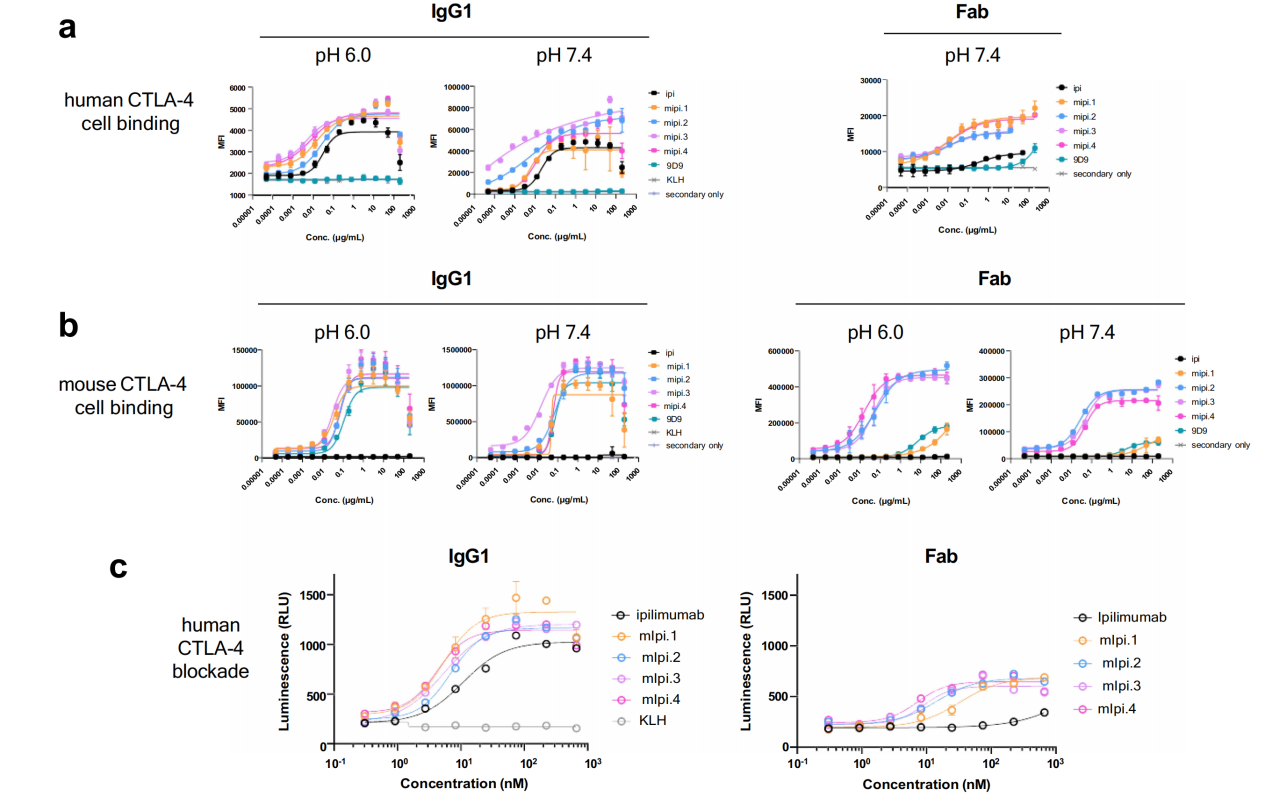
mipi.4–hCTLA-4和mipi.4–mCTLA-4复合物的晶体结构
通过1.64 Å和1.57 Å的分辨率确定了mipi.4 Fab与hCTLA-4和mCTLA-4复合物的晶体结构。这些复合物在hCTLA-4上对齐的结构叠加显示,与亲本抗体ipilimumab相比,mipi.4的Fv区域发生了9°的偏移。尽管存在这种偏移,mipi.4和ipilimumab的Fv结构域显示出高度的结构相似性(Cα RMSD为0.35 Å),并在hCTLA-4上识别出相似的表位。

两种抗体都使用六个CDRs与hCTLA-4结合,重链和轻链分别贡献了Fab埋藏表面积的60%和40%。Mipi.4在hCTLA-4上的埋藏表面积(约836 Ų)比ipilimumab(763 Ų)更大。
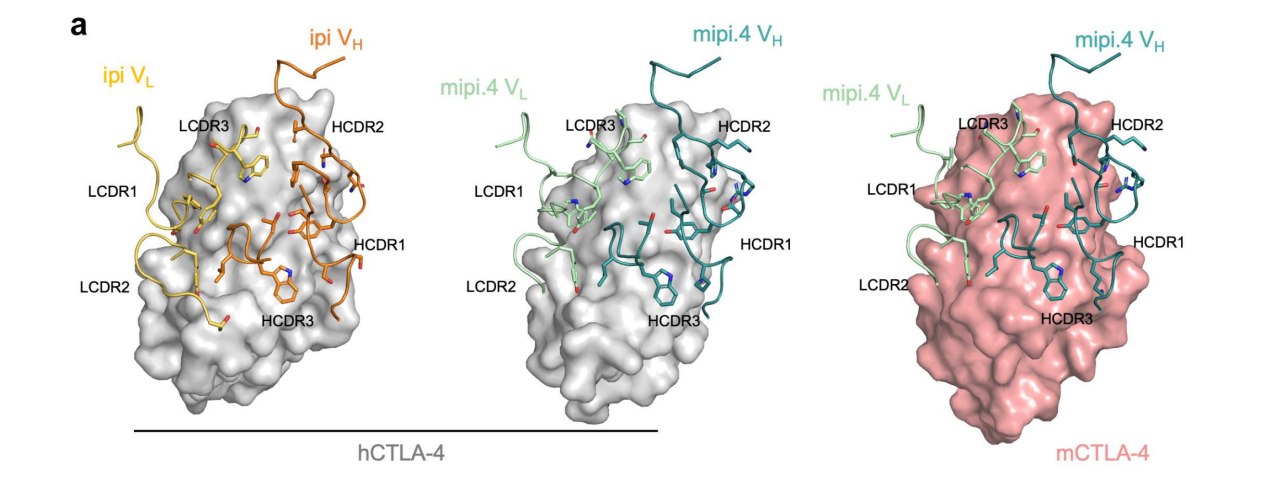
Mipi.4和ipilimumab的CDR环主链以及侧链旋转采用相似的构象。Mipi.4的LCDR1采用与ipilimumab(仅LCDR1对齐Cα RMSD为1.93 Å)不同的构象,可能由S30W和Y32P取代引起。
这些改变将LCDR1接触残基从ipilimumab中的S31和Y32变为mipi.4中的V28、G29和S30W。并将轻链的埋藏表面积从260 Ų增加到337 Ų。
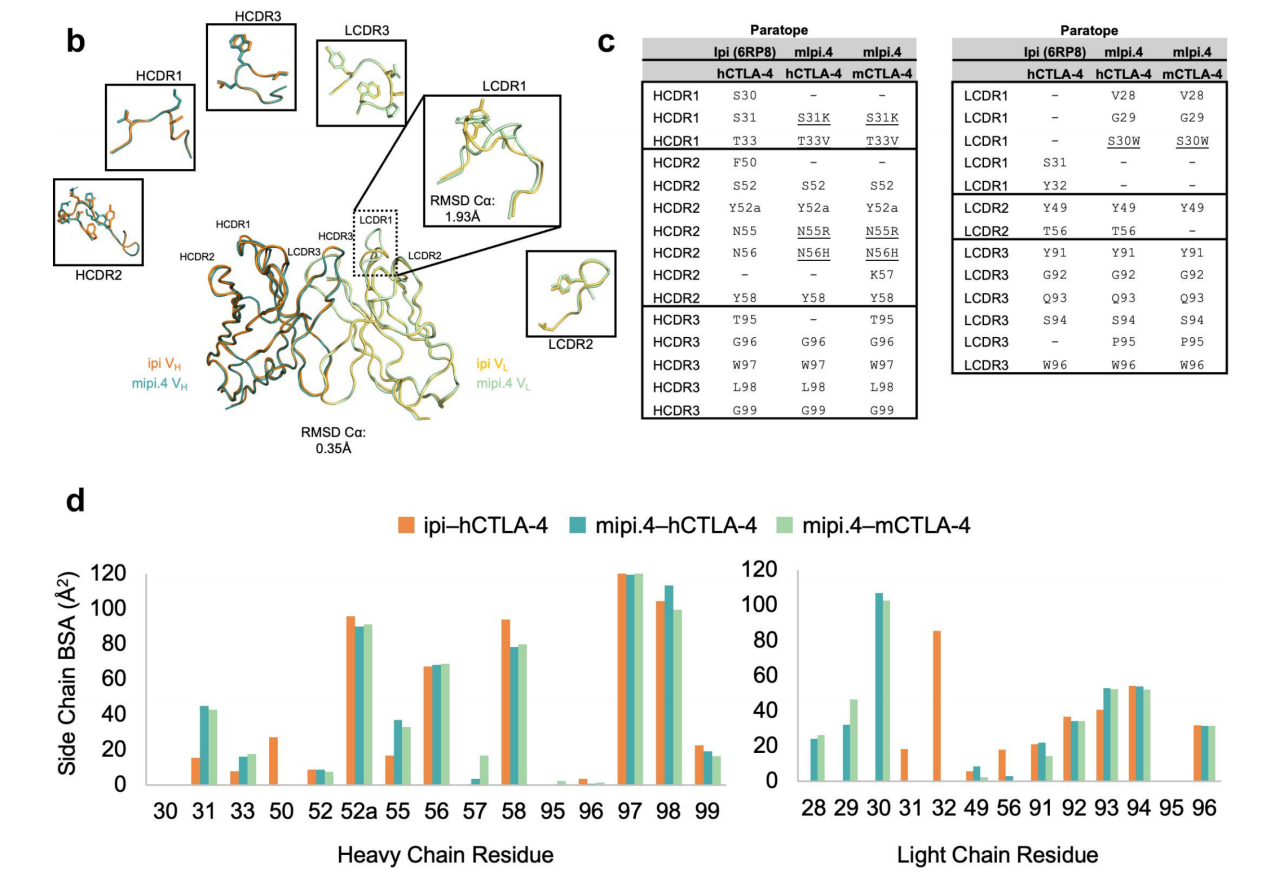
Mipi.4的hCDR1和HCDR2突变在hCTLA-4的结合界面引入新的极性相互作用。Ipilimumab的HCDR2中N56与hCTLA-4的E33之间的氢键被涉及突变残基N55R的盐桥和mipi.4中的N56H的氢键所替代。此外,mipi.4的HCDR1中的S31K取代与hCTLA-4的E48形成盐桥。这些获得的静电相互作用提供了工程化mipi.4变体对mCTLA-4交叉反应性结合的结构理由,同时也增强了其对hCTLA-4的结合。

总结
研究者通过工程化方法成功开发了能够同时结合人类和小鼠CTLA-4的ipilimumab变体,特别是mipi.4变体。mipi.4它在不同pH条件下均保持高亲和力且结合表位与ipilimumab相似,但通过特定突变增强了结合能力。将mipi变体与各种Fc结构域(带或不带FcγR结合)配对,可以帮助揭示在没有Fc效应功能的情况下强力检查点阻断的影响。相信未来mipi变体将成为多功能工具,在研究小鼠癌症模型中针对CTLA-4的治疗策略时,作为现有替代物和转基因模型的补充。
