背景
在过去几十年中,抗体疗法在多种疾病的治疗中越来越普遍,包括癌症,炎症性,自身免疫等疾病。由于抗体疗法中通过皮下注射的方式,一般皮下注射的典型剂量(<2mL),这就需要高抗体浓度(>100mg/mL)来提供所需的抗体量。高抗体浓度可能会带来技术挑战,增加成本并延迟抗体疗法的发展。治疗性抗体的自缔合会导致粘度升高,从而给制造和配方带来问题,并限制皮下注射给药。一些抗体的高浓度粘度已通过可变域突变或添加配方赋形剂来降低。相反,Fc突变对抗体粘度的影响研究甚少。
2024年4月4日,Genentech公司的研究人员在MAbs上发表了一篇名为“Modulation of the high concentration viscosity of IgG1 antibodies using clinically validated Fc mutations”的文章。在这里,研究人员研究了一组常见且经过临床验证的Fc突变对两种密切相关的人源化IgG1,κ抗体,omalizumab(抗IgE)和trastuzumab(抗HER2)粘度的影响。发现某些IgG1抗体的高黏度可通过Fc突变缓解,这提供了一种方法,有助于设计未来可能适用于皮下给药的抗体疗法。

可变结构域,Fc区,IgG1格式对omalizumab和trastuzumab黏度的作用
可变区(尤其是CDR区)在omalizumab单抗的高粘度中发挥重要作用,在等效质量浓度下,omalizumab单抗相应的F(ab’)2的黏度降低了9.1倍,这表明Fc区域对该抗体的高粘度有显著贡献。相比之下,仅Fc片段的粘度非常低。这些结果表面Fab-Fc可能是omalizumab高粘度的重要促成因素。trastuzumab单抗的黏度明显依赖于完整的IgG1格式。
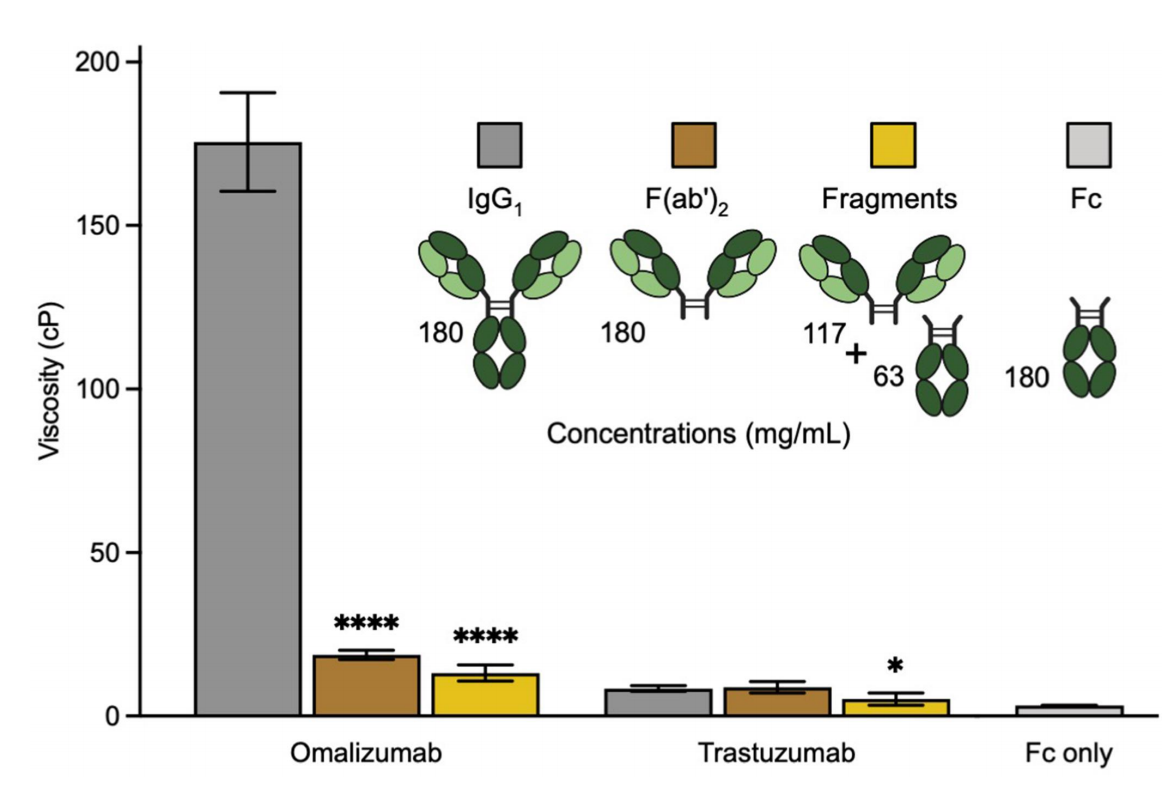
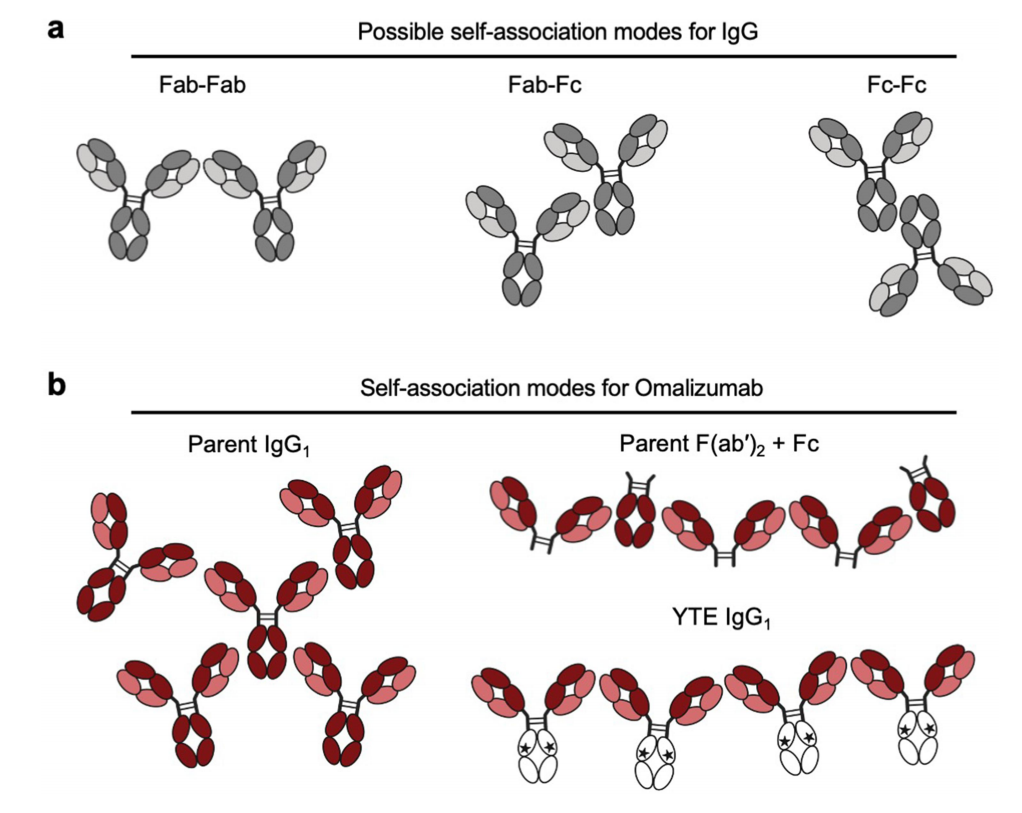
IgG自结合位点可能包括Fab-Fab、Fab-Fc和Fc-Fc相互作用,在自结合的四接触模型中,发现Fab-Fab和Fab-Fc(而非Fc-Fc相互作用)对omalizumab的高粘度做出了重大贡献。
Fc变异对omalizumab和trastuzumab单抗黏度的影响
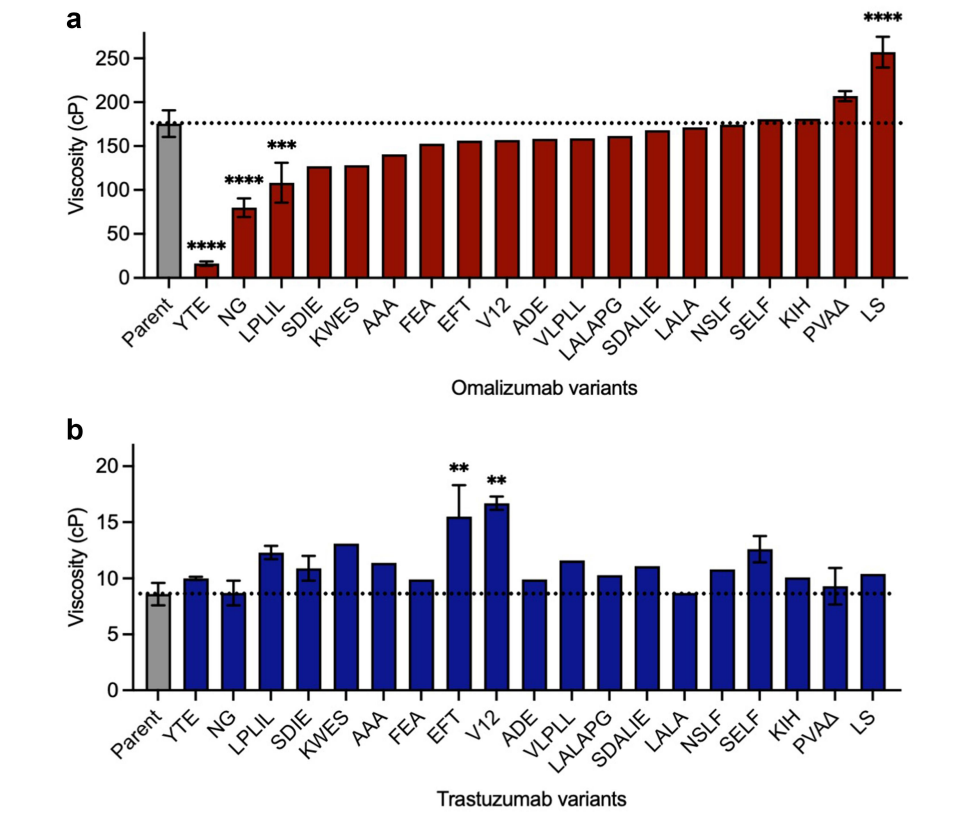
研究了一些常用的Fc变体对omalizumab和trastuzumab高浓度黏度的影响,omalizumab中发现YTE(血清半衰期延长),NG(糖基化),LPLIL(效应功能增强)这3种Fc变异体分别使亲本抗体的黏度降低了10.7倍、2.2倍和1.6倍。
与omalizumab相比,Fc变异均未显著降低trastuzumab本已较低的黏度,相反一些Fc变异体增加了trastuzumab的黏度,表明临床阶段抗体中常用的Fc修饰有时可导致不必要的自结合。
Fc变体突变的空间定位与显著的粘度效应
研究人员发现了识别Fc中与自关联相关的拓扑区域,对于omalizumab,降低黏度的变体NG和LPLIL在上部CH2结构域具有溶剂可及的表面残基,以及在CH2和CH3结构域具有面向糖的残基。omalizumab最显著的降低黏度变异型YTE位于CH2/CH3肘部区域。该区域还包含LS突变的位置,LS突变是唯一发现粘度显著升高的omalizumab单抗Fc变异体。omalizumab中影响粘度的突变的空间取向与trastuzumab明显不同。已鉴定的所有显著增加trastuzumab粘度的变体都涉及替换位于上部CH2结构域的残基。

Omalizumab单抗的高黏度因个体YTE突变而得到缓解
通过评估YTE三重突变中所有可能的单一成分突变(M252Y、S254T和T256E)和双重成分突变(M252Y:S254T、M252Y:T256E和S254T:T256E),进一步研究了从YTE三重突变(176 cP到16.4 cP)中奥马珠单抗的黏度大幅降低。通过单个S254T(降低6.1倍)或T256E(降低5.8倍)突变,可以部分重现YTE三重突变导致的Omalizumab黏度大幅降低(10.7倍)。
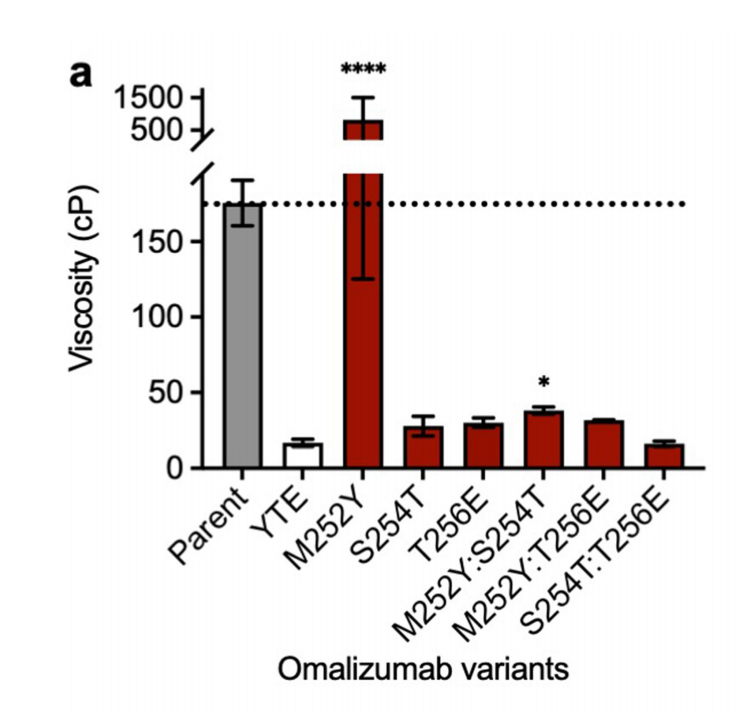
溶液pH、静电和疏水性影响omalizumab的粘度
Omalizumab具有强pH依赖性,它的粘度在pH6.0时达到最大值,而在更酸性或更碱性的条件下粘度降低,这表明组氨酸的离子化状态可能对粘度有贡献。
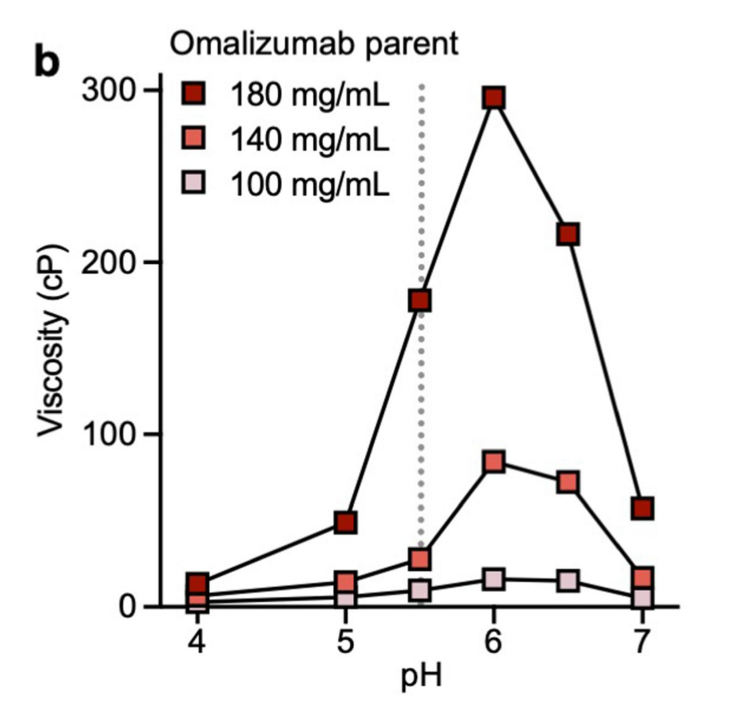
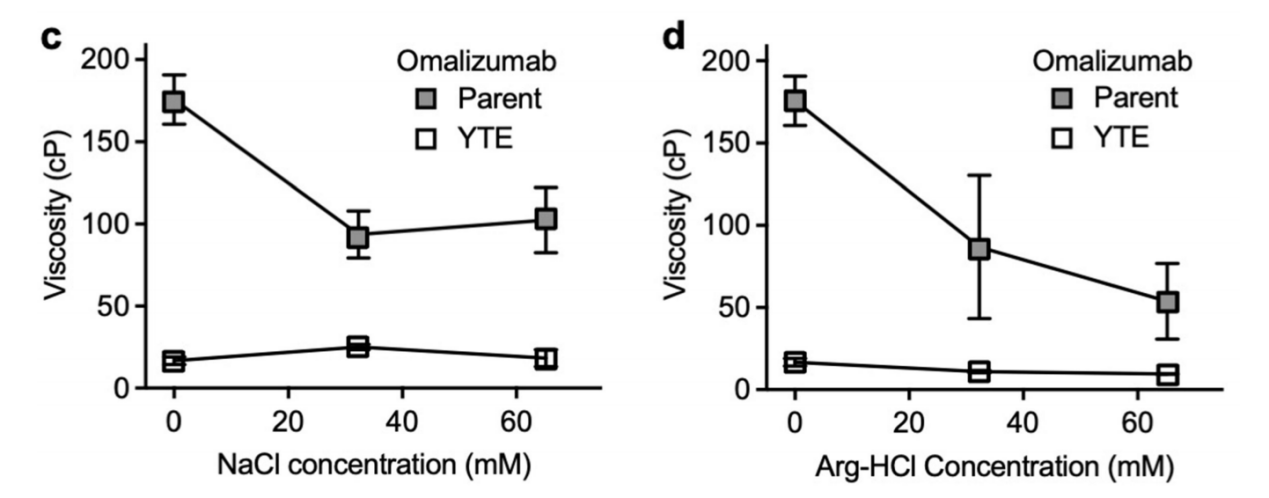
通过添加赋形剂、NaCl和精氨酸-盐酸(Arg-HCl),研究了促进omalizumab高粘度的非共价相互作用类型。Nacl使omalizumab的粘度降低,表明它的静电相互作用被屏蔽。但是添加Nacl后,它的单抗YTE变体粘度增加,这意味着Fab-Fab自结合主要不是由静电驱动。Arg-HCl的加入降低了omalizumab的粘度。说明酸性和芳香族基团是通过Fab-Fc和Fab-Fab自关联增加粘度。
亲本和YTE Fc区的分子动力学分析
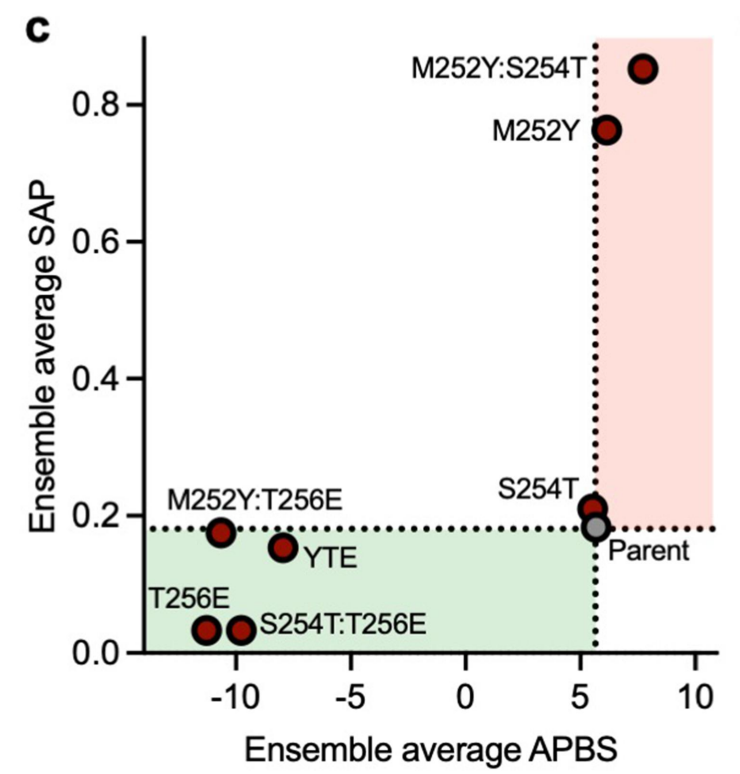
M252Y单突变体显示SAP评分大幅增加,相应的双突变体(M252Y:S254T和M252Y:T256E)和三突变体(YTE)的SAP评分增加较小,这一观察结果与在M252Y中观察到的显著粘度增加一致,表明酪氨酸在增强Fc区域的芳香性或疏水性方面发挥关键作用。点突变周围的静电表面APBS评分受到谷氨酸残基存在与否的显著影响。与亲本和其他变体(在Fc环上保持正静电电位)相比,单(T256E)、双(M252Y:T256E和S254T:T256E)和三(YTE)突变体均在指定环内表现出向负静电电位的转变。
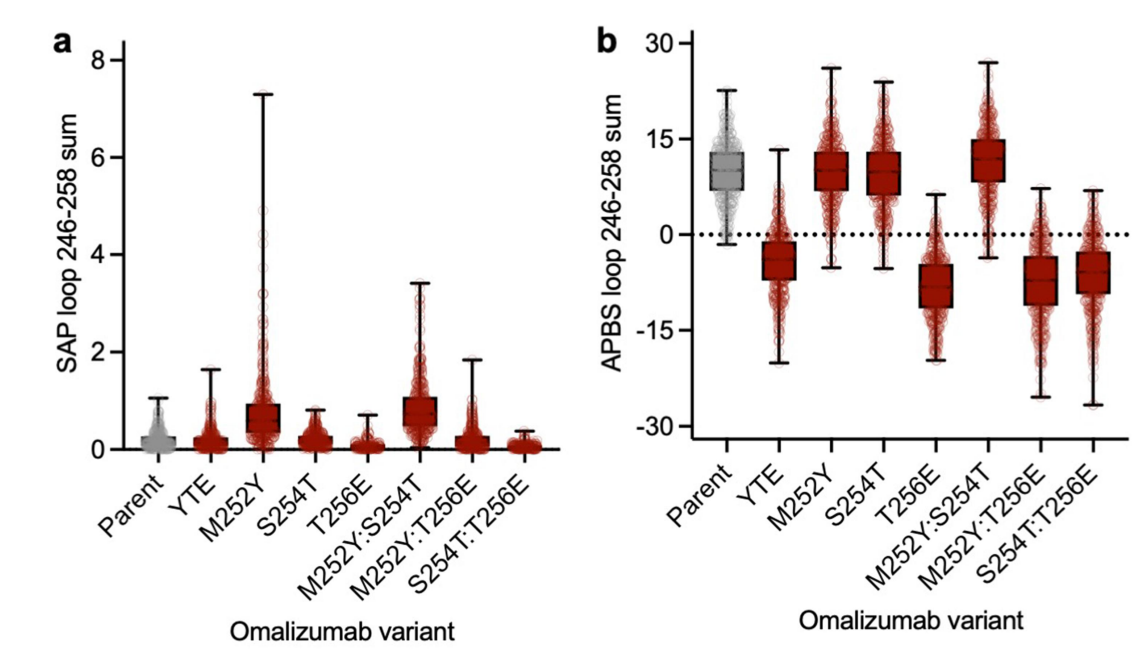
考虑了不同变体中集合平均静电和疏水(SAP)表面特性的变化,所有具有谷氨酸突变的变体都表现出向局部 Fc 区负表面电位的转变,这与观察到的粘度降低一致。
Fc的不稳定可能有助于降低omalizumab的粘度
分析每个变体的Fc区相对于不同MD框架的初始亲本晶体结构的均方根偏差(RMSD),了解Fc点突变如何影响Fc区的结构和构象稳定性。发现亲本Fc相对于晶体结构的环RMSD最低,YTE三重突变体表现出最显著的构象变化和不稳定性,其次是M252Y:T256E双突变体。其他突变体,无论是谷氨酸还是酪氨酸取代,也显示出与亲本Fc相比在相应环内更高的RMSD不稳定性。S254T变体也显示出与亲本Fc相比增强的不稳定性,尽管它低于其他变体。Fc的不稳定可能会通过增加Fab-Fc相互作用的熵成本来破坏分子间相互作用。
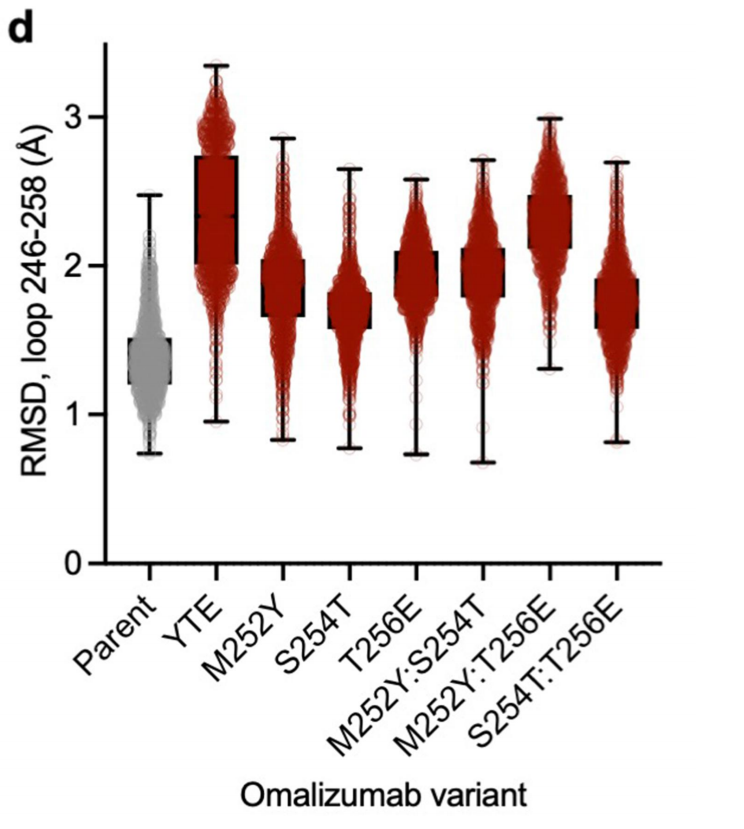
MD分析揭示了YTE突变导致Fc不稳定的潜在机制,YTE突变会破坏Fc区域中的一个稳定的分子内盐桥网络。在野生型Fc中,R255、K246和K248这些带正电荷的氨基酸形成一个稳定的网络,将带负电荷的D249包裹其中。而YTE突变引入的Y252和E256会与这些带正电荷的氨基酸形成新的分子内相互作用,打破了这个稳定的网络结构。YTE突变导致Fc区域出现多种有利的构象,表现出较大的构象不稳定性。与野生型Fc相比,YTE 变体在MD模拟中显示出更大的均方根偏差(RMSD)。这种构象不稳定性可能会影响Fab-Fc之间的相互作用,从而降低抗体的高浓度粘度。

