CD33是一种属于唾液酸结合免疫球蛋白样凝集素(Siglecs)的细胞表面蛋白,属于Siglec家族,它是一种跨膜蛋白,在介导细胞-细胞相互作用和免疫调节中发挥重要作用。CD33一般在单核细胞、巨噬细胞、树突状细胞以及成熟的髓系细胞上表达,尤其是在急性髓细胞白血病(AML)的白血病细胞上表达显著,CD33成为了AML治疗的理想靶点。在中枢神经系统中,CD33在微胶质细胞上表达,这与阿尔茨海默病(AD)中Aβ斑块的清除相关,由于CD33在AD中的潜在作用,它可能成为开发新治疗方法的靶点。
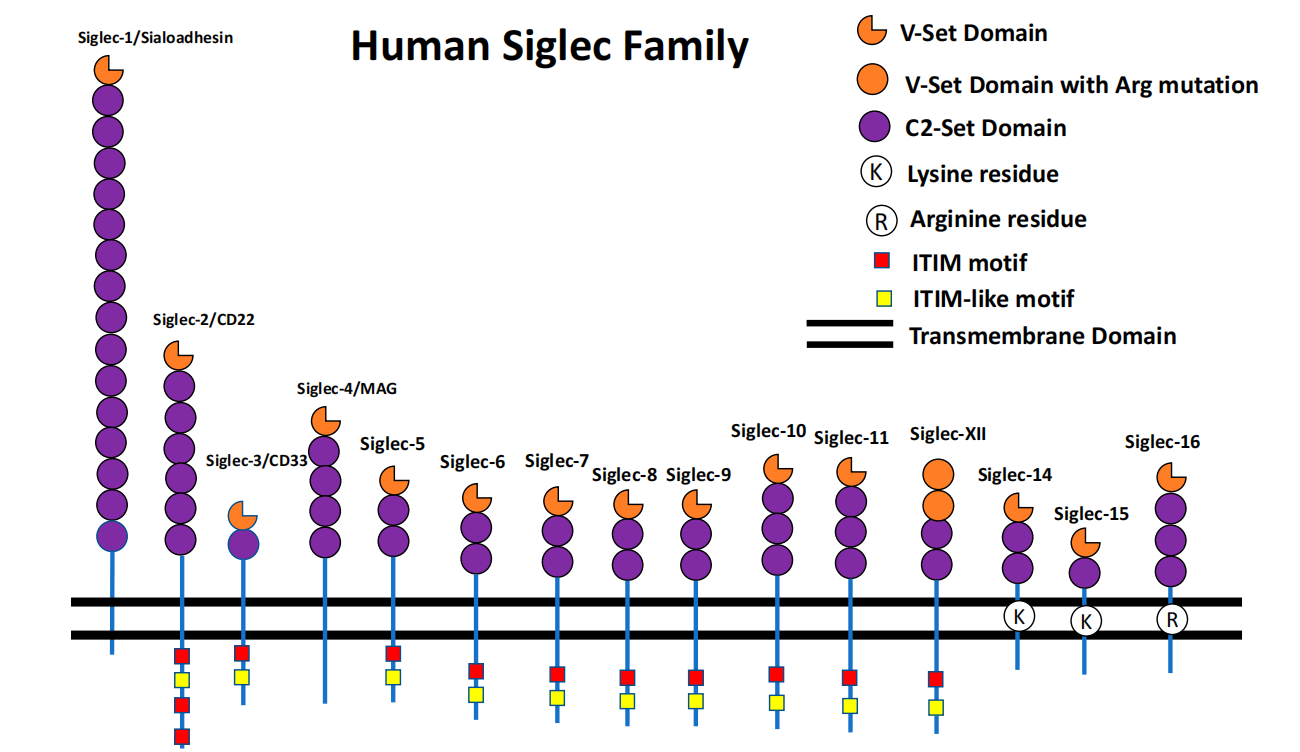
(数据来源 Shoib Sarwar Siddiqui, at al. Cells. 2019)
CD33结构:
CD33是一个分子量约为67KD的糖基化跨膜蛋白,在CD33的N端包括一个细胞外的V型(V-set)免疫球蛋白样域,它主要负责与唾液酸的识别,以及一个或多个C2型免疫球蛋白样域,C2型域在CD33的功能中起到辅助作用,可能参与细胞间的相互作用和信号传导。该跨膜糖蛋白的细胞质尾部包含2个保守的基于酪氨酸的抑制性信号基序(ITIMs),ITIM是细胞内抑制性信号转导的主要结构域,这些基序在CD33介导的信号传导中起着关键作用,通过招募和激活细胞内的酪氨酸磷酸酶和其他信号分子,调节免疫细胞的活性。

(数据来源 Teng Jiang, at al. Mol Neurobiol. 2014)
CD33信号通路和调控:
CD33的功能是基于细胞表面受体-配体的相互作用和细胞类型。由于CD33在免疫细胞上表达,CD33的一个重要作用是其调节免疫细胞功能的能力。免疫细胞中,细胞过程(如吞噬作用、细胞因子释放、细胞凋亡等)由含免疫受体酪氨酸基激活基序(ITAM)的激活受体和含ITIM的抑制性受体共同调控。当与其配体结合时,抑制性受体ITIM内的酪氨酸被磷酸化,并作为包含Src同源(SH)2结构域的蛋白(如SHP磷酸酶)的对接位点。这导致了细胞蛋白的去磷酸化,从而下调了涉及磷酸化的激活信号通路,如那些由ITAMs 诱导的信号通路。CD33是一种抑制性受体。它可以被含唾液酸的糖蛋白和糖脂组成性激活。活化的CD33受体通过其ITIM结构域招募SHP磷酸酶等抑制蛋白,从而抑制吞噬等细胞功能。
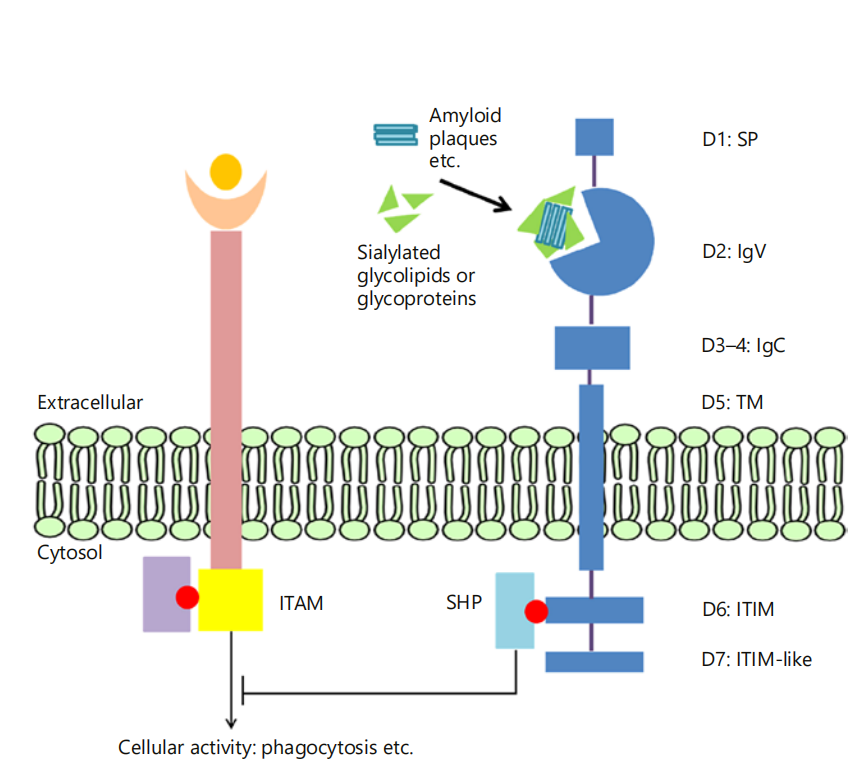
(数据来源 Lingzhi Zhao. Gerontology. 2018)
CD33临床价值:
CD33的临床价值主要体现在其作为治疗靶点的潜力,尤其是在急性髓细胞白血病(AML),阿尔茨海默氏病(AD)治疗中发挥重要作用。
急性髓细胞白血病(AML)的治疗:CD33是AML细胞表面的一个重要标志物,由于其在AML细胞上的高表达和在正常造血干细胞上的低表达或不表达,CD33成为了AML治疗的理想靶点。抗体药物偶联物(ADC)gemtuzumab ozogamicin是针对CD33的疗法,它结合到CD33上并被AML细胞内化,随后释放细胞毒素,导致癌细胞死亡。gemtuzumab ozogamicin是首个也是唯一一个被美国食品药品监督管理局(FDA)批准用于治疗AML的CD33靶向药物。
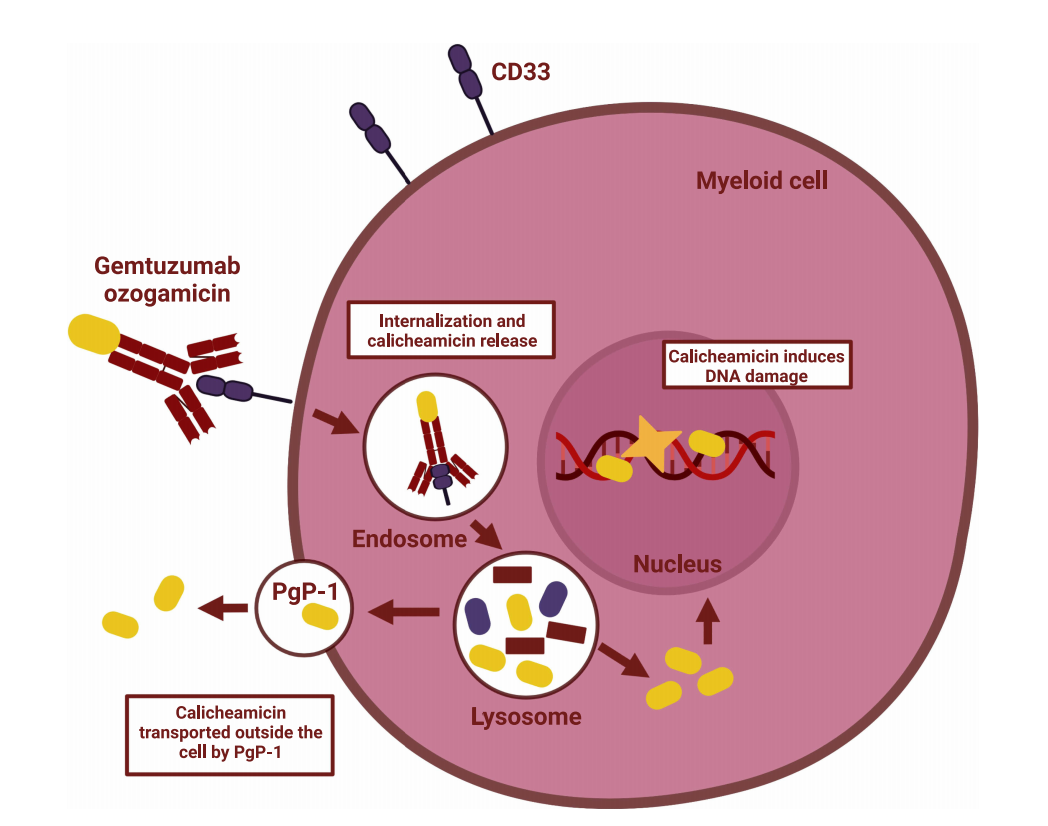
(数据来源Noa E Wijnen, at al. OncoTargets and Therapy .2023)
随着免疫导向疗法发展迅速,如嵌合抗原受体(CAR)-T细胞,这种细胞对包括急性淋巴细胞白血病(ALL)在内的B细胞恶性肿瘤表现出突出的临床活性,CD33靶向CAR-NK疗法通过特异性识别AML细胞上的CD33抗原,激活并增强NK细胞的杀伤能力,从而提供了一种潜在有效的AML治疗方法。
阿尔茨海默病(AD)的治疗:在AD中,CD33与Aβ斑块的清除能力减弱有关。由于CD33在微胶质细胞上的表达与Aβ的清除相关,针对CD33的治疗策略可能有助于改善Aβ的清除,从而减缓AD的进展。
CD33作为治疗靶点的研究推动了新型药物的开发,包括双特异性抗体、放射性免疫偶联物和CAR修饰的免疫效应细胞。这些疗法的临床试验正在进行中,旨在提高治疗效果并减少副作用。总之CD33的临床价值在于其作为治疗靶点的潜力,特别是在AML和其他血液癌症的治疗中。通过针对CD33的疗法,可以设计出更精确的治疗方案,以提高疗效并减少对正常细胞的影响。随着研究的深入,CD33在其他疾病治疗中的应用也可能逐渐显现。
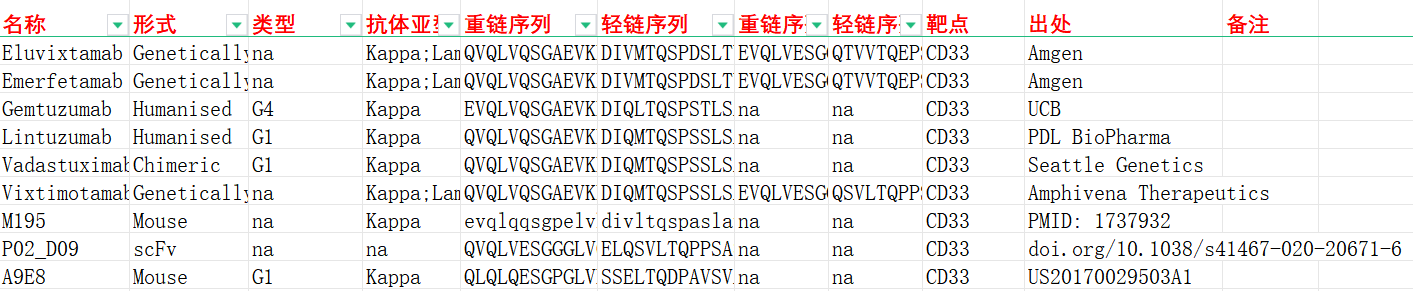
我们收集整理一批CD33相关抗体序列信息。文档可关注公众号,号内回复“CD33”下载。