双特异性抗体(BsAbs)能够识别两个不同的表位或抗原,以不同分子形式,针对不同的靶点并通过不同的分子机制介导抗癌功能,可实现使用传统IgG单抗无法实现的新作用机制和治疗应用。截至2023年底,14个双特异性抗体已被批准:11用于癌症治疗,3用于非肿瘤适应症。包括在过去的3年(2021-2023年)里,有9种双特异性抗体被批准用于癌症治疗。
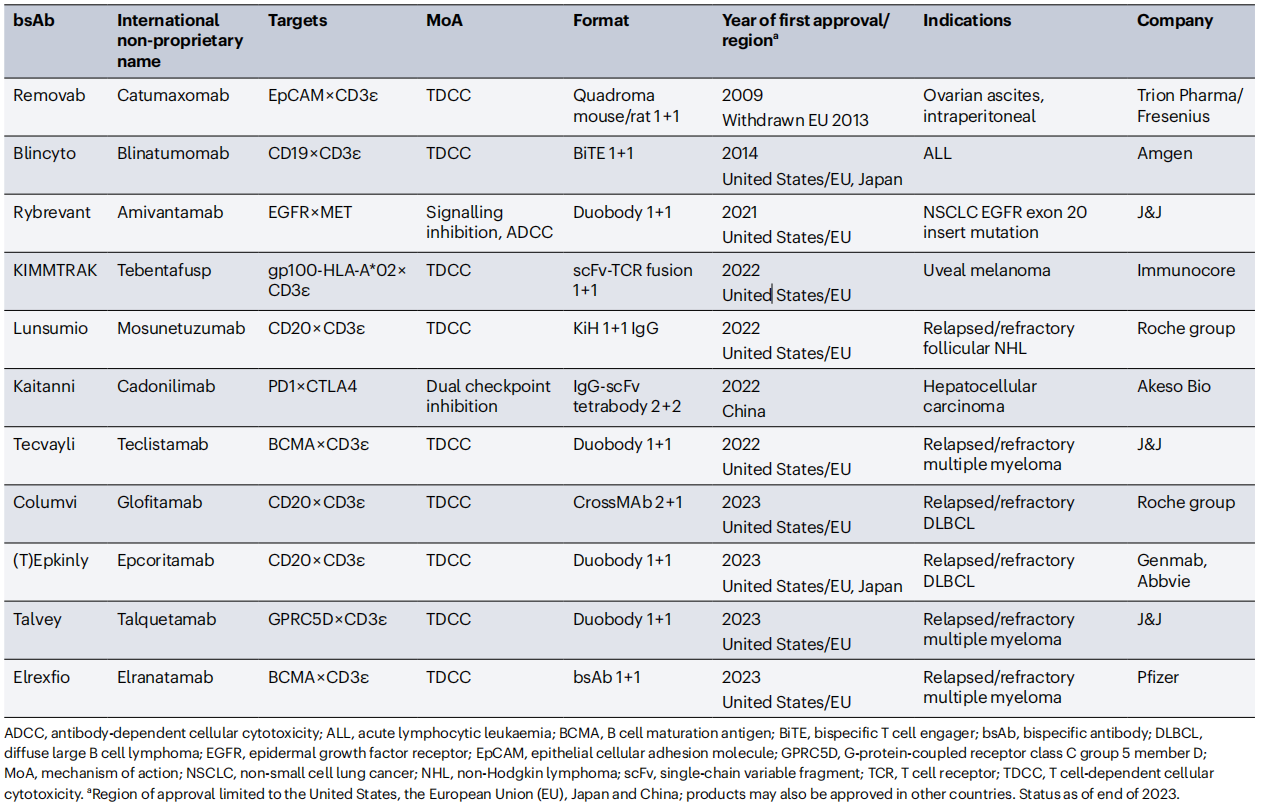
(数据来源 Klein C, et al. Nat Rev Drug Discov. 2024)
现状:
目前正在临床开发中的200多种双特异性抗体,大约四分之三的双特异性抗体正在被研发用于治疗实体瘤,其中T细胞激活剂(TCE,占比32.9%)以及具有免疫检查点抑制和/或免疫调节机制作用机制的双特异性抗体(CPI,占比45.1%)占据主导地位,针对血液系统恶性肿瘤的BsAbs则主要由T细胞激活剂(占75%)和其他针对免疫活性的作用机制(先天免疫细胞定向剂ICE-10.9%,免疫检查点抑制剂CPI-6.3%,自然杀伤细胞定向剂NKCE-4.7%)构成,这些作用机制通常通过利用高度肿瘤选择性或谱系特异性抗原来实现对自然杀伤细胞及其他免疫细胞的免疫检查点抑制和/或免疫调节作用。
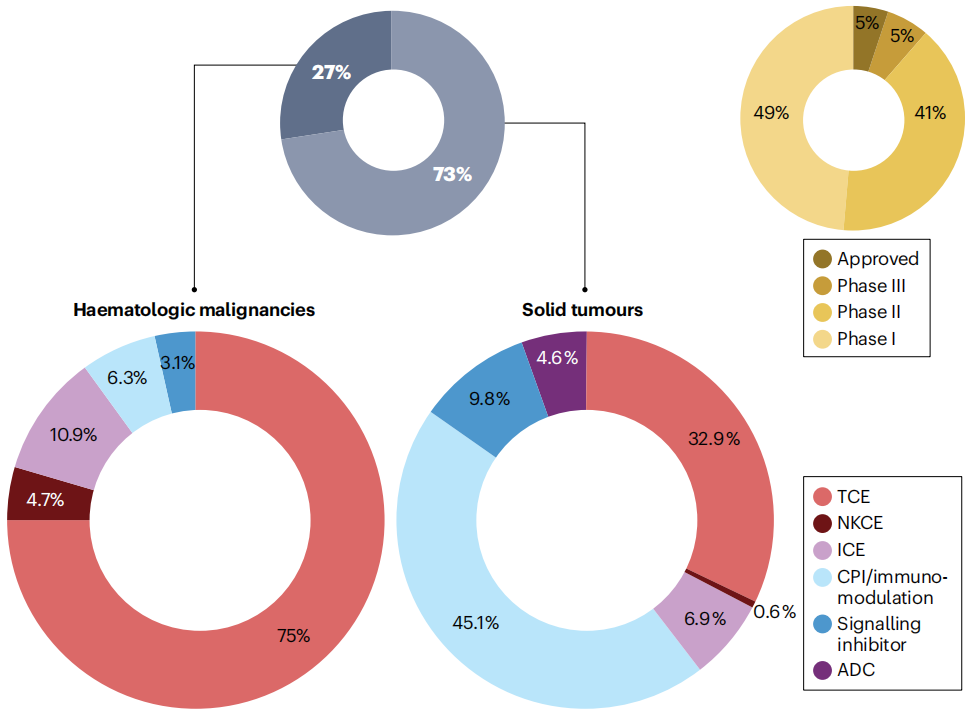
(数据来源 Klein C, et al. Nat Rev Drug Discov. 2024)
分子设计类别:
围绕双特异性抗体的分子设计目前也是百花齐放,众多形式多样的分子被构建试验,通常可将双特异性抗体分为的两大类:IgG样抗体类型(包含Fc单元)和非IgG样抗体(不含Fc单元)形式。这种分类机制的目的很好地强调了Fc结构域的存在,它不仅促进了上述功能,而且有助于双特异性抗体的溶解度、稳定性和纯化,此外,可以对该区域进行基因改造,以消除抗体依赖性细胞介导的细胞毒性(ADCC)或补体依赖性细胞毒性(CDC),同时保留较长半衰期的潜力。没有Fc单元的非IgG样双特异性抗体的可以使用Fab片段或通过连接两个抗体的可变轻重结构域来完成,这些抗体可大致分为基于scFv(单链可变片段)、纳米抗体、对接锁定(DNL)方法构建抗体以及其他双特异性/多特异性分子。

(数据来源 Wei J, et al. Front Immunol. 2022)
作用机制类别:
由于癌症的异质性和适应性,双特异性抗体中的任何一种设计都不太可能成为一种普遍的癌症免疫治疗方案。相反,针对不同靶点、肿瘤类型,及效应细胞,双特异性抗体设计需要为不同作用机制程序量身定制,以最大限度地提高其有效性和安全性窗口。

(数据来源 Klein C, et al. Nat Rev Drug Discov. 2024)
目前双特异性抗体作用机制根据重定向免疫效应细胞类型,及针对肿瘤微环境中非免疫细胞限制肿瘤扩散,并重新激活抗肿瘤免疫力可分为:①靶向免疫检查点的双特异性抗体和免疫细胞修复的共刺激剂(a-d);②双特异性抗体招募自然杀伤 (NK) 细胞进行肿瘤重定向(e-f);③双特异性抗体招募适应性效应T细胞以实现肿瘤重定向(g-n);④双特异性抗体改变TGF-β信号通路改善肿瘤微环境(o);
新兴探索:
双特异性抗体领域仍在进一步探索和扩展技术和应用:a、T细胞接合器(TCEs)通过CD3结合同时激活T细胞受体(TCR),并通过与CD28结合共同刺激;b、双特异性抗体前药的作用方式;c、蛋白水解靶向嵌合体(PROTAC)通过结合表面抗原(肿瘤相关抗原(TAA))和降解片段(如膜E3连接酶)来实现,从而导致细胞表面靶点的内化和蛋白酶体降解;d、双特异性抗体的递送,通过基因疗法,进入CAR-T细胞;e、双特异性抗体融合细胞因子模拟细胞因子的作用,触发细胞因子受体通路。
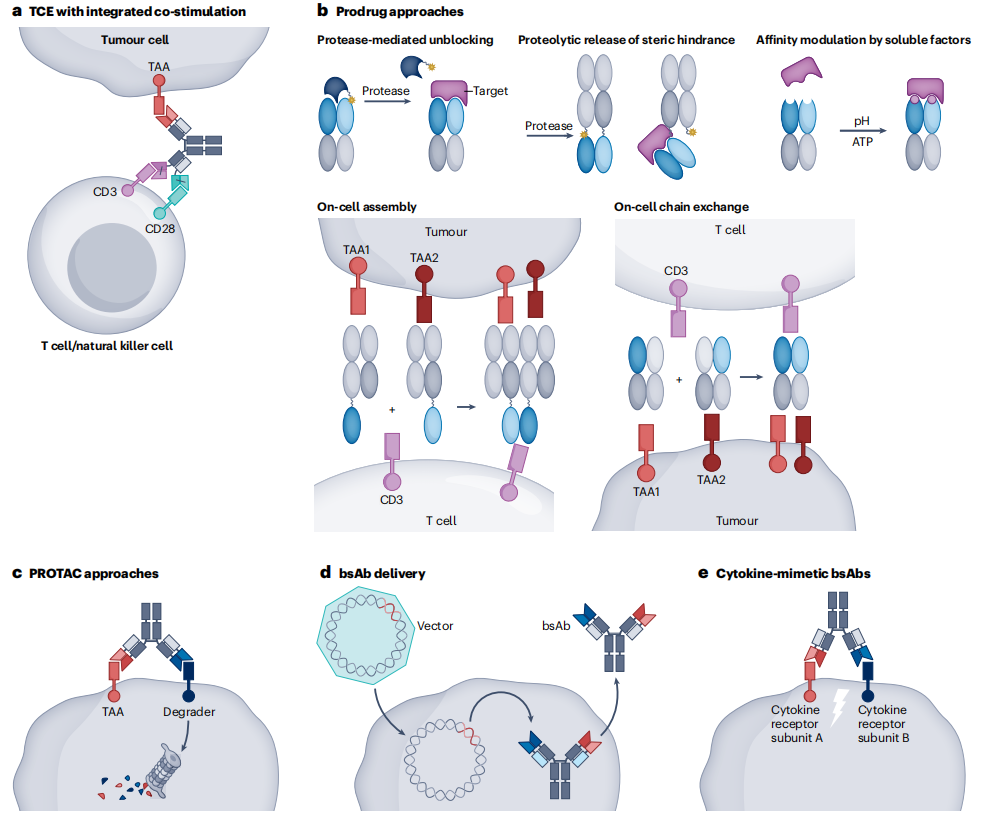
(数据来源 Klein C, et al. Nat Rev Drug Discov. 2024)
展望:
双特异性抗体的开发在维度上比单克隆抗体的开发更加困难。选择最佳靶点组合只是第一步,接下来是根据靶点和疾病生物学正确选择合理的形式并设计分子。此外,不适当的临床设计和给药方案将使患者面临明显更高的毒性,这是可以通过对治疗策略、剂量、时机、顺序进行一定程度的优化来避免的。我们相信双特异性免疫调节抗体领域更全面的探索将拓宽癌症免疫治疗的前景。
