背景
免疫细胞因子利用靶向抗体将细胞因子集中在肿瘤部位,已显示出潜在优势,如延长细胞因子半衰期、减轻不良反应以及抗体和细胞因子成分的协同抗肿瘤疗效。

2024年8月2日,Acta pharmaceutica Sinica. B上发表了一篇名为“Advancements and challenges in immunocytokines: A new arsenal against cancer”的文章,该综述重点介绍了细胞因子的分子结构设计,并探索了可促进下一代免疫细胞因子开发的潜在策略,如细胞因子工程和前药设计。强调了持续努力的方向和重点,即在最大限度提高疗效的同时改善安全性。
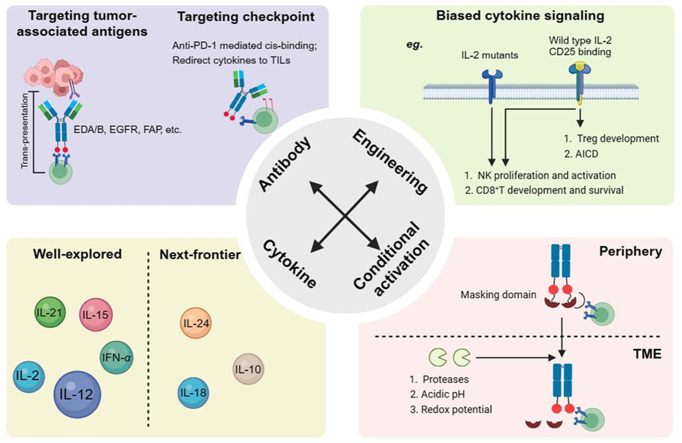
免疫细胞因子概述
细胞因子在免疫调节中发挥至关重要的作用,调控肿瘤微环境,表现出强大的抗肿瘤效果。长期以来,细胞因子的临床应用受到半衰期短和脱靶全身毒性的限制,导致“细胞因子汇”效应。2024年,N-803(IL-15超激动剂)获得批准,这是第三种上市的细胞因子。但它适用于非肌层浸润性膀胱癌(NMIBC)联合卡介苗膀胱内灌注治疗,而非全身给药(NCT03022825)。
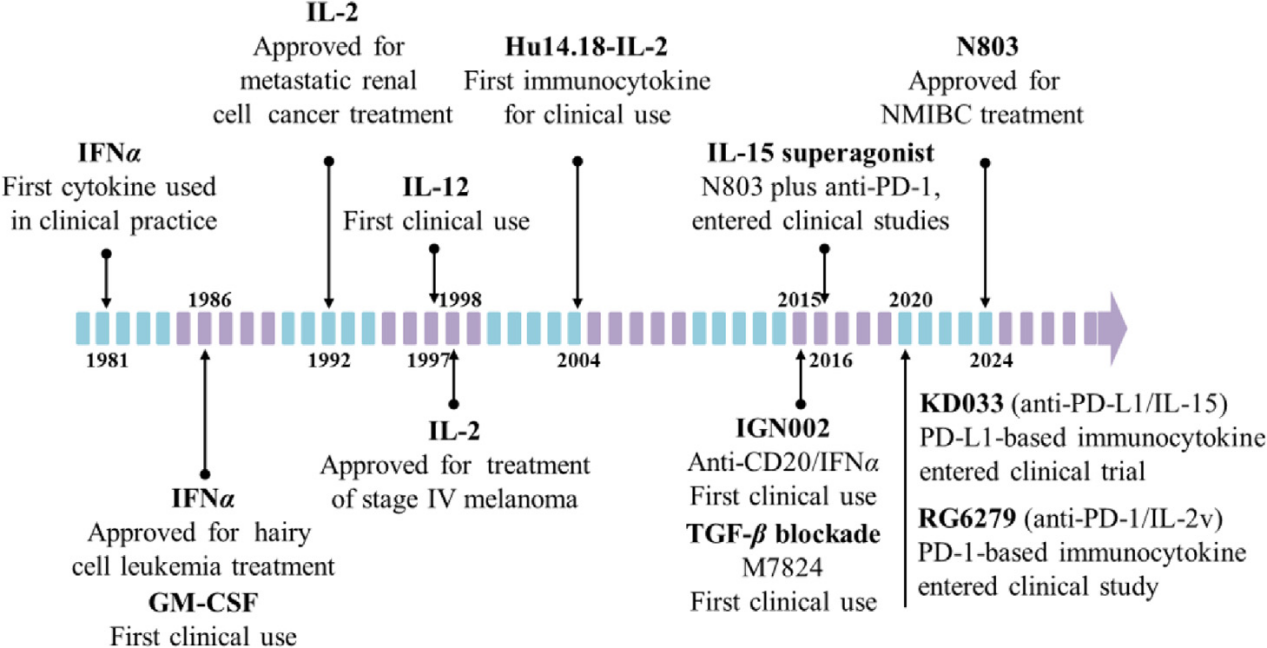
免疫细胞因子(抗体-细胞因子融合蛋白)是指利用抗体选择性地将细胞因子递送到肿瘤部位,从而延长其半衰期并降低毒性。目前有许多免疫细胞因子已经进入临床阶段。例如,由IL-15和PD-L1融合成的KD033,在I期临床试验中显示出良好的耐受性,这一趋势反映了免疫细胞因子研究朝着靶向特定免疫检查点(如PD-1/PD-L1)的方向不断发展的格局。
常见免疫细胞因子
IL-2
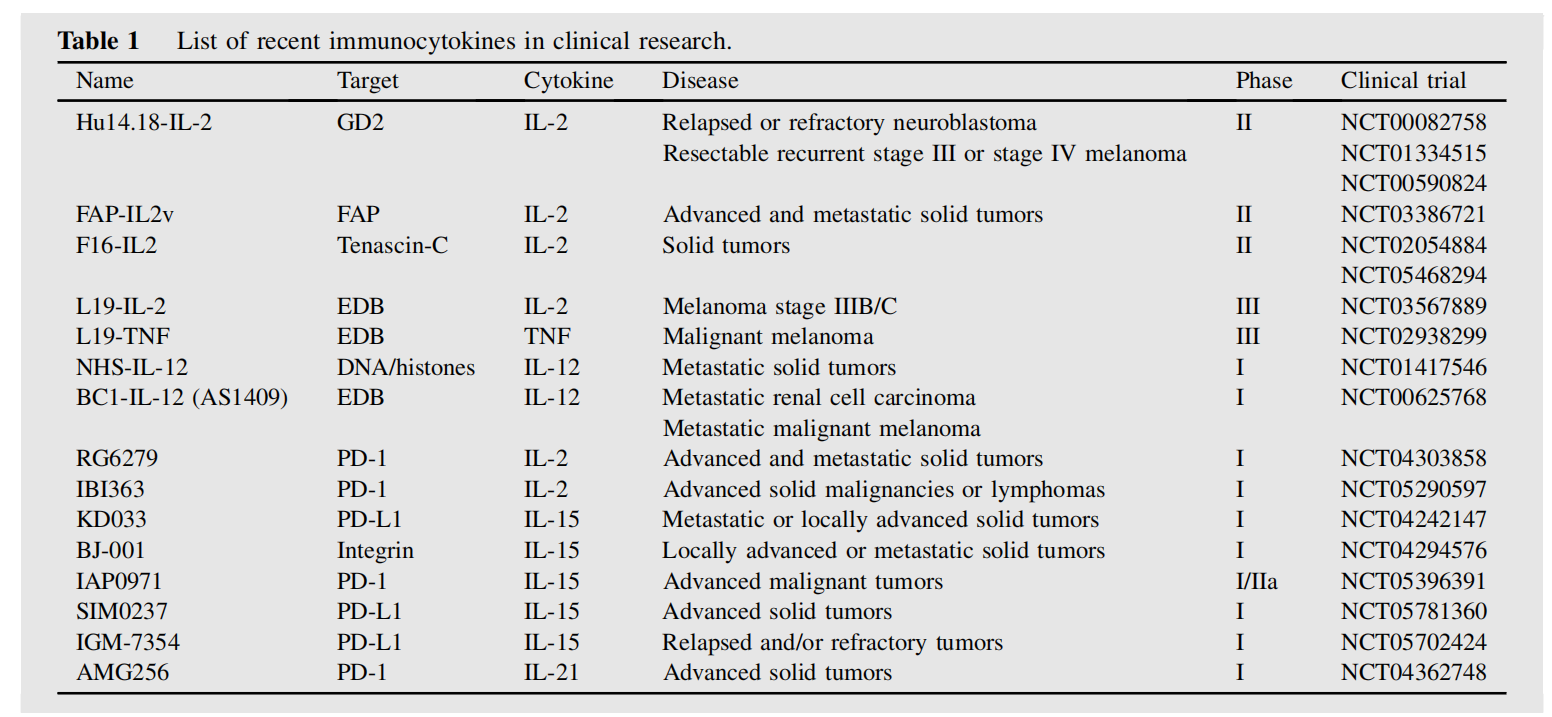
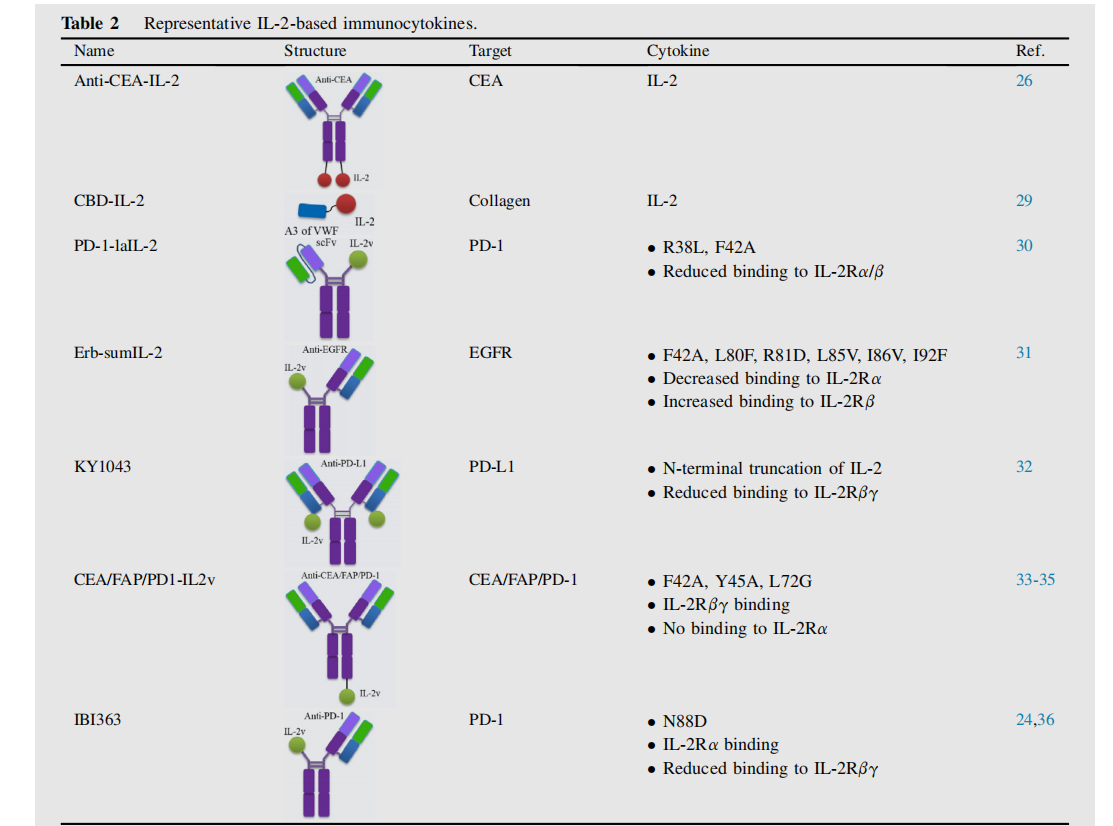
IL-2已被用于产生各种针对纤维连接蛋白可变剪接的额外结构域A(EDA)或额外结构域B(EDB)、癌胚抗原(CEA)、成纤维细胞活化蛋白(FAP)、PD-1和其他的免疫细胞因子。目前有多种IL-2的免疫细胞因子再临床前和临床开发中。
二聚体免疫细胞因子anti-CEA-IL-2,融合CBD的IL-2(CBD-IL-2),他们的抗肿瘤作用依赖于肿瘤内的CD8+T细胞;与PD-1融合的一款新低亲和力的IL2的免疫细胞因子PD-1-laIL-2;由超突变IL2(sumlL-2)组成的具有不对称结构的Erb-sumIL2和Her2- sumIL2,以及PD-L1和IL-2突变体融合而成的KY1043;他们都显示出更强的抗肿瘤作用,他们的抗肿瘤效果依赖于CD8+T细胞。
罗氏公司开发了一种基于工程IL-2变异体(IL-2v)的新型免疫细胞因子,该变异体保留了对IL-2Rβγ的亲和力,同时取消了与IL-2Rα的结合。例如CEA-IL2v和FAP-IL2v,它们与野生型相比表现出更强的肿瘤靶向能力和更好的药代动力学。
Innovent开发了一种抗PD-1/IL-2融合蛋白(IBI363),该蛋白可阻断PD-1检查点,并顺式激活α亚基偏向的IL-2,以恢复耗尽的TSTs。研究表明与IL-2Rβγ偏倚的激动剂相比,IL-2Rα偏倚的激动剂显著增强了肿瘤特异性CD8+T细胞,显示出更好的抗肿瘤疗效。此外,偏向IL-2Rα的激动剂表现出更强的外周调节性T细胞刺激作用,因此比偏向IL-2Rβγ的激动剂具有更好的安全性。
IL-15
IL-15在NK细胞和CD8+T细胞的发育,存活和激活中发挥着至关重要的作用,并有助于记忆性CD8+T细胞的稳态增殖,促进对肿瘤的持久免疫力。IL-15已与各种靶向抗体或蛋白质融合,包括转化生长因子β受体外域(TGF-βRII-ECD)、抗PD-1和抗PD-L1。
N-809是一种双功能融合蛋白,包含IL-15/IL-15Rα超级激动剂复合物,其中含有IgG1的Fc结构域与两个单链抗PD-L1结构域融合。从机制上讲,N-809的抗肿瘤效果是通过NK细胞和CD8+T细胞的介导。
LH01显示出比抗PD-L1与非靶向IL-15超激动剂组合更好的抗肿瘤疗效和安全性,并克服了对抗PD-L1治疗的耐药性。
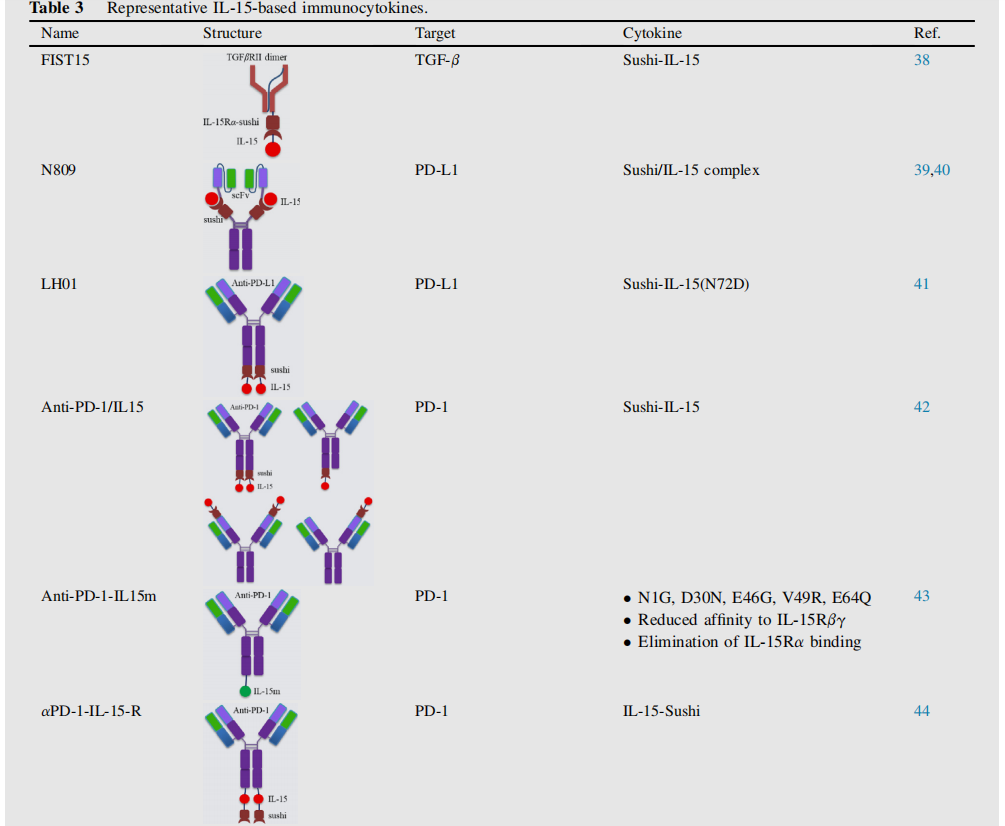
HCW9218利用可溶性组织因子为基础的支架技术,结合TGF-βRII-ECD和IL-15Rα-sushi结构域/IL-15复合体,并通过促进NK细胞和CD8+T细胞浸润肿瘤显示出强大的抗肿瘤活性。
KD033由全人源抗PD-L1与IL-15Rα-寿司结构域/IL-15复合物连接而成,KD033激活了肿瘤内适应性和先天性免疫细胞,其抗肿瘤疗效主要依赖于CD8+T细胞而非NK细胞。此外,当与抗PD-1联合使用时,KD033表现出协同抗肿瘤活性。在一项I期临床试验中,KD033耐受性良好,不良事件可预期且可控。
SOT201和IAP0971的机制依赖于CD8+T细胞和NK细胞,IAP0971的安全性、耐受性和初步疗效目前正在一项针对晚期恶性肿瘤患者的I/IIa期临床试验(NCT05396391)中评估。
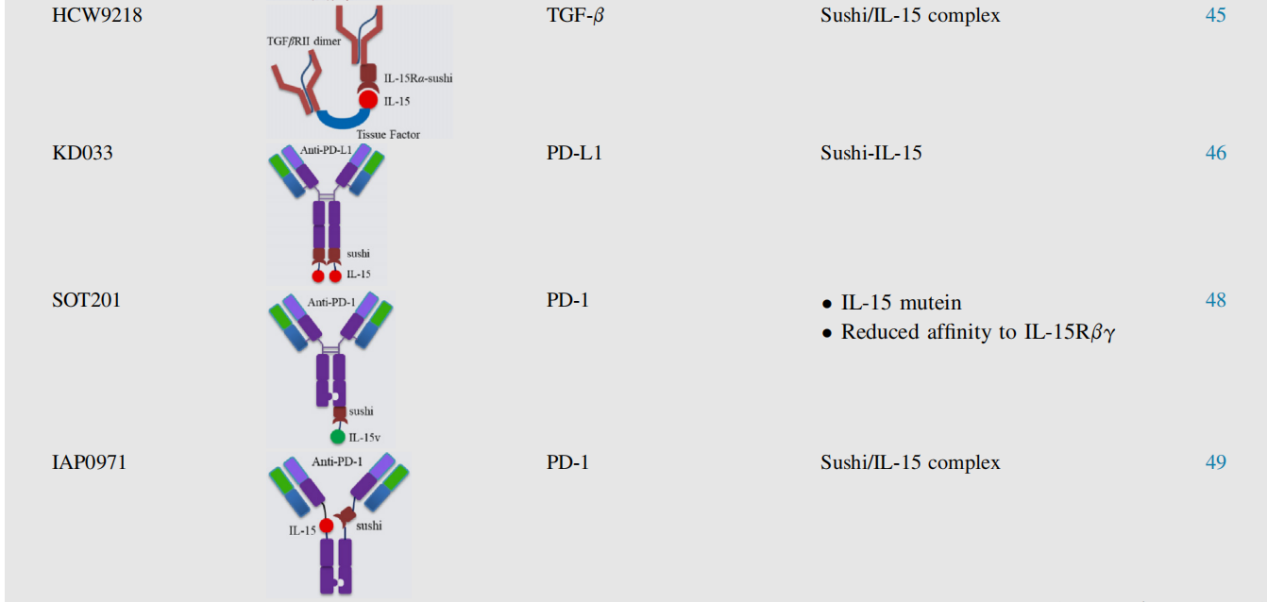
研究发现,NK细胞能够在最低限度启动的情况下溶解肿瘤,并且不受MHC限制。IL-15与三特异性杀伤细胞连接器(TriKEs)整合会显示出更强的NK细胞增殖和活化能力。
Miller团队利用改良的IL-15交联剂构建了含有抗NK细胞CD16和肿瘤细胞CD33单链抗体的TriKE(GTB-3550),该抗体能有效地修复缺陷的NK细胞功能并诱导特异性NK细胞增殖。一项1期研究证明了GTB-3550 TriKE在急性髓系白血病(AML)和骨髓增生异常综合征患者中的安全性、内源性NK细胞的稳健扩增以及活性的临床信号(NCT03214666)。
IL-12
IL-12在促进Th1细胞的分化和增殖、重新激活和促进CD4+T细胞的存活以及增强CD8+T细胞和NK细胞的细胞毒性方面发挥着至关重要的作用。然而,IL-12的临床应用面临着剂量限制性毒性,在一项I期临床试验中,rhIL-12的最大耐受剂量仅为500 ng/kg。IL-12与抗体融合构建免疫细胞因子可以改善这一问题。
IL12-F8-F8是一种基于IL-12作为单一多肽与两个F8抗体以单链抗体片段(ScFv)形式连续融合的免疫细胞因子,靶向选择性剪接的纤维连接蛋白EDA。NK细胞主要参与了IL12-F8-F8介导的抗肿瘤效应。
Wittrup团队首创了一种利用肿瘤中丰富的胶原蛋白增强注射细胞因子融合蛋白滞留的方法。与非锚定IL-12相比,肿瘤内给予的胶原锚定IL-12具有较长的滞留时间,并有效地消除了全身暴露毒性。将它与与癌症疫苗、CAR-T细胞疗法或新辅助检查点阻断联合应用可改善抗癌效果,而不会加重毒性。此外,这种局部治疗可启动保护性和全身性CD8+T细胞应答,从而对未注射细胞因子的肿瘤产生治愈性远隔效应。
Hubbell团队开发的CBD-IL-12显示出增强的抗肿瘤活性和降低的全身毒性。CBD-IL-12可以与检查点抑制剂协同作用,并引发抗原特异性免疫反应。
L19-IL-12由IL-12和选择性结合纤维连接蛋白可变剪接的EDB结构域的单链可变片段(scFv)组成。L19-IL-12可以增加CD4+T细胞、CD8+T细胞和NK细胞在小鼠胶质瘤模型中的浸润和激活。Philogen已经开始针对接受免疫检查点阻断治疗后病情进展的晚期实体瘤患者进行的I期临床试验(NCT04471987)。
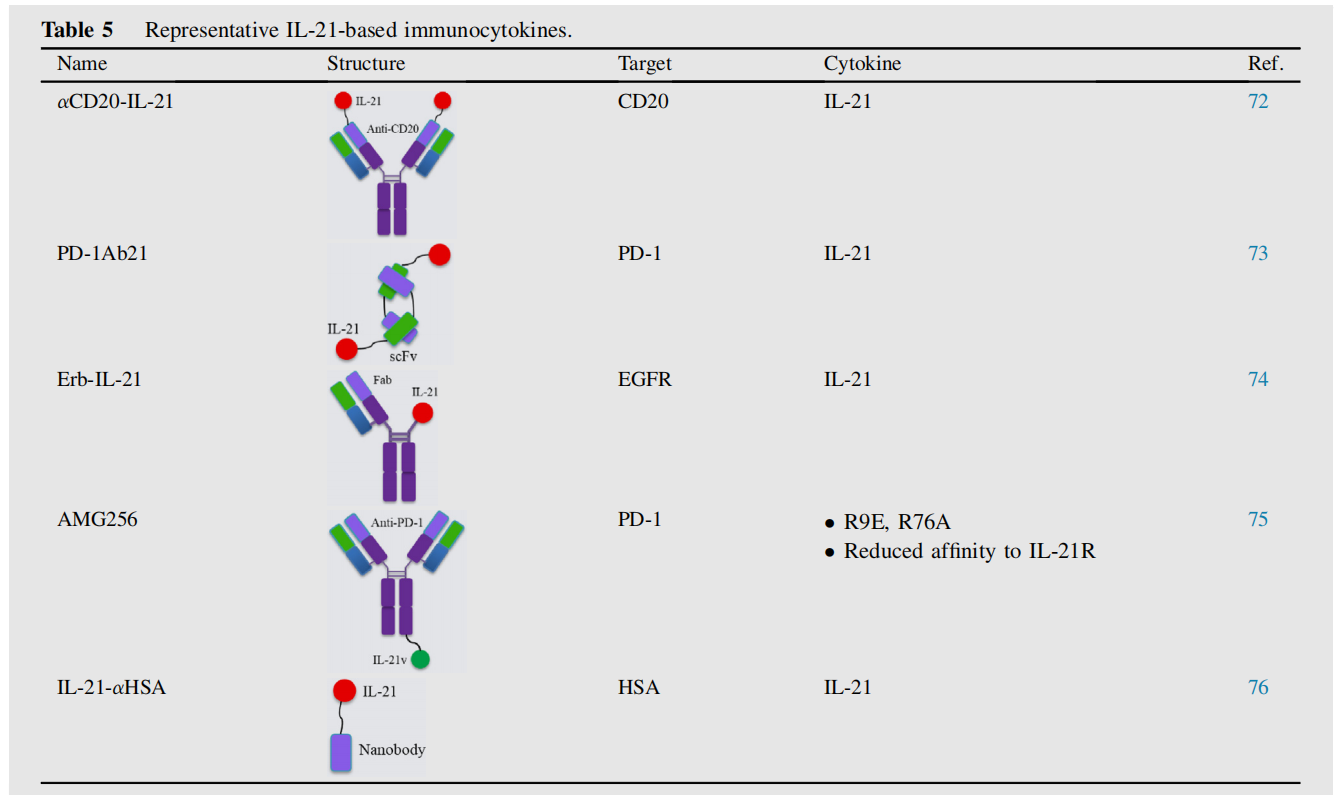
IL21
IL-21在临床试验中通过增强NK细胞和T细胞的效应功能,以及调节B细胞分化和生存,显示出有前景的抗肿瘤活性。
αCD20-IL-21是一种与抗CD20的NH2末端融合的人IL-21融合蛋白,可直接诱导对IL-21抵抗的B细胞淋巴瘤细胞凋亡。它还增强了NK细胞的活化、效应功能和IFN-γ的产生,从而导致更大的ADCC。αCD20-IL-21治疗在利妥昔单抗耐药的A20-huCD20肿瘤中显示出更好的肿瘤控制效果。
安进公司报道了一种融合抗PD-1抗体和IL-21细胞因子突变蛋白的新型免疫细胞因子。其中,与IL-21融合的AMG256在难治性人源化小鼠模型中表现出了显著的疗效。一项评价AMG256安全性和耐受性的I期临床试验(NCT04362748)建立。
IL-21-αHSA(JS014)是通过与靶向人血清白蛋白(HSA)的纳米抗体融合而形成的一种工程化的长效IL-21,这一设计显著延长了IL-21在食蟹猴中的半衰期并增加了其暴露量。当与PD-1和T细胞免疫受体Ig和ITIM结构域(TIGIT)阻滞剂联合使用时,IL-21-αHSA不仅增强了抗肿瘤应答,而且对肿瘤再攻击具有保护作用,这提示了长期抗肿瘤免疫的建立。
IFNα
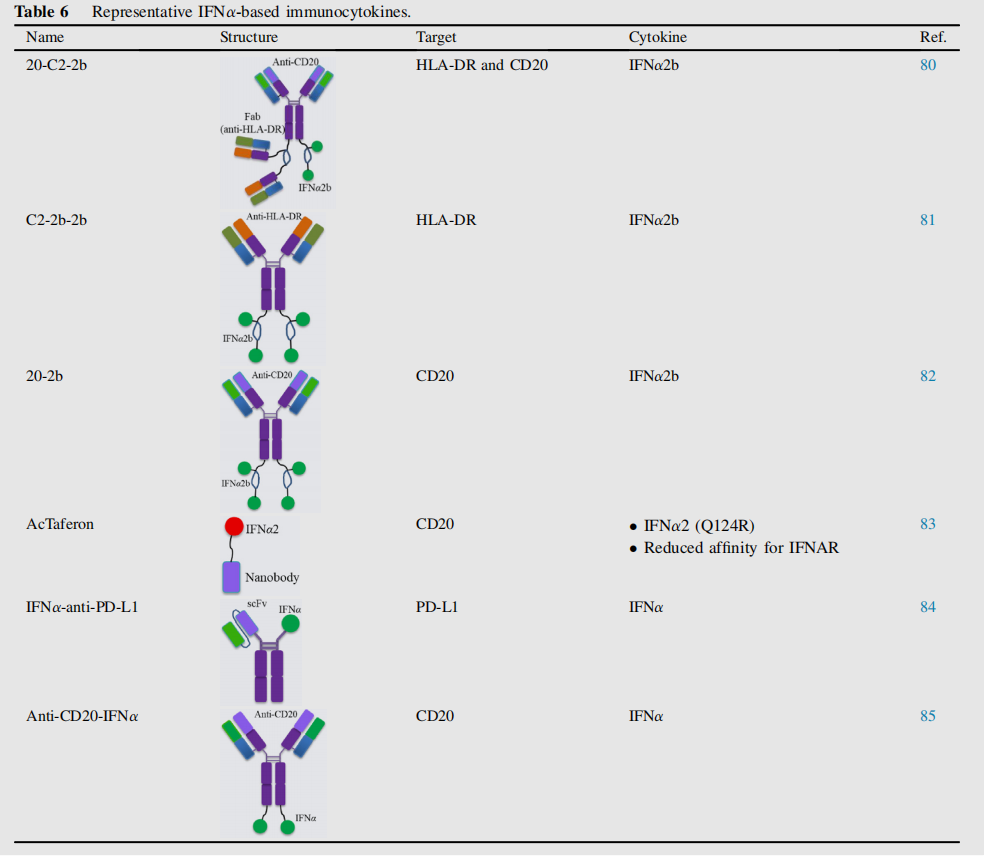
IFNα是I型干扰素家族的成员,在调节影响肿瘤生长、增殖、迁移、凋亡和分化的基因方面发挥关键作用。IFN-α的临床应用长期受到副作用和半衰期短的限制。基于IFNα的免疫细胞因子主要针对血液系统恶性肿瘤,如20-C2-2b、C2-2b-2b、20-2b等。
除了抗肿瘤作用外,IFNs还是PD-L1表达的强大诱导剂,从而抑制T细胞对肿瘤的应答,通过设计IFNα-抗PD- L1,以诱导前馈反应。这种方法协同克服了对I型IFN和检查点阻断疗法的耐药,同时最大限度地减少了晚期肿瘤的副作用。
IGN002是一种抗CD20-IFNα融合蛋白,抗CD20-IFNα介导的肿瘤根除需要肿瘤细胞表面表达I型IFN受体,而最佳的肿瘤抑制需要CD20靶向85。一项评估IGN002治疗难治性非霍奇金淋巴瘤患者的安全性和疗效的I期研究正在进行中。
新型免疫细胞因子
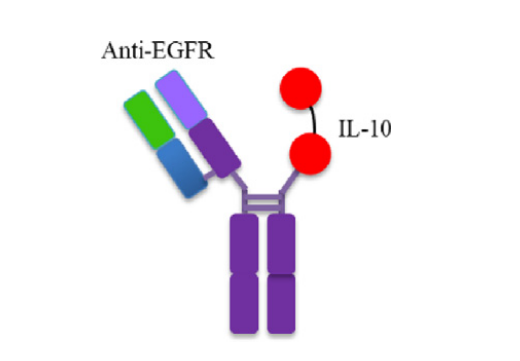
IL-10
唯一报道的基于IL-10的免疫细胞因子是CmAb-(IL10)2,其特点是Cetuximab的一条臂被IL-10二聚体取代。它在抗肿瘤疗效和毒性方面优于非靶向IL-10和Cetuximab。机制上,CmAb-(IL10)2通过树突状细胞的IL-10受体信号抑制IFN-γ诱导的肿瘤内CD8+T细胞凋亡。这些发现强调了基于IL -10的免疫细胞因子在癌症治疗中的重要前景。
IL-18
IL-18具有显著的抗肿瘤潜能,但是IL-18BP(IL-18结合蛋白)的存在阻碍了IL-18与其受体的结合,从而在TME中发挥分泌型免疫检查点的作用,从而限制了其治疗效果。IL-18的突变体DR-18通过促进多功能效应性CD8+T细胞的发育、减少T细胞耗竭和扩大干性TCF-1+前体CD8+ T细胞库,从而发挥强大的抗肿瘤作用。
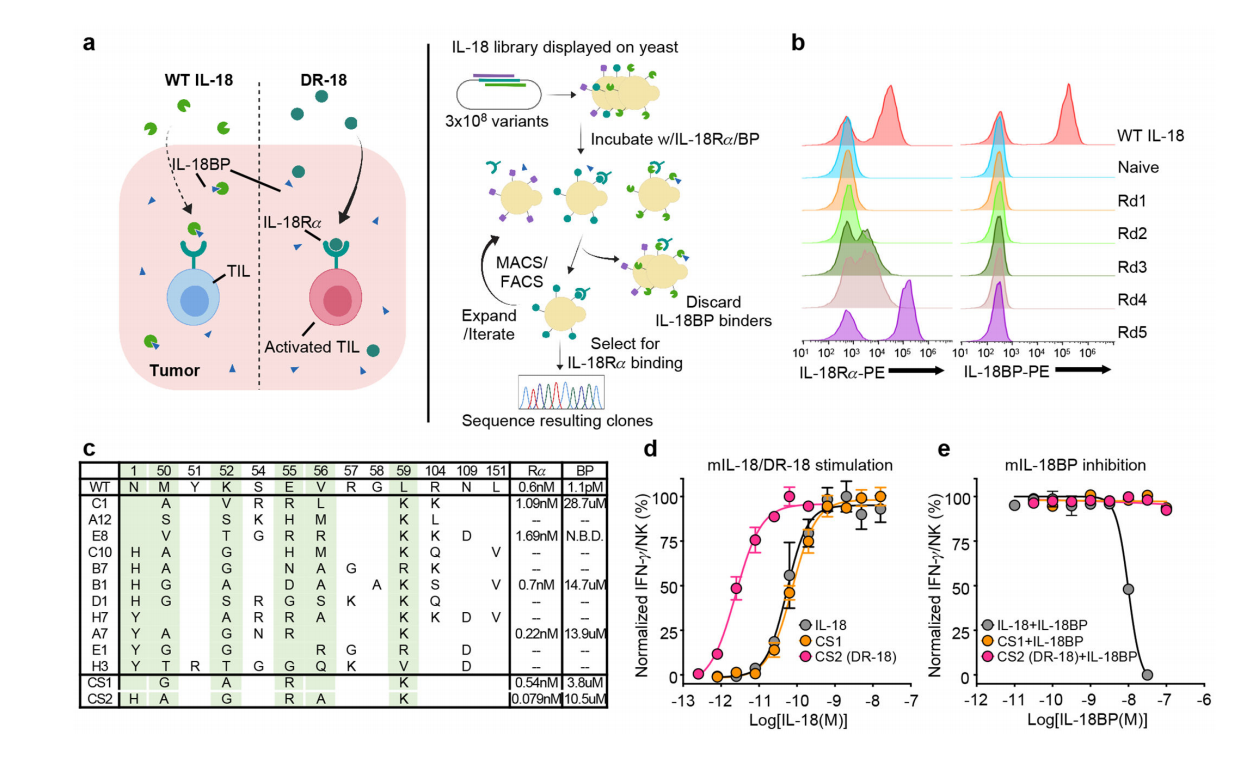
(数据来源 Zhou T, et al. Nature. 2020)
IL24
IL-24具有抑制肿瘤侵袭、转移和肿瘤干细胞干性的能力。临床研究表明IL-24表达降低与肿瘤进展和不良预后相关。IL-24的抗肿瘤作用还归因于其能够有效降低血管内皮生长因子水平,刺激CD4+/CD8+T细胞,并将TME转变为更具有免疫刺激作用的环境。构建靶向肿瘤部位IL-24的抗体-细胞因子融合蛋白在克服耐药性和免疫逃逸方面具有重要潜力。
TNF-α
TNF-α最初被认为具有细胞毒性,现在被认为也具有免疫抑制功能,促进Treg、调节性B淋巴细胞(Bregs)和MDSCs98的聚集和/或活性。L19-TNF是该领域研究的最早的细胞因子之一。
下一代免疫细胞因子
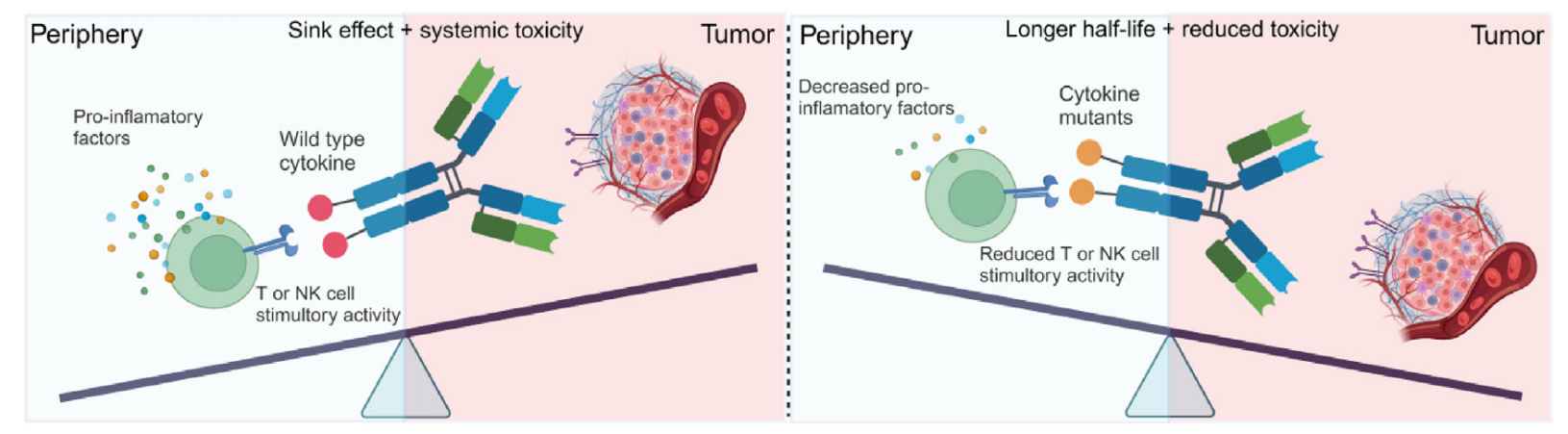
免疫细胞因子受到“细胞因子吸收”效应的阻碍,即它们在到达靶肿瘤部位之前被循环中的同源受体捕获。目前有使用受体亲和力降低的细胞因子突变体或创建条件激活的免疫细胞因子前体药物两种策略来解决“细胞因子汇”和提高肿瘤靶向性。
免疫细胞因子与效力降低的细胞因子融合
降低细胞因子对同源受体的亲和力可减轻“细胞因子吸收”效应,从而延长半衰期,并使抗体导向的肿瘤蓄积成为可能。此外,由于半衰期延长,生物活性降低可增加肿瘤部位的药物量,从而允许使用较高剂量的免疫细胞因子。IL-2、IL-15和IFNα等细胞因子的突变已显示出相关免疫细胞因子的可给药性。
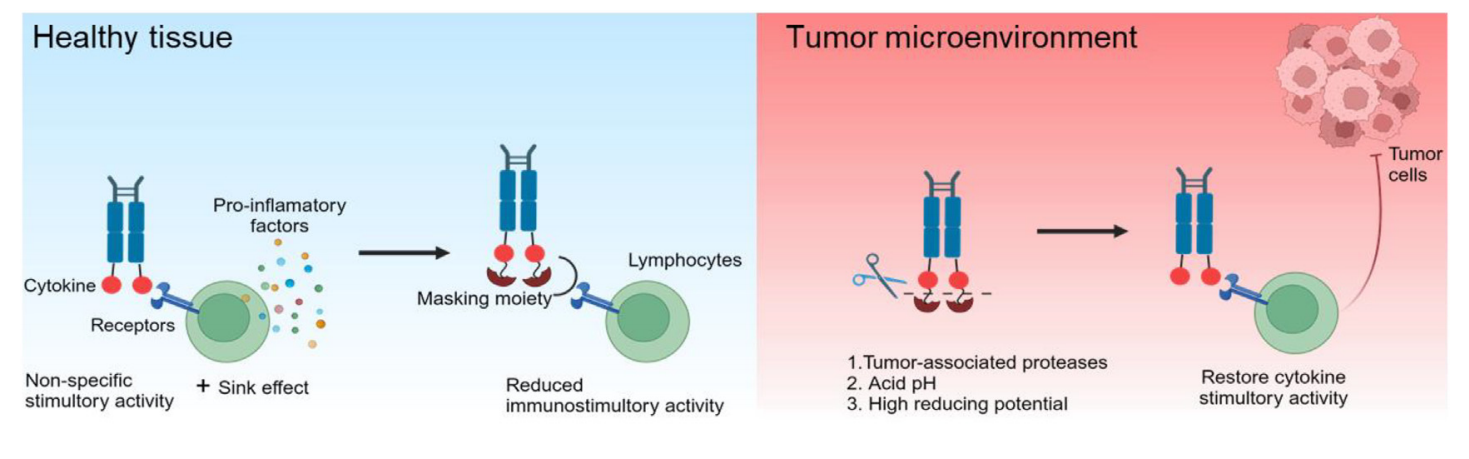
条件激活的免疫细胞因子前体药物
基于前药的策略提供了一种提高免疫细胞因子安全性同时保持抗肿瘤活性的潜在方法。利用肿瘤相关蛋白酶是实现肿瘤局部细胞因子激活的一个有前景的方向。各种掩蔽域(如天然细胞因子受体、抗体片段、肽和聚乙二醇(PEG))已被用于掩蔽细胞因子。在健康组织中,细胞因子被掩蔽基团屏蔽;在肿瘤中,它被肿瘤相关的蛋白酶、氧化还原或酸性pH值切割,释放出免疫刺激性的细胞因子。
总结
如何“匹配”抗体和细胞因子的一个基本标准是免疫细胞因子应表现出优于抗体和细胞因子联合给药的抗肿瘤活性和安全性。通过改造天然亲和力较低的细胞因子受体和前体药物技术来提高免疫细胞因子的安全性,将这两种策略的相结合的联合方法可能提供一种安全性、有效性和靶向激活最佳的免疫细胞因子通路。免疫细胞因子有望与其他治疗方法(包括抗体、化疗、放疗和过继细胞转移(ACT)治疗等)联合应用。将各种细胞因子产物与不同细胞因子载荷相结合可产生协同抗肿瘤效应,需要优化不同细胞因子的组合水平。
