研究人员研究了VUN701,一种靶向非典型趋化因子受体3(ACKR3)的纳米抗体拮抗剂。确定了ACKR3绑定需要一个延伸的CDR3环。CDR3在大多数纳米抗体中不常见,但在靶向GPCR的纳米抗体中普遍存在。结合实验和计算方法,研究人员绘制了一个抑制性ACKR3-VUN701界面,并定义了GPCR失活的独特构象机制。研究结果提供了关于A类GPCR -纳米抗体选择性的见解,并为这些新的治疗工具的开发提供了策略。
背景
G蛋白偶联受体(GPCRs)是重要的治疗靶点,但其复杂的结构对有效的药物设计提出了挑战。纳米抗体(即单域抗体)已成为靶向GPCRs的有前景的治疗策略,与传统小分子和抗体相比具有优势。然而,对使GPCR -纳米抗体相互作用的结构特征的不完全了解限制了它们的发展。
2024年5月30日美国研究人员在Nature communications上发表了一篇名为“Structural basis for selectivity and antagonism in extracellular GPCR-nanobodies”的文章,研究人员研究了VUN701,一种靶向非典型趋化因子受体3(ACKR3)的纳米抗体拮抗剂。确定了ACKR3绑定需要一个延伸的CDR3环。CDR3在大多数纳米抗体中不常见,但在靶向GPCR的纳米抗体中普遍存在。结合实验和计算方法,研究人员绘制了一个抑制性ACKR3-VUN701界面,并定义了GPCR失活的独特构象机制。研究结果提供了关于A类GPCR -纳米抗体选择性的见解,并为这些新的治疗工具的开发提供了策略。

G蛋白偶联受体(GPCR)靶向治疗的发展
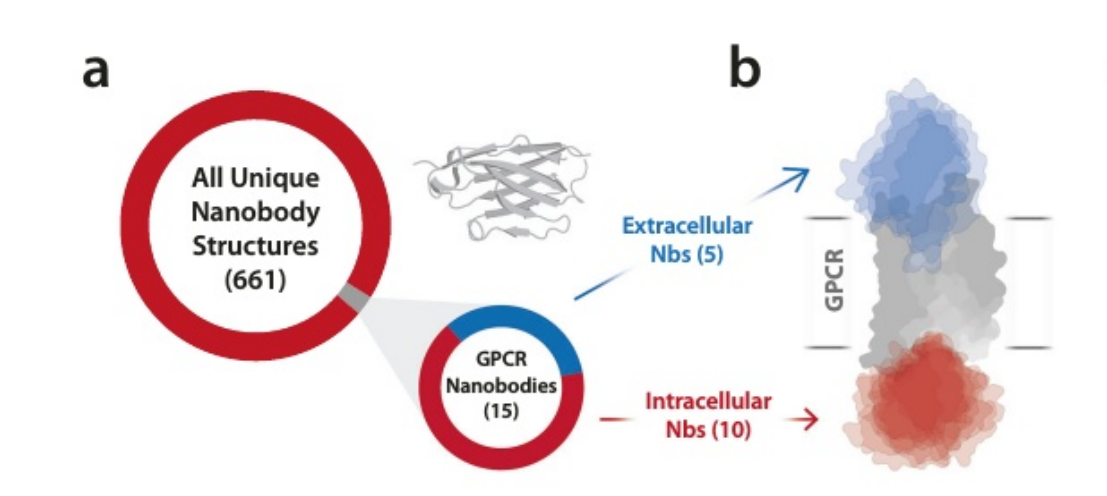
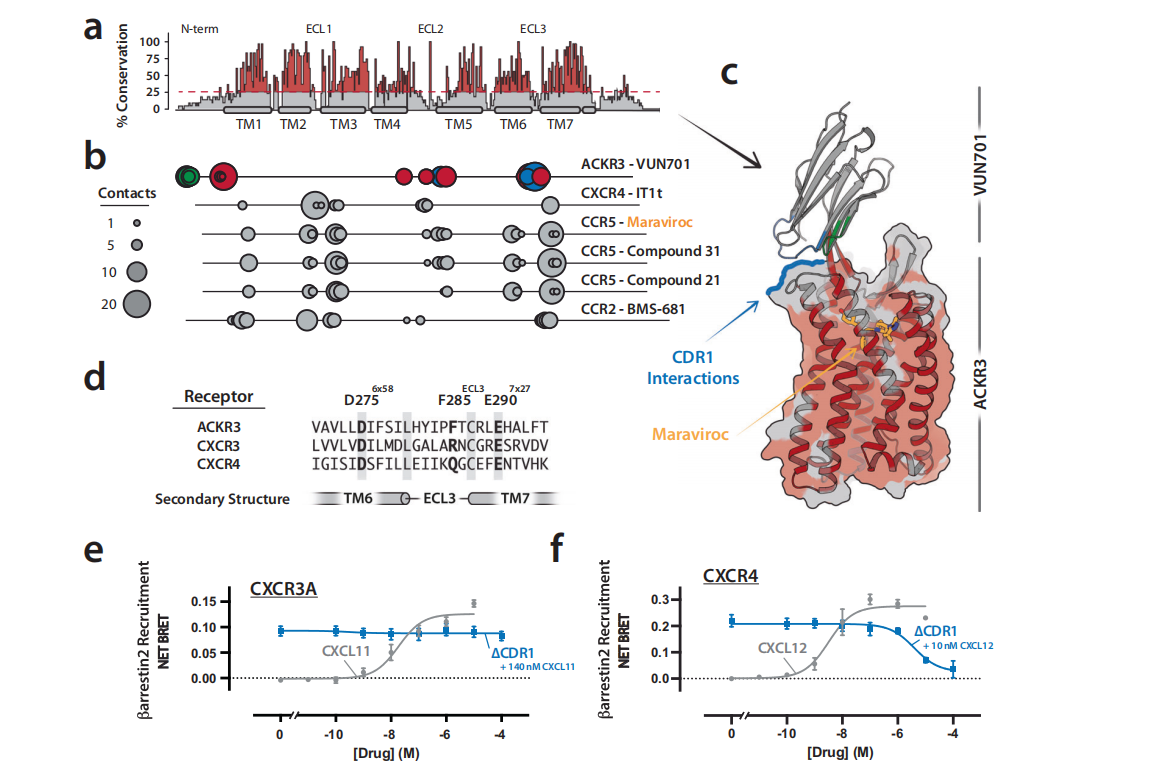
超过800种人类G蛋白偶联受体(GPCR)允许全身细胞对无数细胞外信号做出反应。这些受体的精细调控使其成为最丰富的一类治疗靶点。但是只有八分之一的GPCR被目前的治疗策略成功靶向。单克隆抗体目前已经被探索为克服GPCR治疗靶向性挑战的手段。两种针对GPCR的mAb 药物已获FDA批准(erenumab—CGRP-R、mogamulizumab—CCR4)。虽然通过单克隆抗体方式靶向取得了一些成功,但mAb膨胀的结合表面并不总是很适合对膜包埋的GPCRs显示的相对较小的细胞外表位进行选择性识别。纳米抗体具有弥合单克隆抗体和小分子之间鸿沟的潜力。2019年,第一种纳米抗体药物placizumab获批,加速了这类新型治疗分子的开发。这些小的(12 ~ 15KDa)、容易产生的蛋白使用三个互补决定区(CDR)组成的更小的对应表位与单克隆抗体更难靶向的GPCR表位结合。靶向两种GPCRs(趋化因子受体CXCR4和CX3CR1)的纳米抗体目前正在临床试验中。为了充分利用纳米抗体作为药理工具和潜在药物的潜力,了解纳米抗体如何结合细胞外GPCR表位并改变受体信号传导非常重要。我们将重点关注最丰富的GPCR靶点,即A 类GPCR。在已解析的1900多个纳米抗体结构中,只有2%靶向A类GPCR,其中大多数与受体的细胞内表面结合。在这五种与细胞外表面结合的抗GPCR纳米抗体中,只有两种具有药理活性。这些纳米抗体JN241和NbE分别是apelin受体和μ阿片受体的中性拮抗剂。JN241也被设计为 apelin受体激动剂(JN241-Y)。其他几种纳米抗体已被鉴定为细胞外拮抗剂,但缺乏纳米抗体-GPCR界面和受体抑制的结构基础的细节。
VUN701选择性及其机制
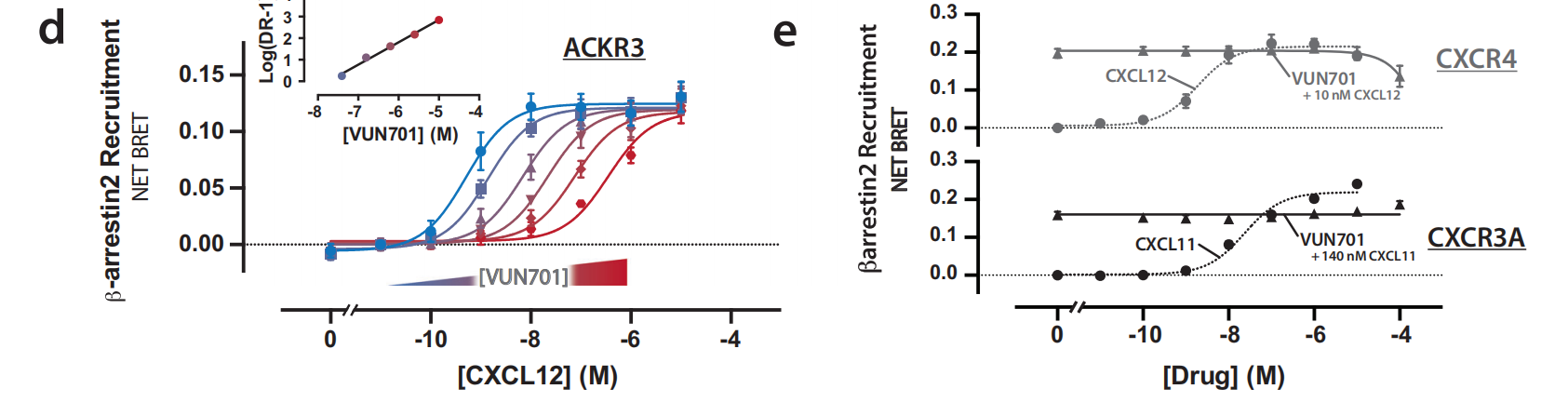
使用BRET检测法测量β-arrestin2募集至ACKR3,发现CXCL11依赖性信号被VUN701抑制;VUN701还抑制CXCL12活化。

CXCL12诱导的β-arrestin2募集到ACKR3的Schild分析表明,VUN701以浓度依赖性方式改变CXCL12的效力,而不改变CXCL12 β-arrestin2募集的斜率或最大效力。CXCR4和CXCR3分别是CXCL12和CXCL11的受体。综上所述,在细胞实验中,VUN701对CXCL11和CXCL12功能的抑制作用以及对CXCL12的Schild分析表明,VUN701作为一种选择性的、可逆的竞争性拮抗剂发挥作用。VUN701与CXCL11和CXCL12的直接竞争表明这两种配体具有重叠的正位表位。
VUN701的CDR3结构特征:
研究人员通过NMR分析了VUN701的溶液结构,VUN701采用了在其他纳米抗体结构中观察到的保守的β-三明治免疫球蛋白折叠,有三个可变环,包括互补决定区(CDRs),主要介导与目标蛋白的结合。通过存在强的跨链核Overhauser效应(NOE)信号、低均方根偏差(RMSD)值和残基91–101和105–109的高异核NOE比率证实了CDR3观察到的延伸β发夹构象。
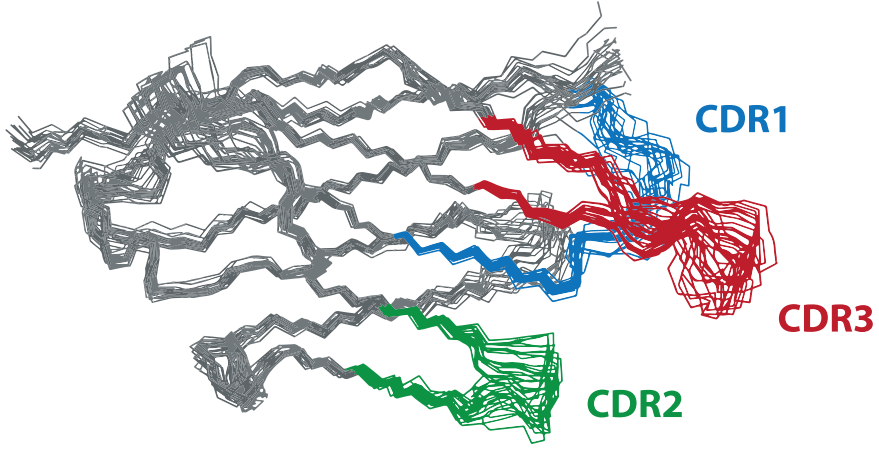
VUN701的延伸CDR3在已解析的纳米抗体结构中是一个特殊的特征,1962个解析的纳米抗体结构有三类CD3,折叠(66%)、延伸(25%)或短(9%)。

A类GPCR靶向纳米抗体时,观察到不同的CDR3分布,其中近70%属于延伸类,推测VUN701的延伸CDR3“β指”直接参与高亲和力ACKR3的结合,并替换了VUN701的每个CDR,以评估它们各自的贡献。


虽然ΔCDR1和ΔCDR2突变体保留了结合和抑制ACKR3的能力,但ΔCDR3突变体导致了几乎完全丧失抑制作用。β指的功能重要性以及与GPCRs结合的纳米抗体中扩展CDR3的富集促使研究人员提出以下假设:VUN701与ACKR3的正位口袋结合,并以模拟趋化因子配体的N端相互作用的方式相互作用。

VUN701-ACKR3界面的映射
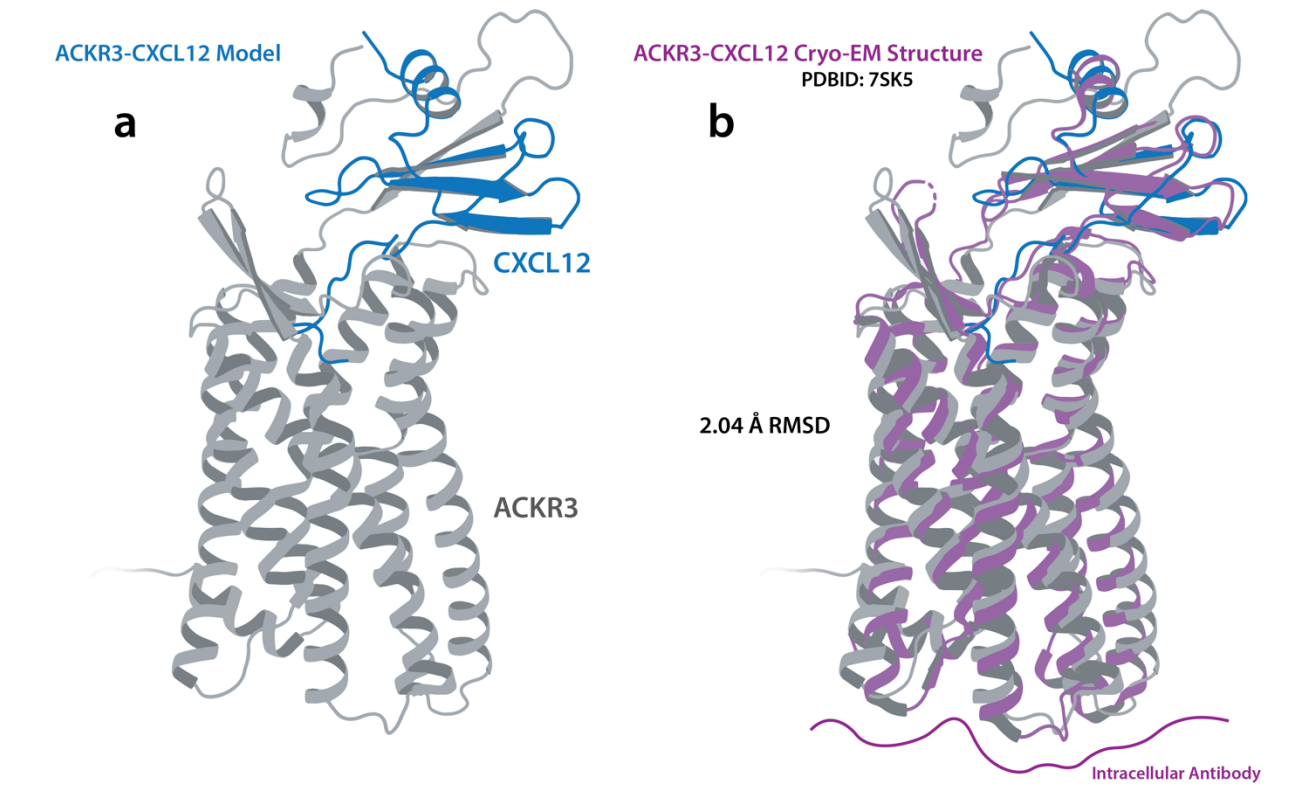
使用AlphaFold2和分子动力学模拟,研究人员构建了ACKR3与其天然配体CXCL12以及与VUN701复合物的模型。VUN701的CDR3环以一个扩展的β-hairpin构象插入到ACKR3的正交位点中。这种插入是VUN701与ACKR3结合的关键特征,并且在GPCR靶向纳米抗体中相对常见。
研究者们通过模型预测了VUN701和ACKR3之间可能的接触点,并通过实验验证了这些接触点的重要性。特别是CDR3环中的某些氨基酸残基(如K100和R103)与ACKR3的特定残基(如D2756x58和E2907x27)形成了关键的相互作用。
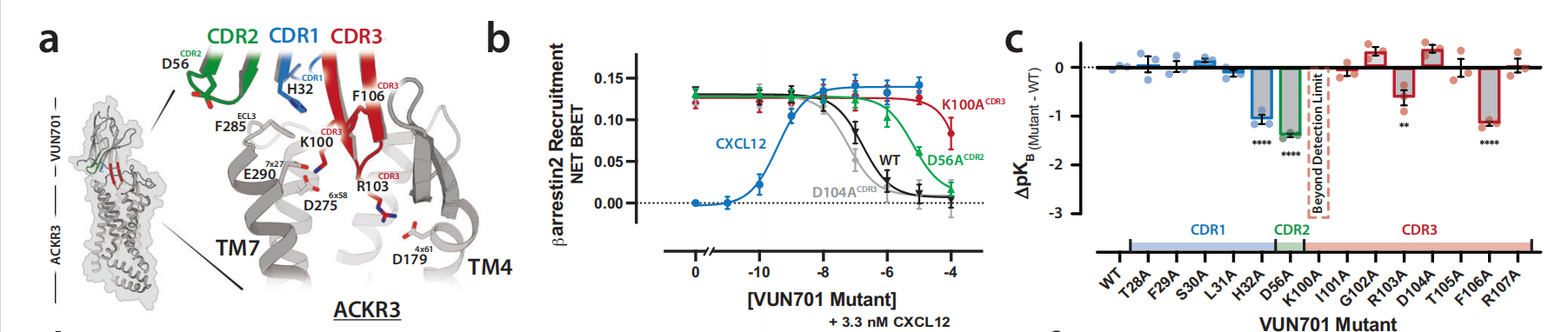
研究人员为了评估ACKR3接触的重要性,选择了趋化因子结合口袋内壁的14个带电芳香残基进行丙氨酸取代,研究人员发现了ACKR3取代的功能效应,其中五种取代对CXCL12效力几乎没有影响,而其他六种取代使EC 50改变了2到100倍。
ACKR3拮抗机制
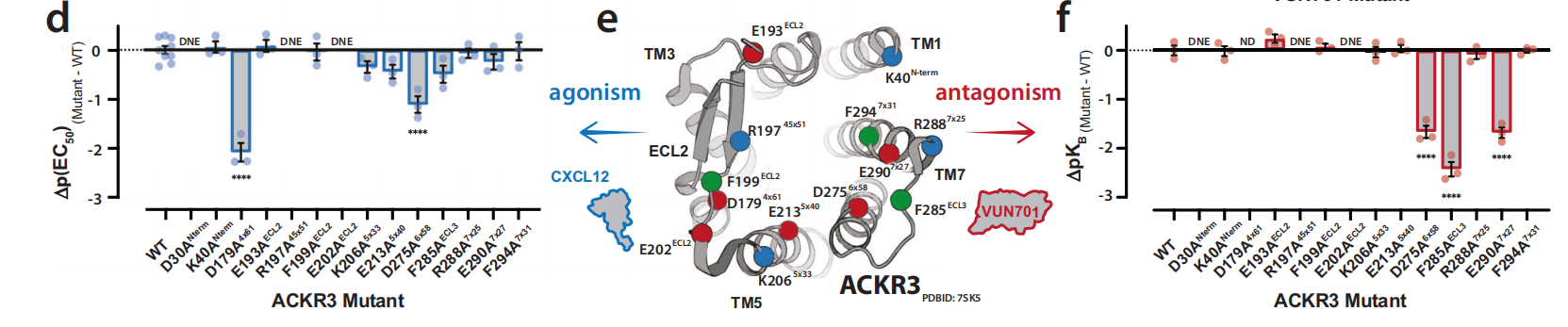
对与趋化因子激动剂CXCL12和纳米抗体拮抗剂VUN701结合的ACKR3进行结构比较,可以揭示受体失活的关键接触或构象变化。VUN701-ACKR3模型与CXCL12-ACKR3低温电子显微镜结构(PDB: 7SK5)之间最大的差异是跨膜螺旋7(TM7)发生了显著位移。VUN701的结合似乎将CDR1和CDR2置于TM7正上方,形成一个盖子,阻止TM7占据CXCL12-ACKR3结构中观察到的位置。CXCL12诱导的TM7向上移动与保守的极性侧链网络有关,从而稳定了活性构象。该网络包括与D902x50相互作用的TM7中的NPxxY基序。VUN701的结合阻止了TM7的向上移位,而TM7向上移位是与保守的NPxxY激活基序结合所必需的。

VUN701的选择性
通过BRET实验,研究者们测量了VUN701对ACKR3受体的功能性选择性。实验结果显示,VUN701能够以纳摩尔级的IC50值有效抑制ACKR3与CXCL11和CXCL12的结合,但对CXCR4或CXCR3的β-arrestin2招募没有影响,这表明VUN701对ACKR3具有高度的选择性。通过比较不同趋化因子受体的序列保守性,研究者们发现跨膜螺旋和正交位点的残基在序列上更为保守,而N-末端、ECL2和ECL3区域的残基序列则较为多变。这表明VUN701的选择性可能与其能够结合ACKR3特有区域的残基有关。VUN701的CDR1和CDR2环与ACKR3的特有区域相互作用,对VUN701的选择性有重要贡献。VUN701的选择性不仅由正交位点内的接触点决定,还由其与ACKR3特有区域的远距离接触所编码,这为设计新的GPCR靶向纳米抗体提供了结构基础。
总结与展望
本研究深入分析了VUN701纳米抗体与非典型趋化因子受体3(ACKR3)的相互作用,揭示了其高选择性和拮抗作用的结构基础。VUN701利用其独特的扩展CDR3 β-hairpin结构与ACKR3的正交位点结合,有效地阻碍了受体的激活,显示出高度的选择性。研究结果为理解GPCR-纳米抗体相互作用提供了新的见解,并为开发新型GPCR靶向药物,特别是针对特定GPCRs的激动剂或拮抗剂纳米抗体的设计提供了结构基础。
