CD38是一种具有外酶活性的跨膜糖蛋白,也具有受体和黏附分子的功能。CD38在正常的淋巴细胞、髓系细胞及非造血组织细胞中,CD38分子表达水平较低,但在MM细胞中CD38高水平表达,因此CD38分子是MM治疗的理想靶点。
CD38分布
在多发性骨髓瘤(MM)细胞上高表达,对肿瘤的发生、发展起调控作用。除此之外,CD38在B细胞、巨噬细胞、树突状细胞(DCs)、固有淋巴细胞(ILC)、自然杀伤(NK)细胞、T细胞、中性粒细胞和单核细胞中高表达。
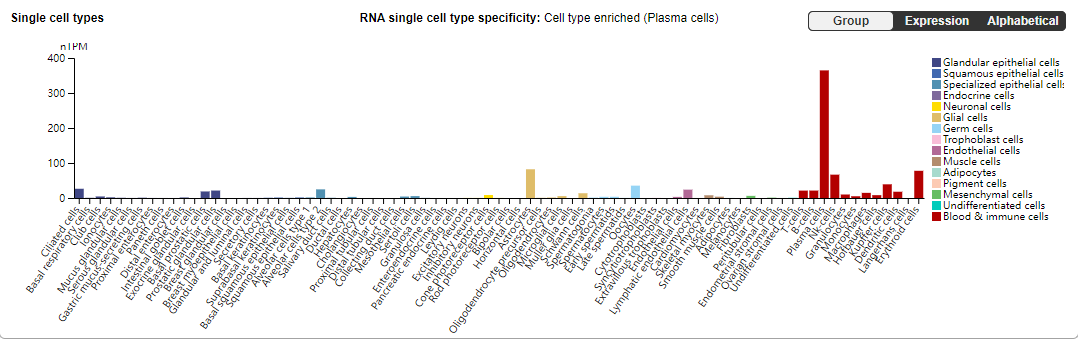
(数据来源 the human protein atlas)
CD38结构和酶功能:
CD38是一个单个跨膜片段的Ⅱ型跨膜糖蛋白,分子量为46kDa,由C端较长的胞外区、单次跨膜域和N末端短的细胞质尾三个部分组成。CD38的三级结构显示它是由两个独立的结构域组成,一个是NH2-端结构域,由一束α-螺旋和两个短β-链组成;另一个是COOH-端结构域,包括一个由四个平行β-链组成的β-片段,周围环绕着两个长α-螺旋和两个短α-螺旋。这两个不同的结构域由一个包含三个肽链的铰链区连接,包括残基118-119、143-144和200-201。这两个独特的结构域通过Cys-119和Cys-201形成的一个二硫键进一步稳定了相对构象。整体结构呈“L”形,其中NH2-端结构域主要由α-螺旋组成,而COOH-端结构域主要由β-链组成。这种结构与Aplysia环化酶的二级结构非常相似。

(数据来源 Malavasi F, et al. Physiol Rev. 2008)
CD38是一种同时具有环化酶和水解酶的活性的双功能胞外酶,参与核苷酸代谢。CD38主要表达在免疫细胞上,并将烟酰胺核苷酸(NAD+和NMN)代谢为ADPR和cADPR,从而导致钙的动员。虽然细胞内的CD38主要存在于细胞器的细胞质和细胞膜上,但绝大多数CD38的活性是在细胞外,从而导致NAD+合成所必需的NAD+前体(如NMN)的降解。在感染、代谢功能障碍、衰老和肿瘤生物学的背景下,CD38的胞外活性对NAD+的稳态有广泛的影响。催化反应的产物ADPR、cADPR等物质作为细胞中重要的第二信使,可以通过调控细胞钙离子的方式来影响细胞生长、胰岛素释放、T细胞激活等功能。

(数据来源 Hogan KA, et al. Front Immunol)
CD38抗体作用机制
CD38单克隆抗体(mAb)通过多种机制,包括补体依赖的细胞毒作用、抗体依赖的细胞介导的细胞毒作用、抗体依赖的细胞吞噬作用、程序性细胞死亡、酶调节和免疫调节等,已成为MM的有效治疗手段。

(数据来源 Gao L, et al. Br J Cancer. 2023)
临床CD38靶向抗体
2015年,强生公司开发的全人源抗CD38抗体Daratumumab(Darzalex)被批准用于治疗复发性耐药多发性骨髓瘤患者。Daratumumab成为市场上第一个CD38抗体。
2020年3月2日,赛诺菲的肿瘤药物Isatuximab获得FDA批准,这是继Daratumumab之后的第二个CD38抗体药物,同样用于MM治疗。目前,Daratumumab和Isatuximab在MM治疗中均显示出显着疗效。
最近,一种名为SAR442085的新型人源化CD38单克隆抗体显著增强了对激活的Fcγ受体(Fcγ r)的亲和力,从而增强了对多发性骨髓瘤的抗肿瘤活性。与Daratumumab和Isatuximab单抗相比,SAR442085被证实对CD38具有较高的结合亲和力。这些观察结果突出了SAR442085的临床前疗效,并支持在多发性骨髓瘤患者中对这种新型抗CD38抗体开展进一步的临床试验。
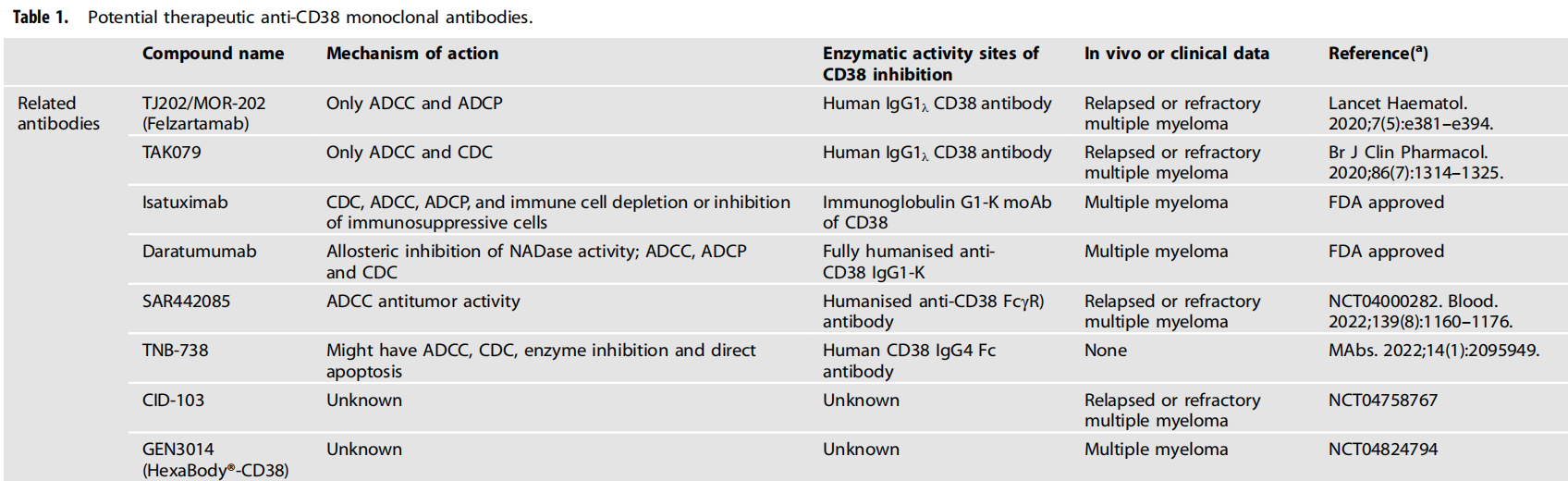
(数据来源Gao L, et al. Br J Cancer. 2023)
CAR-T细胞耗竭的潜在标记分子
近年来,CAR-T细胞疗法成为了血液系统恶性肿瘤及自身免疫疾病最具前景的治疗手段之一,CD38被确定为耗竭CAR-T细胞的潜在标志,抑制CD38酶活性可增强CAR-T细胞的细胞毒性和抗肿瘤功效,抑制CD38可逆转衰竭并改善CAR-T细胞功能,从机制上讲,CD38抑制通过特定的信号通路抑制糖酵解,表明CD38抑制在增强CAR-T细胞治疗方面的潜在临床应用。

(数据来源 Huang Y, et al. Cell Rep Med. 2024)
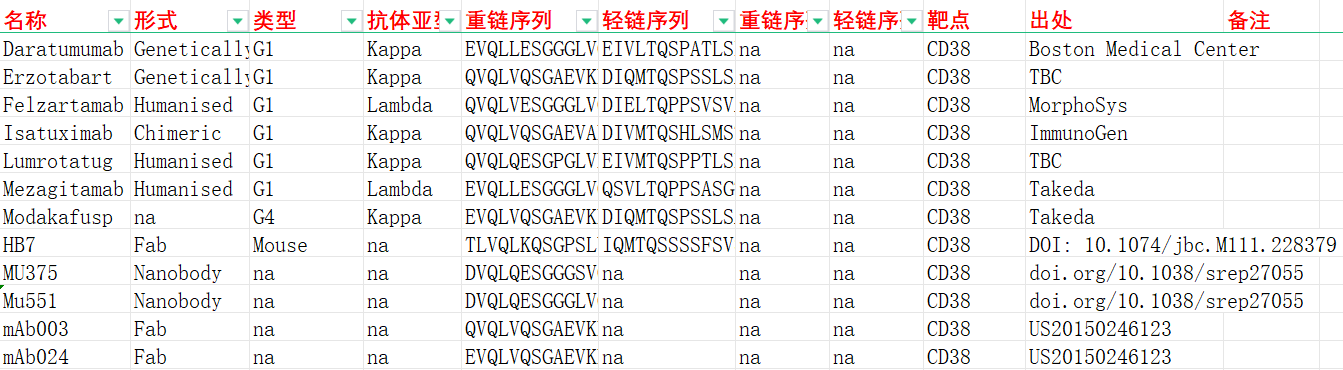
我们收集整理一批CD38相关抗体序列信息。文档可关注公众号,号内回复“CD38”下载。