CD117,也称c-Kit,KIT或干细胞因子(SCF)受体,CD117是一种III型酪氨酸蛋白激酶,在细胞存活和增殖、造血、干细胞维持、配子发生、肥大细胞发育、迁移和功能的调节,黑色素生成中发挥重要作用。
CD117分布
CD117主要分布在粒细胞,黑色素细胞中,除此之外在神经元细胞,腺上皮细胞中也有表达,参与细胞的生长发育。

(数据来源 uniprot)
CD117结构:
CD117由存在于4号染色体长臂区域(4q11-4q13)的原癌基因编码,与RTK家族III类的其他成员类似,在结构上,c-Kit由三个结构域组成:疏水性跨膜、胞外配体结合结构域和具有酪氨酸激酶活性的胞质结构域。c-Kit中的活性位点以结合的Mg2+离子和ADP为中心,位于N叶和 C叶之间的裂隙中。ADP的结合构象证明腺嘌呤核心位于疏水口袋中,与Cys673和Glu671形成氢键。近膜结构域位于激酶结构域的COOH-和NH2 -末端叶之间。在非活性状态下,近膜区域形成发夹环,插入活性位点并破坏调节过程,抑制其激酶活性,从而充当自抑制调节域,CD117的近膜端发挥着关键的调控作用。

(数据来源 Pathania S, et al. Biochim Biophys Acta Rev Cancer. 2021)
CD117信号通路和调控:
当CD117的配体SCF二聚体和CD117的胞外结构域结合时,CD117就会被激活。无活性的CD117 以单体形式存在于细胞表面;而SCF以二聚体形式存在于细胞外。结合SCF后,CD117受体形成同二聚体,引起细胞内催化结构域中特定酪氨酸残基的自磷酸化。CD117磷酸化触发多个信号转导通路,包括JAK/STAT、RAS/MAP激酶通路、PI3激酶、PLCγ通路和SRC通路。CD117被激活,细胞就会存活、增殖、分化和迁移,需要这些途径的重叠。CD117在自磷酸化后被SOCS6 快速泛素化,导致内化和降解。SCF/CD117信号轴的激活可以驱动细胞存活、增殖和运动;是癌症进展的重要步骤。
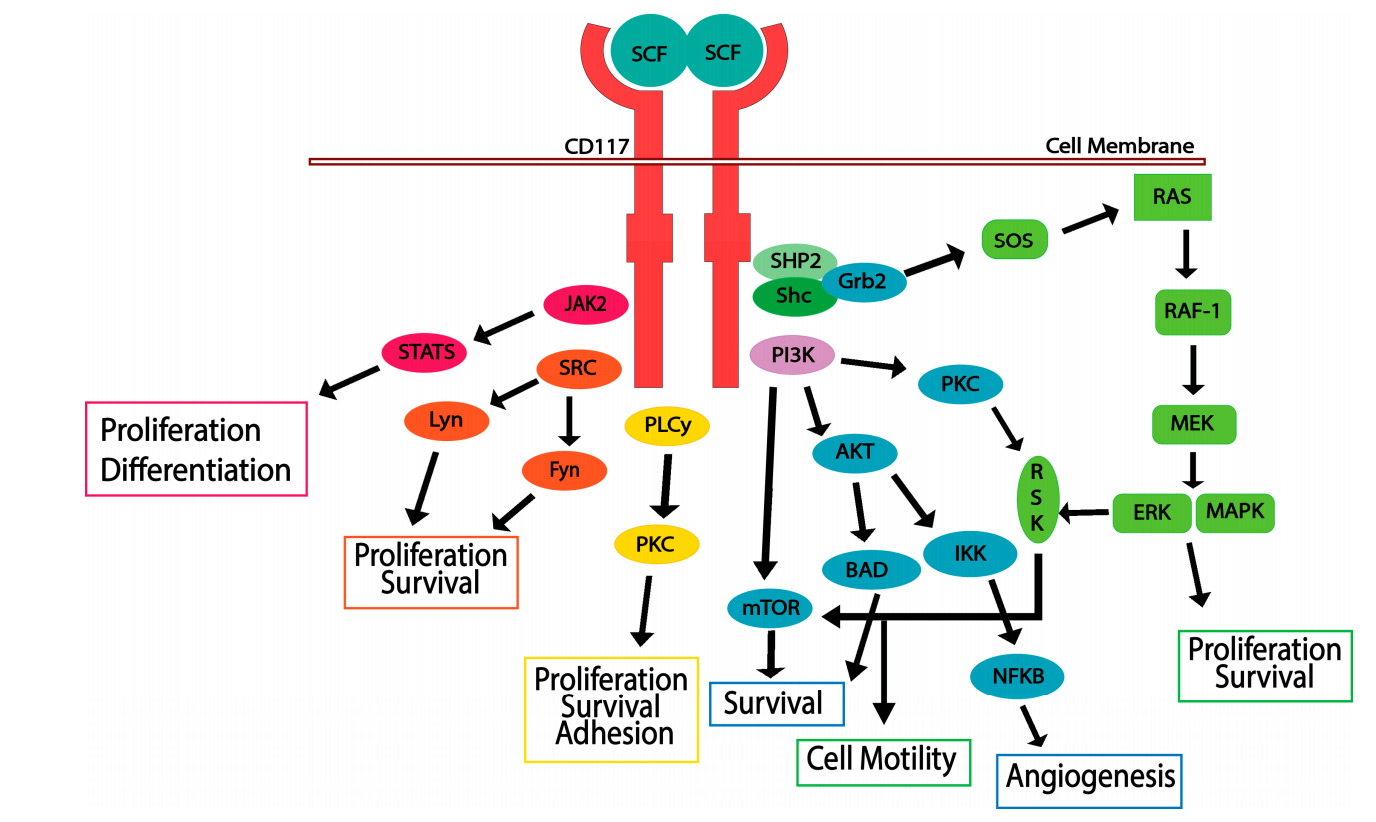
(数据来源 Foster BM, et al. Biomedicines. 2018)
CD117靶向治疗策略
靶向和治疗c-KIT突变肿瘤的两种主要方法是小分子抑制剂和单克隆抗体(mAb)。在小分子抑制剂方面,甲磺酸伊马替尼是第一个被开发并批准用于治疗TK活性异常的血液恶性肿瘤的酪氨酸激酶抑制剂(TKI)。随后,它被批准作为晚期转移性GIST患者的一线治疗方法。其他TKI被开发出来,包括ripretinib、avapritinib、nilotinib、amuvatinib和tivozanib等小分子抑制剂,用于靶向c-KIT治疗各种肿瘤。

(数据来源 Abdellateif MS, et al. Onco Targets Ther. 2023)
至于mAb,它们用于靶向或抑制失调的c-Kit,以克服用TKI治疗的某些野生型或突变型c-Kit阳性癌症中产生的耐药性。此外,抗体药物偶联物(ADC)是通过将mAb与不同治疗药物(例如化疗药物、TKIs或免疫检查点抑制剂(ICIs))偶联而设计的。这些ADC可能是一种成功的治疗方式,能够对癌细胞产生有效的细胞毒性作用,同时减少对正常组织的毒性,从而提高患者的生存率和治疗结果。
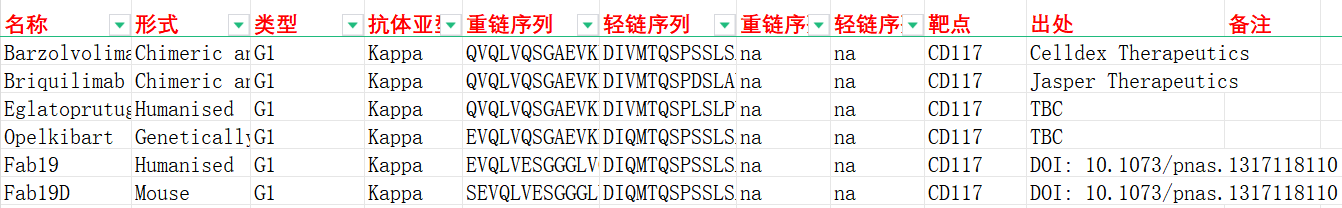
我们收集整理一批CD117相关抗体序列信息。文档可关注公众号,号内回复“CD117”下载。