背景
体外诊断(IVD)是生物医药产业的重要组成部分,IVD行业成本效益比极高,仅占医疗资源的3%便掌握了70%以上的临床决策权,是临床医生制定临床治疗方案的主要依据,是医疗器械中最大的细分市场。受新冠肺炎疫情影响,中国体外诊断市场近两年呈现爆发式增长。IVD产业上游在整个体外诊断产业链中具有重要的战略意义,抗原抗体是诊断技术创新的源头,原料的主导地位决定了体外诊断系统的性价比,也是产业发展的瓶颈。
目前有多种方式用于筛选诊断抗体,但是每种技术都有其局限性,例如基于血清的获取的可变性和控制困难,杂交瘤衍生抗体的开发漫长而困难,噬菌体展示技术的免疫偏倚导致的序列和表位多样性的潜在限制,以及昂贵的单个B细胞筛选。研究人员发现蛋白质质谱测序的获取时间更短、成本更低,被诊断公司视为一条捷径,影响了传统的抗体开发。但是在诊断性抗体的开发中,下游检测的方法学差异和抗体可变区核心外恒定区域的影响往往被忽视。
2024年6月25日中国农业大学王战辉教授团队在VIEW上发表了一篇名为“The challenges and breakthroughs in the development of diagnostic monoclonal antibodies”的文章,该文章深入分析体外诊断(IVD)面临的挑战,提出下一代诊断抗体开发的创新策略。这些策略旨在更接近抗体发现的金标准,增强诊断试剂产品的竞争力。

抗体发现
抗体于1890年被德国科学家在注射了感染破伤风杆菌的兔子血清的小鼠中发现,当时科学家发现血清中存在着不含细胞的免疫活性物质:抗毒素,也就是现在生物医学领域所熟知的抗体。随后证实了抗体是一类对侵入物质具有特异性结合能力的蛋白质。然后阐明了抗体的结构,以及抗体遗传多样性原理的发现。抗体发现主要分为三个阶段,第一阶段是血清学说,在血清中发现了抗体;第二阶段是免疫细胞学说,明确了B细胞产生抗体的理论基础;第三阶段是遗传多样性学说,阐明了抗体遗传物质的产生过程。基于这些理论,抗体的获取方法学被陆续开发出来,包括通过血清的方法获取抗体;通过杂交瘤技术将产生抗体的B细胞与不断增殖的骨髓瘤细胞融合,从而产生具有相同特异性的单克隆抗体;通过噬菌体展示技术深入发现遗传物质并结合重组蛋白表达进行繁殖,利用该方法可以获得高亲和力、高特异性的单克隆抗体,对生命科学中的分子识别和疾病治疗具有重要意义;以及目前蓬勃发展的单B细胞筛选结合单细胞测序技术,一般动物免疫后,脾脏、淋巴系统和外周血中均含有能分泌单个抗体的B细胞,该技术能筛选出能有效分泌目标抗体的B细胞并从其遗传物质中获取抗体基因序列。

此外,随着质谱技术的进步,蛋白质氨基酸测序可以绕过单个B细胞,从靶向角度出发,从血清中富集针对抗原的有效抗体,利用质谱技术获得目标抗体的蛋白质序列,从而获得候选目标抗体。
诊断抗体研发问题分析
动物免疫阶段问题:
抗体制备过程中免疫原的设计和获取对免疫效果起着至关重要的作用。因此从免疫原获取的角度看,存在以下问题:抗原靶点的复制难度较大,尤其是一些膜蛋白,表达周期长,开发成本高。免疫蛋白的来源主要依赖两种方式:天然提取和重组蛋白。天然提取只能获得部分免疫原性的蛋白,对于大多数项目来说,免疫原主要依赖重组蛋白,在设计重组蛋白时,需要分析蛋白结构、理化性质等,选取结构表位或线性表位。另外,一些抗原蛋白极不稳定,需要以特定的配方保存。作为免疫原,稍有不慎导致蛋白构象发生改变,就无法得到对真正抗原具有良好特异性的抗体。实现免疫蛋白的精准复现是目前筛选优质诊断抗体的难点。免疫效率有待提升,随着临床生物标志物对精准检测的需求越来越大,对诊断抗体原料的要求已经不再是简单的识别抗原,而是需要高亲和力,同时还要有高线性。
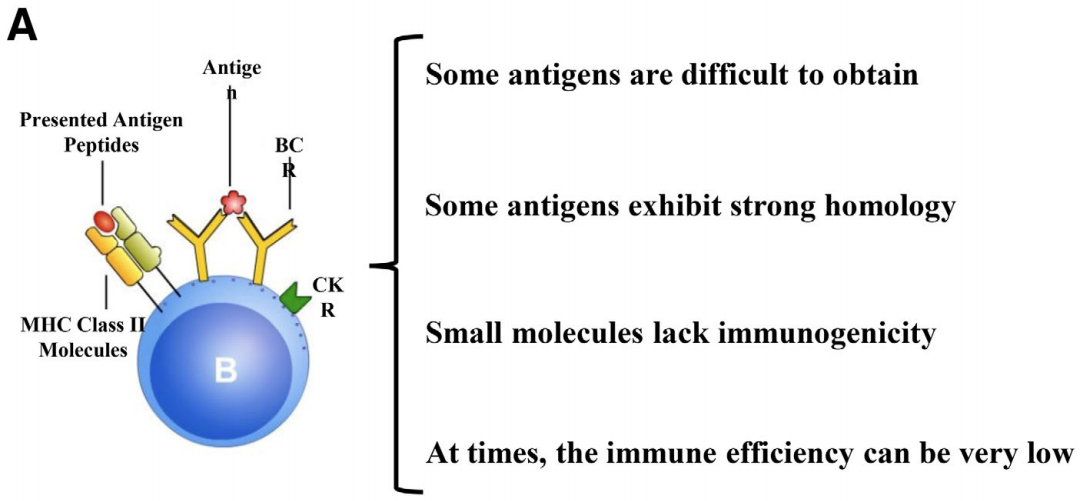
抗体筛选系统问题:
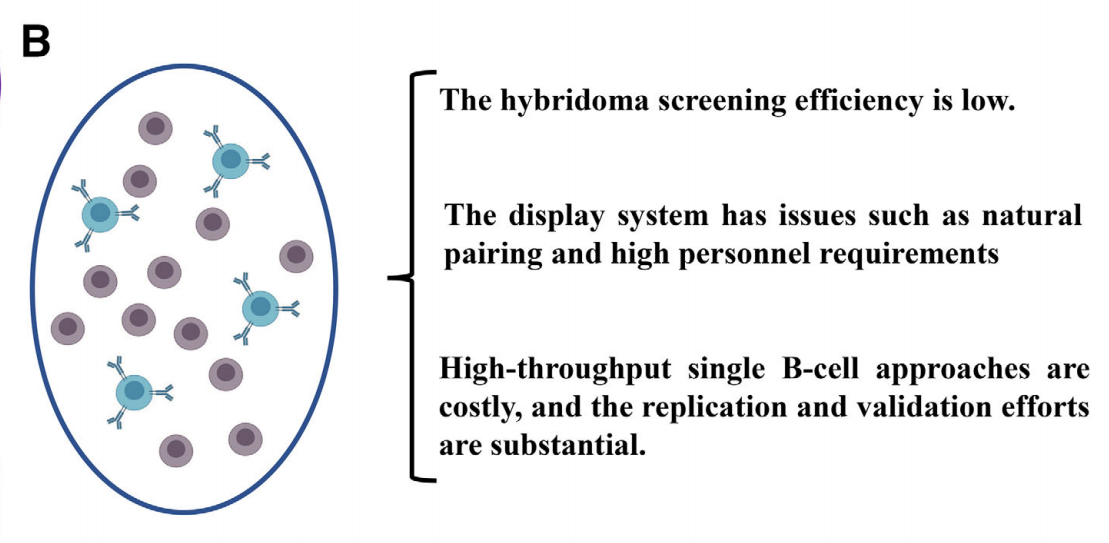
单克隆抗体的发现研发经历了三个阶段,分别是杂交瘤技术,噬菌体展示技术,单B细胞筛选技术,但是每种技术也都有他的局限性。
杂交瘤技术:其周期相对较长,在没有动物免疫的情况下需要4-6个月。由于PEG融合的成功率较低,大约百分之一的阳性筛选率,因此使用电穿孔、仙台病毒或其他病毒等替代方法提高杂交瘤融合效率。此外,由于杂交瘤细胞染色体不稳定性成分比例较高,且存在部分抗体产量较低的杂交瘤,不适合在GMP级生物反应器中长期有效使用。而且在培养初期,部分低产克隆生长速度可能快于高产克隆,导致在分子单克隆筛选时被排除。从腹水中制备抗体需要建立大型动物设施,运营成本高昂,未来还可能引发与动物福利相关的伦理问题。
噬菌体展示技术:噬菌体表面可展示的蛋白质肽段长度有限,传统的Y型抗体筛选只能展示scFv部分,难以获得自然配对的重链和轻链组合。通过噬菌体展示技术从B细胞中获取有效抗体序列一般需要3-5轮筛选,而且设计的引物存在局限性,无法有效获得所有有效抗体序列。此外,由于筛选过程需要反复洗涤,对实验人员造成了很大的时间和精力负担。
单B细胞筛选技术:在筛选过程中,高通量的单个B细胞面临一定的挑战,在获得数百甚至数千个候选抗体序列后,对这些序列进行打分排序,并确认最优的抗体或一系列抗体组合,需要大量的重组表达和验证工作。此外,基于此类孔分离技术的筛选以及后续的表达验证对研发成本提出了相当大的挑战。
抗体表达再现问题
异源蛋白表达系统存在局限性:大肠杆菌表达系统不适合表达完整的抗体分子,只能表达单链抗体或抗体片段;酵母、昆虫和植物等虽然也具备类似糖基化的翻译后修饰功能,但与人或哺乳动物真核细胞相比,这些细胞的糖基化模式不同,其表达的重组抗体与人天然抗体的质量差异较大,只有哺乳动物细胞才适合表达异源人抗体。
构建高产细胞珠存在挑战:目前国际上用于重组抗体生产的工程化细胞株表达量可达20~70 pg/细胞/天。通过细胞工程技术、位点特异性整合技术和高通量筛选等方法来提高细胞株的生长和表达能力,基因组学分析表明,高产细胞株的表达能力是多种细胞属性协同作用的结果,包括能量代谢、氧化还原状态、生长能力和蛋白加工能力等。
诊断抗体结构设计有待深入探索:近95%的诊断原材料企业主要关注完整抗体基因序列的复制,而没有深入考虑抗体的结构差异及其对下游试剂的后续影响。抗体Fc区的作用、诱发人抗鼠抗体(HAMA)效应等问题需要进一步研究。关于重新配置和重新排列传统IgG抗体中的Fv、CH1(CL)、铰链、CH2和CH3区域以实现多样化的概念框架的潜在好处仍然存在疑问。
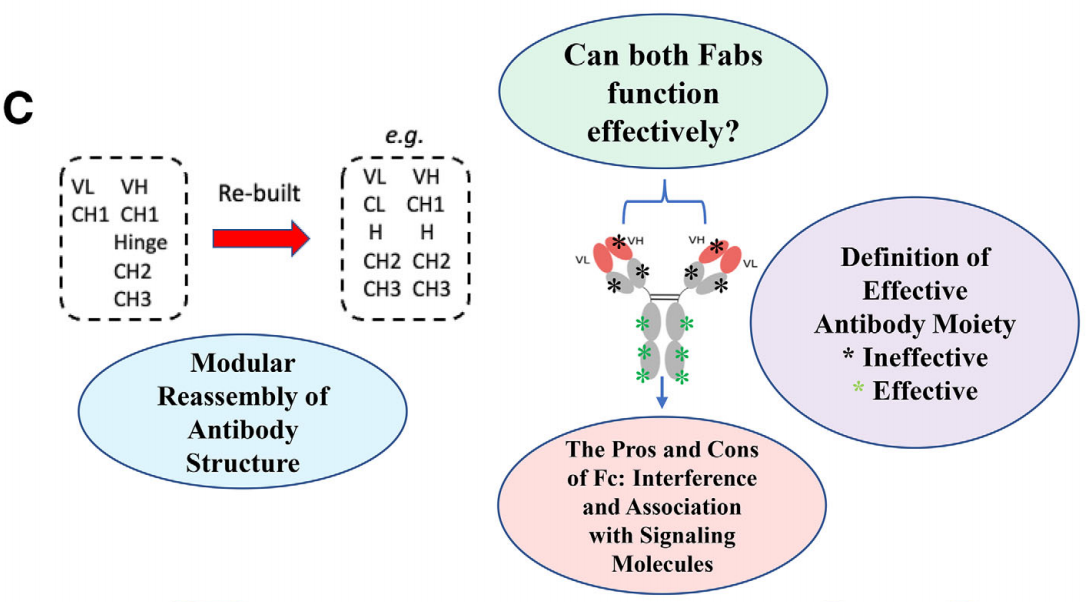
诊断单抗挑战及探索策略
针对上述的一些技术挑战,研究人员提出了新一代诊断性单克隆抗体开创性开发方法,并全面实施。
RNA免疫:RNA疫苗的出现利用病毒的遗传密码“诱骗”人体细胞产生与病原体表面相同的蛋白质,在迅速应对新型传染病爆发方面具有无与伦比的优势,采用RNA疫苗模式,不仅有效解决了获取复杂免疫原的问题,而且通过绕过传统的免疫原复制或纯化步骤,增强了免疫原的原始构象,理论上提高了免疫反应的有效性。从成本角度来看,这种方法大大缩短了开发周期,并降低了与免疫原获取相关的费用。
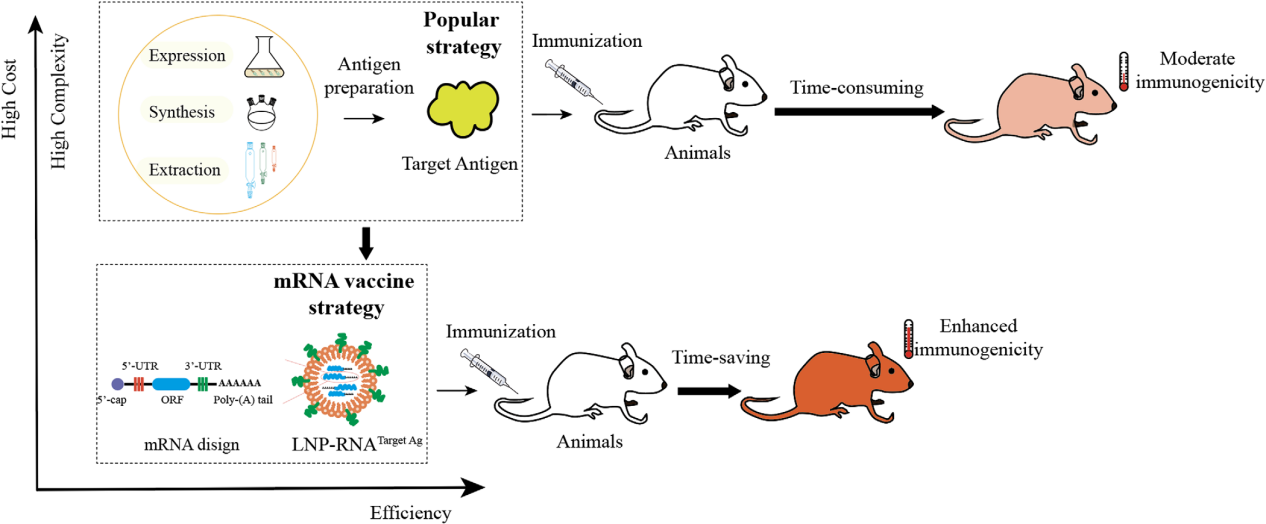
计算机模拟技术:在获得大量候选抗体序列后,利用计算抗体平台模拟候选抗体与抗原的结合位点和亲和力排名,可以从数百到数千个候选抗体中精确选择出数十种最佳诊断抗体。这种方法大大降低了复制的通量和成本,为生物技术与计算机信息技术(BTIT)的融合提供了一条有希望的途径,以完成单B细胞高通量抗体开发的最后一块拼图。

诊断抗体的模块化定制:治疗性抗体已经呈现出各种结构合理的设计,如纳米抗体、双特异性抗体、三价抗体,四价抗体,而诊断抗体只涉及纳米抗体和Fab抗体相关的小部分产品。随着未来对简化流程的需求和新方法的出现,抗体的模块化定制是必然趋势。系统地组织和研究抗体的模块化设计将对ADC/AOC中药物分子/核酸的定向负载和ACC中抗体的高丰度负载具有重要意义。未来新方法的出现无疑将要求抗体结构的多样性,为诊断抗体和生物制药发展的进步提供重要机遇。

蛋白质测序技术的利与弊
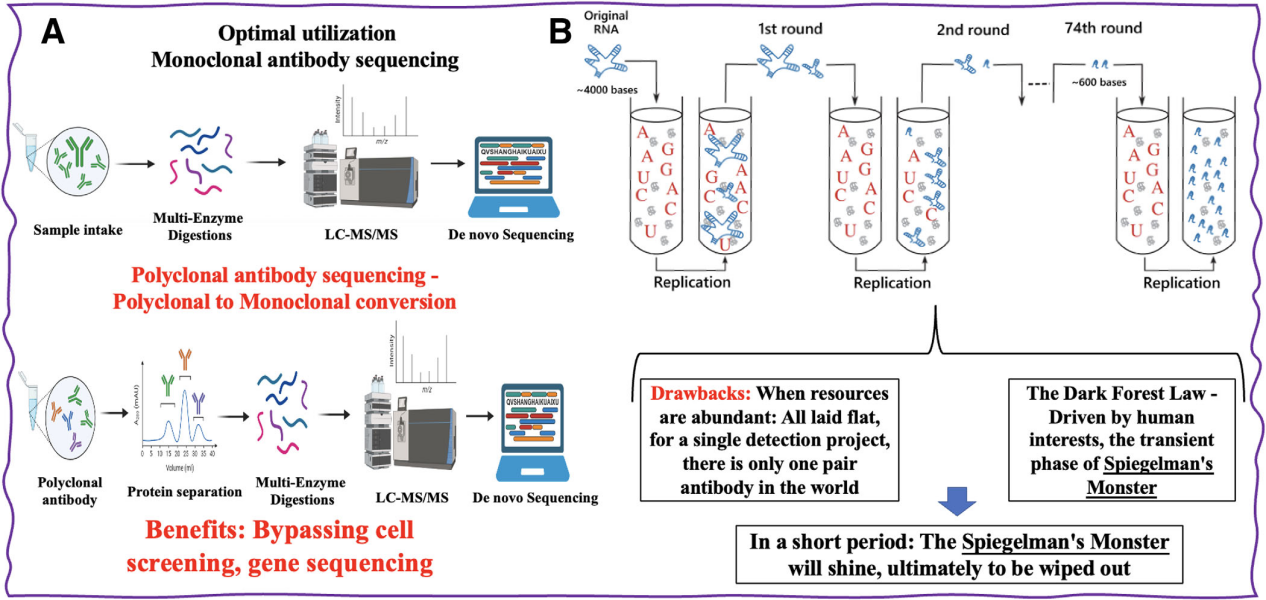
蛋白质测序的优势:蛋白质测序主要有两种:Edman降解测序和基于质谱的蛋白质测序,Edman测序方法无需蛋白质数据库,可直接分析氨基酸信息,对于从游离的α-氨基开始表征蛋白质的N端尤为重要。然而,Edman测序在序列长度和游离α-氨基的可用性方面存在局限性。基于质谱的蛋白质测序,在从N端进行的蛋白质测序取得了重大进展。质谱测序技术可以通过系统性地分解肽段来确定完整的蛋白质序列,包括翻译后修饰。为对动物血清中的多克隆抗体进行测序提供了一种潜在的解决方案,可以绕过单个B细胞或有效遗传物质筛选的繁琐而昂贵的过程。直接从末端获取有效抗体的序列信息大大缩短了开发周期,彻底改变了诊断抗体的开发,进而改变了治疗性抗体的开发。蛋白质测序技术可以用于快速测序新冠病毒中和抗体,为诊断抗体开发提供新思路。将蛋白质测序技术与计算机辅助抗体设计平台相结合,可以从大量多克隆抗体序列中精准筛选出最优单克隆抗体。
蛋白质测序的劣势:由于诊断抗体知识产权体系不完善,以及IVD试剂中抗体的低消耗和复杂性,很多IVD厂商基于蛋白从头测序技术,由原来的诊断抗体正向开发或外包,转向全球抗体分析试验,基于蛋白质测序技术的逆向开发和复制,可能会严重打击正向开发诊断抗体的积极性,导致整个行业发展缓慢。
总结与展望
抗体筛选的方式目前主要有杂交瘤技术,噬菌体展示技术,单B细胞筛选技术。诊断抗体乃至治疗性抗体研发的最关键环节在于抗体序列的发现,抗体质谱测序技术的成熟意味着研究人员可以绕过动物免疫和细胞筛选等繁琐的抗体序列发现过程。仅利用历史抗体-抗原数据、服务器和算法即可生成新的抗体序列。随着蛋白质谱测序技术的成熟和商业化应用,其相对较短的序列获取时间和相比正向开发显著降低的测序成本,让更多诊断公司将其视为抗体开发的捷径。但是我们需要合理的使用,反向抗体开发的滥用,虽然会给诊断抗体产业带来短期的盈利,但最终也会导致整个领域发展缓慢甚至停滞。我们需要重新定义诊断抗体的结构,从抗体结构角度分析抗体在诊断中的方法论,进一步分化抗体的设计,对提升诊断试剂的性能至关重要,是未来诊断抗体发展中不可或缺的阶段。现阶段,诊断抗体的开发需要原始理论创新与前沿技术突破的有机结合,具体表现为新型免疫机制与高通量筛选技术的协同、计算抗体平台的建立、新方法与抗体结构机理研究的结合。战略定位基于AI生成的抗体平台也被认定为保持诊断抗体开发行业领先地位的有效途径之一。
