背景
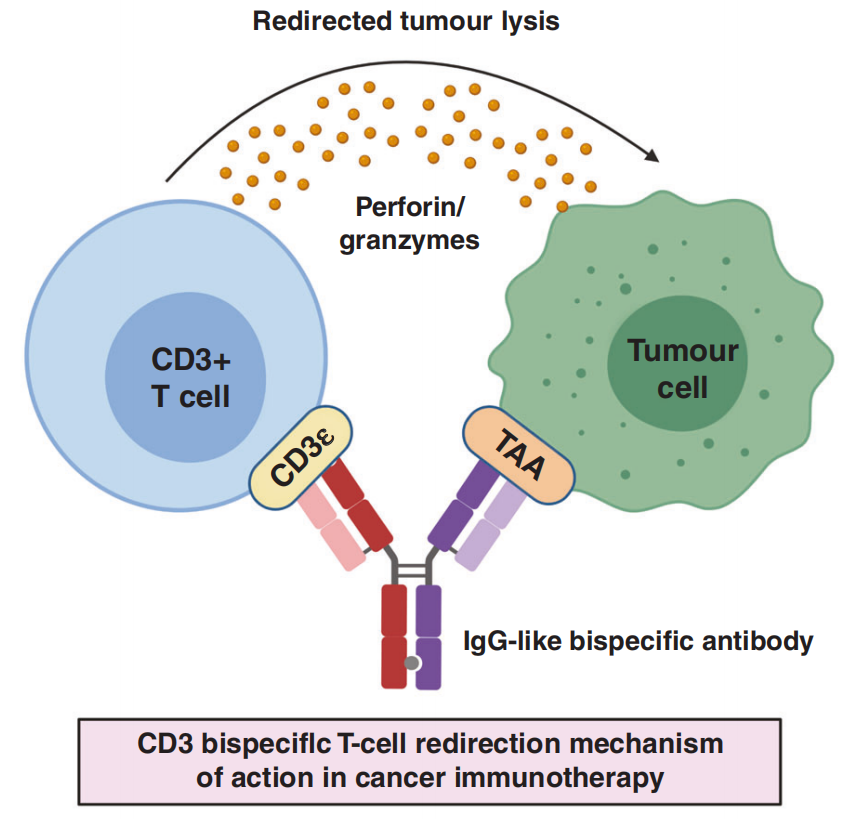
在过去10年中,利用适应性免疫反应来摧毁肿瘤的癌症免疫疗法取得了实质性进展,特别是在延长危及生命的恶性肿瘤患者的生存期方面。T细胞在癌症免疫疗法的临床成功中具有核心作用,因为它们能够强大地杀伤肿瘤细胞,并且可以向其他免疫细胞发出信号,以协助破坏肿瘤。T细胞衔接器(T-cell engager,TCE)双特异性抗体是免疫疗法的一个亚群,是能够指导T细胞杀伤肿瘤的工程抗体药物。TCE通过双特异性抗体的一臂与T细胞上的细胞表面受体(通常是CD3)结合,而另一臂与癌细胞上的细胞表面抗原结合来发挥作用。当靶抗原也存在于健康细胞上时,可能会产生靶向、肿瘤外毒性。TCE给药时可能会伴有毒性副作用,从而限制剂量。包括TCE在内的强效T细胞活化疗法常伴有细胞因子释放综合征(CRS)的严重毒性。轻度CRS患者可以接受治疗和支持,而重度CRS患者则需要干预和终止治疗,这限制了TCE的治疗时间窗。
(数据来源 Singh A, et al. Br J Cancer. 2021)
2024年7月4日,研究人员在MAbs上发表了一篇名为“Engineering a tumor-selective prodrug T-cell engager bispecific antibody for safer immunotherapy”的文章,研究人员解析了一种新型抗CD3抗体(E10)的抗原结合片段与其CD3表位的复合物的晶体结构,并利用这些信息设计出一种可被肿瘤富集的基质金属蛋白酶2(MMP-2)激活的掩蔽型抗体。证明了这种前药TCE能够依赖于MMP-2的肿瘤选择性T细胞活性,证明了类似的掩蔽策略可用于创建常用的抗CD3抗体SP34的前药物形式。该研究展示了一种开发优先考虑安全性的免疫调节疗法的方法,并有可能推进癌症免疫治疗的治疗策略。

抗CD3 mAb克隆E10与CD3ε肽结合的结构
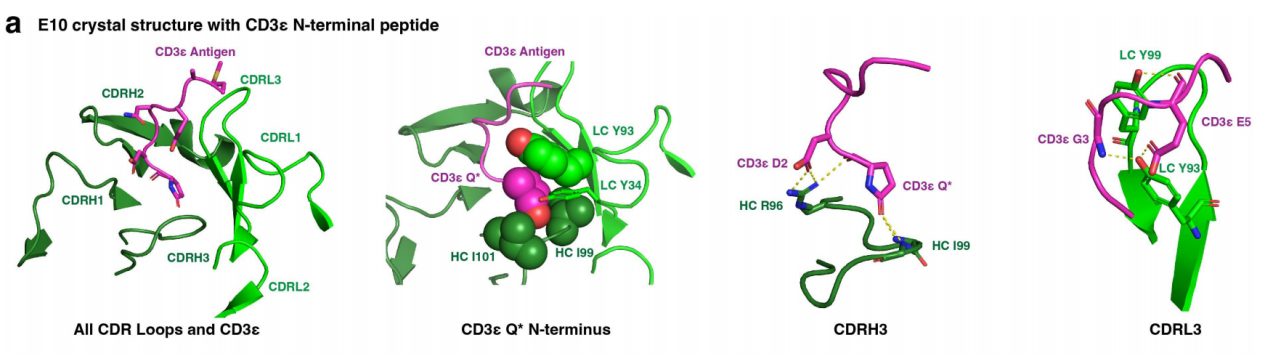
E10 mAb是由重组人/猕猴CD3εγ-Fc免疫兔子而产生的,为了揭示兔mAb E10如何与CD3ε结合,研究人员解析了E10的Fab与猕猴CD3εγ-histag蛋白复合物的晶体结构。猕猴CD3εγ-histag蛋白的N端只有7个氨基酸(PCA-DGNEEM,其中PCA是焦谷氨酸),表明CD3ε的N端代表了全部表位。在结构中,CD3ε肽N端焦谷氨酸深埋在抗体Fab的VH和VL结构域之间形成的凹槽中,在那里它形成几个疏水和极性相互作用。焦谷氨酸的亚甲基与重链(HC)上的Ile97以及轻链(LC)上的Tyr93和Ile101之间发生疏水相互作用。焦谷氨酸的侧链羰基与HC-Ile99和HC-Gly100的主链酰胺基团之间形成氢键。焦谷氨酸的主链羰基还与HC-Arg96形成氢键。CD3ε肽残基Asp2通过与HC-Arg96形成氢键进一步稳定相互作用。CD3残基Gly3和Glu5与LC-Tyr93和LC-Tyr99之间也形成氢键。这一结果促使研究人员假设CD3肽可以以某种方式连接到E10的N末端,从而使其能够结合并掩盖E10的CDR区域。
CD3ε变体的亲和力测定
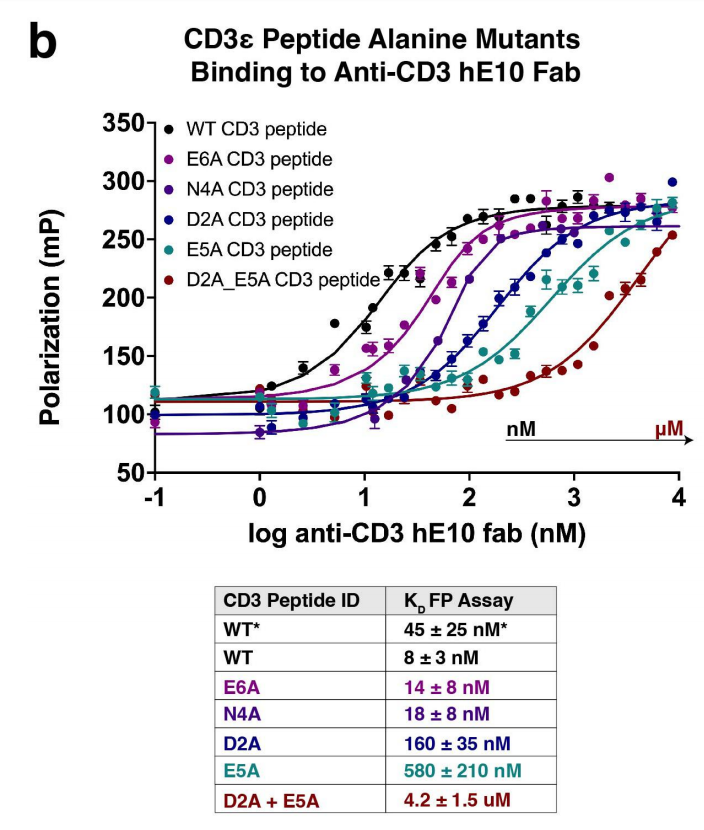
研究人员使用荧光偏振(FP)测量来确定人源化的E10抗体(hE10)Fab结构域对各种CD3ε肽变体的结合亲和力。使用TAMRA标记的WT CD3ε肽(序列PCA-DGNEEM),确定了相互作用的平衡解离常数(KD)为45±25nM。与晶体结构一致,将Asp2或Glu5突变为丙氨酸,两者都与抗体CDR环形成氢键,降低了结合亲和力。表明这两个氨基酸在hE10中发挥重要作用。
pro-TCE的设计
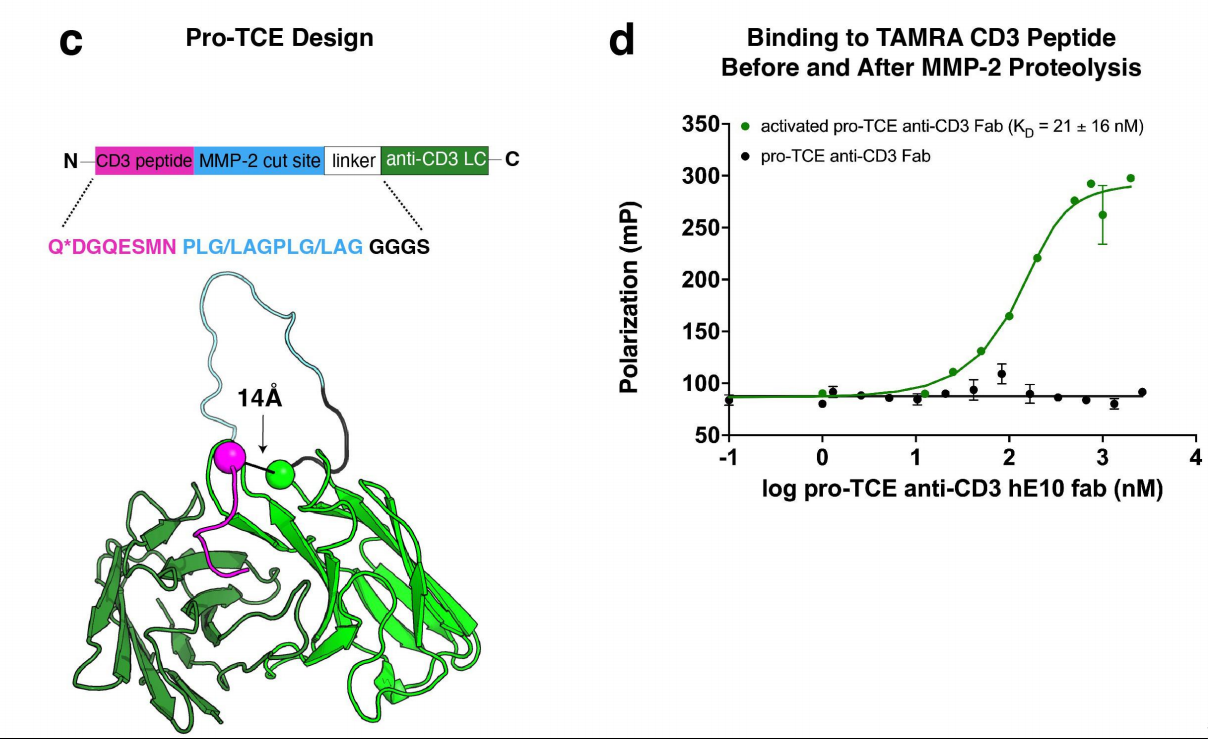
CD3ε多肽与hE10的CDR环的紧密亲和力表明其可作为一种有效的掩蔽结构域来制备条件激活的TCE。在晶体结构中,E10抗体LC的N端位于CD3ε肽末端14 Å处;研究人员使用不同长度的甘氨酸丝氨酸连接体进行了分子模拟,连接体中也包括MMP-2裂解位点。模拟结果表明,与两个MMP-2裂解位点(序列PLG/LAGPLG/LAG-GGGS)结合的4-残基连接体足以使CD3ε肽与其结合位点相互作用。为了屏蔽hE10,研究人员使用了与CD3ε的野生型(WT)序列(PCA-DGNEEM)略有不同的屏蔽序列(PCADGQESM)。使用FP测量了在用MMP-2蛋白酶处理之前和之后掩蔽的hE10 Fab对TAMRA-CD3ε肽的亲和力,发现掩蔽的Fab对肽没有亲和力,而蛋白酶处理的Fab与TAMRA-CD3ε肽结合的测量KD为21 ± 16 nM。表明在CD3ε肽段和抗体之间加入含有MMP-2剪切位点的柔性连接子,可以在MMP-2存在时使CD3ε肽段从抗体上解离,从而激活抗CD3抗体的功能。
Pro-TCE的生成和物理特性
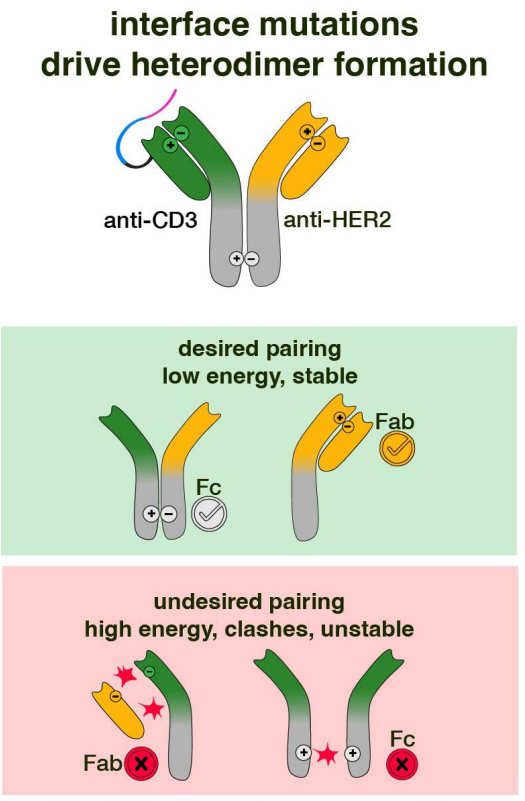
研究人员设计了一种双特异性IgG抗体,创建了一种可诱导的TCE,该抗体将掩蔽的hE10作为抗体的一方,将抗人表皮生长因子2(HER2)抗体(pertuzumab)作为抗体的另一方。为了促进IgG抗体在表达期间的高效组装,研究人员在HC/LC界面加入了OrthoMab突变,从而有利于hE10 LC与hE10 HC的配对,以及pertuzumab的LC和HC的配对。抗体的Fc也包含突变,从而促进hE10/pertuzumab异源二聚体的形成,而非形成hE10和pertuzumab的同源二聚体。HER2(一种在几种实体肿瘤中表达的蛋白质,也是肿瘤学中公认的临床靶点),以将原型pro-TCE活性导向相关的靶肿瘤抗原。
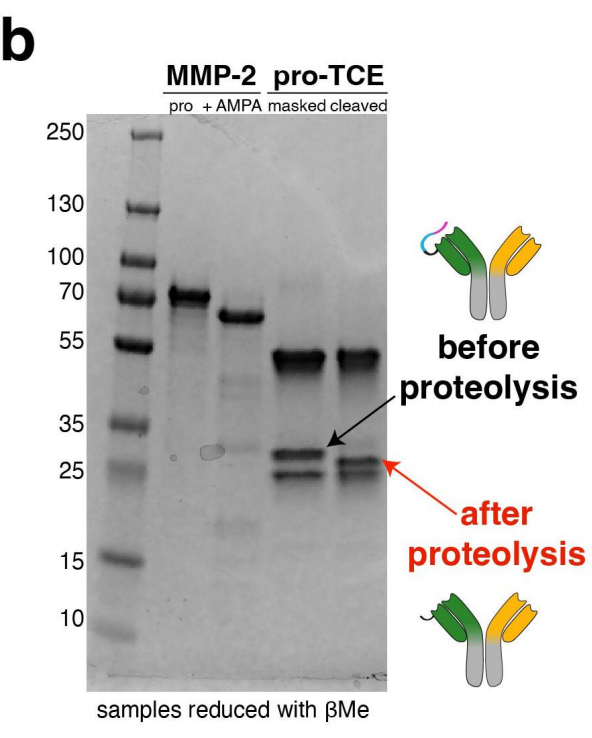
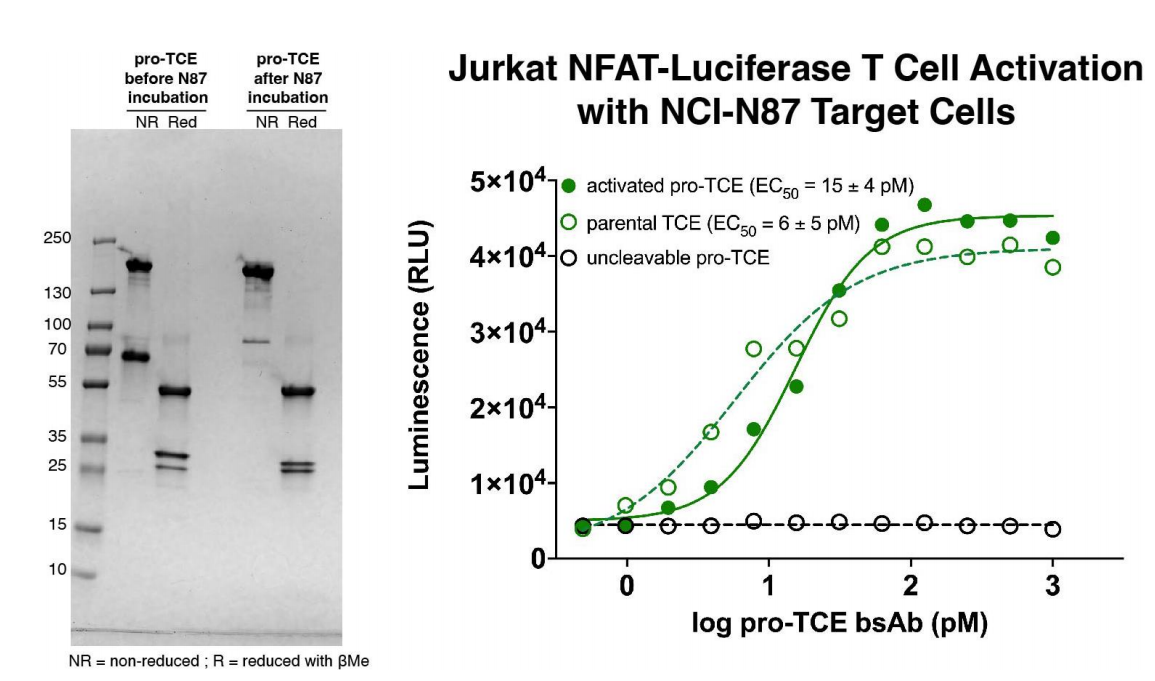
将pro-TCE双特异性抗体在Expi293F哺乳动物细胞中瞬时表达,并通过蛋白A树脂纯化,之后进行凝胶过滤,获得双特异性抗体样本。研究人员使用生化迁移率-凝胶位移试验,分析在pro-TCE与MMP-2蛋白酶孵育前后凝胶迁移率/蛋白分子量的变化来观察蛋白水解。发现使用纯化的重组MMP-2进行蛋白水解后,我们观察到抗CD3 LC发生了质量偏移,对应于前药抗CD3成分在pro-TCE上成功裂解。
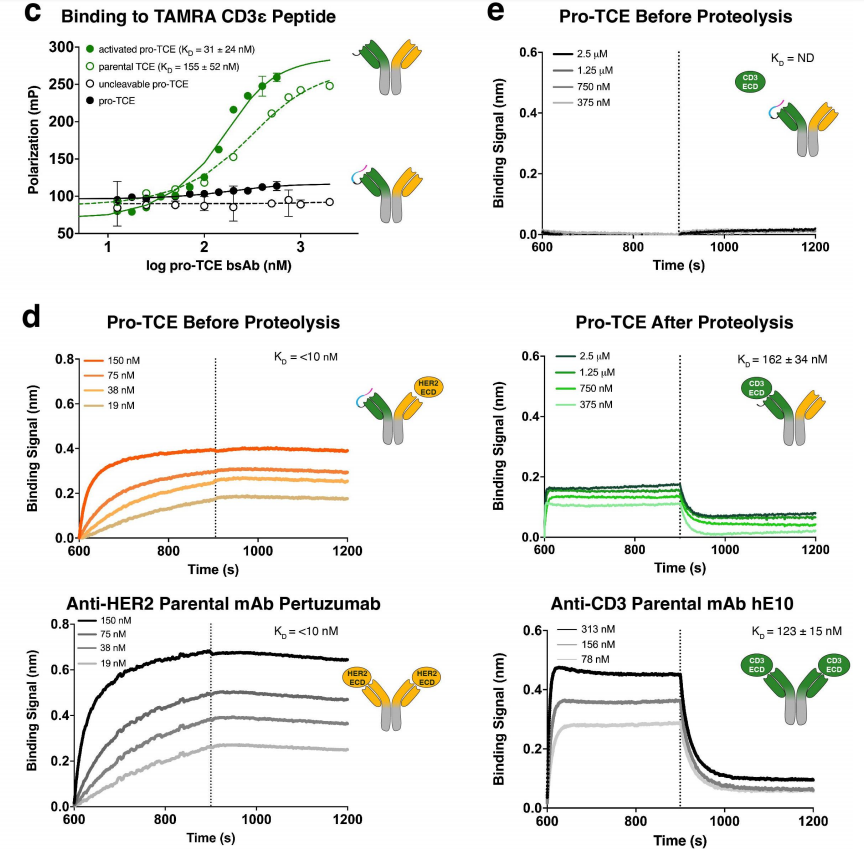
研究人员利用TAMRA-CD3ε多肽的FP检测和重组全长CD3胞外结构域(CD3γε)的生物膜干涉(BLI)技术,证实pro-TCE双特异性抗体对靶抗原CD3保持了较高的亲和力和特异性。研究人员发现活化的pro-TCE与CD3的结合动力学和亲和力与亲本抗CD3 hE10单克隆抗体相似,pro-TCE抗体与HER2的结合亲和力与亲本抗HER2抗体pertuzumab相同,并且蛋白酶处理不会干扰结合。FP和BLI数据显示,pro-TCE原型具有功能性体外结合行为,其中CD3结合在蛋白水解之前被掩盖,并通过与重组MMP-2孵育而完全恢复。
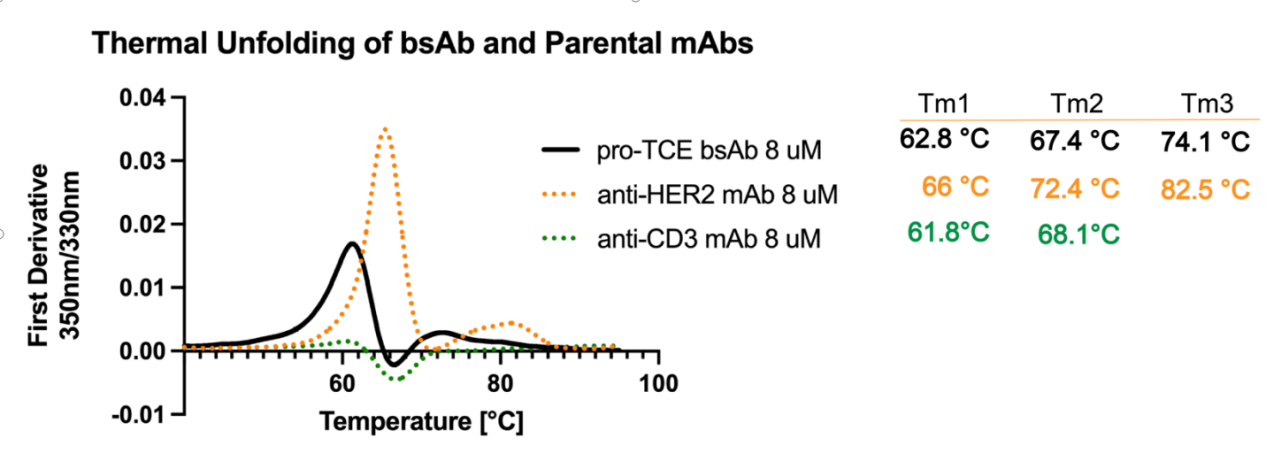
研究人员将pro-TCE的热稳定性与其亲本抗CD3和抗HER2单克隆抗体进行了比较。发现双特异性pro-TCE在生理温度以上仍保持良好折叠,并且与亲本单克隆抗体具有相当的稳定性。
pro-TCE的功能性验证
研究人员使用NFAT荧光素酶报告共培养实验评估了pro-TCE双特异性抗体激活Jurkat T细胞与HER2表达SKOV-3细胞共培养的能力,发现Pro-TCE在使用MMP-2激活后能够诱导T细胞激活和杀死靶HER2抗原的肿瘤细胞。在CRS期间,T细胞会释放大量促炎细胞因子,研究发现Pro-TCE由于存在掩蔽域,不会触发强劲的细胞因子分泌;而具有蛋白水解活性的pro-TCE会诱导细胞因子IL-2,IFN-γ 的分泌。
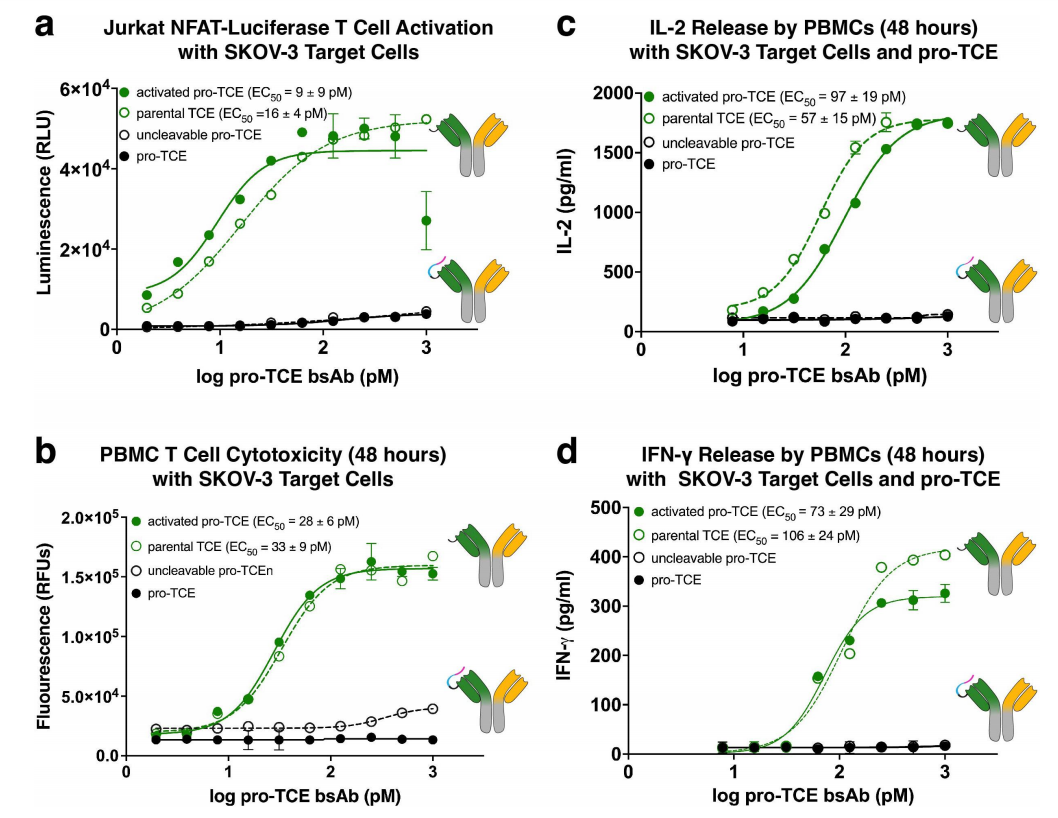
pro-TCE触发T细胞的条件激活
研究人员将pro-TCE与分泌MMP-2蛋白酶的HER2表达胃癌细胞系NCI-N87共培养,并监测 pro-TCE蛋白水解和Jurkat NFAT-荧光素酶T细胞活化,结果发现肿瘤分泌的MMP-2诱导的pro-TCE蛋白水解可以触发细胞培养中的T细胞活化。
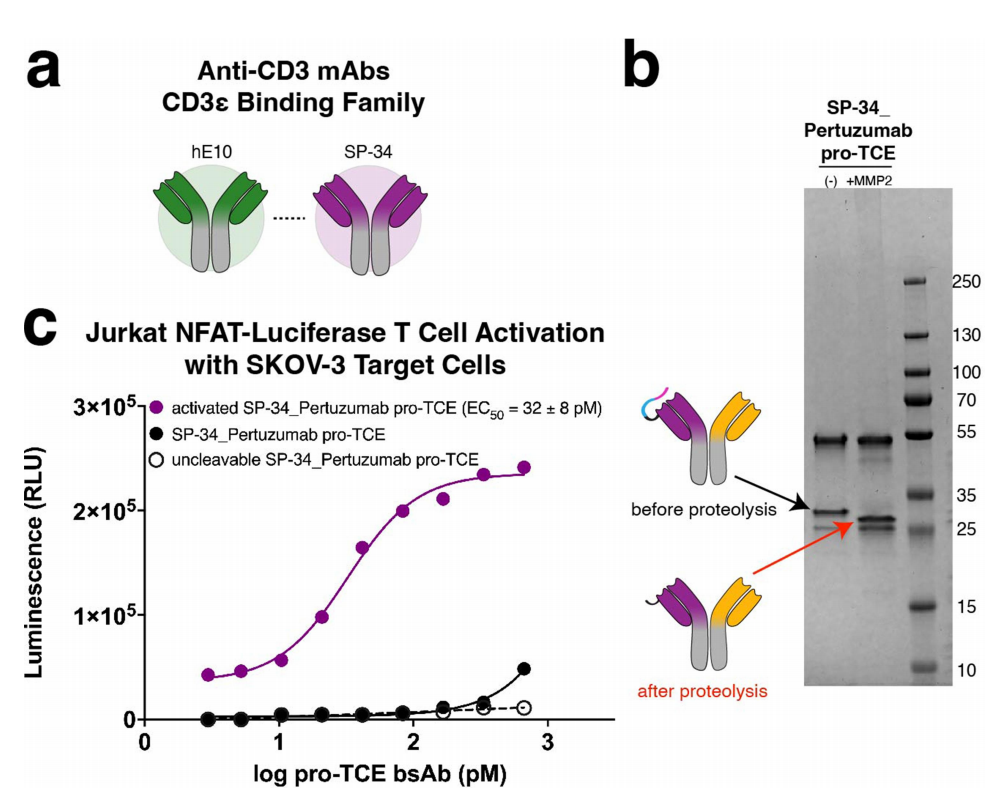
扩展pro-TCE平台
研究人员使用SP34抗体序列代替hE10制作了一种识别CD3ε的pro-TCE,其中包括替代CD3ε肽(序列PCA-DGQESM),该肽通过优化的柔性接头与抗体连接,接头中含有MMP-2蛋白酶切割位点。另一条结合臂识别HER2,其序列与源自pertuzumab的原始pro-TCE相同。使用Jurkat NFAT荧光素酶报告基因共培养试验,结果显示,在裂解之前,Jurkat T细胞在与表达HER2的 SKOV-3细胞共培养时没有被激活。MMP-2蛋白水解后,T细胞活化得以恢复,这表明抗CD3克隆hE10和SP34均可用于pro-TCE形式,因为它们结合相同的CD3ε表位。
总结
本研究开发了模块化的pro-TCE,它的设计利用了抗CD3抗体E10与CD3ε肽段的结构信息,在抗体的N端连接了CD3ε肽段作为掩蔽域,并在中间加入了MMP-2剪切位点的连接子。这种设计可以有效遮蔽抗CD3抗体的结合位点,该域能够在肿瘤丰富的基质金属蛋白酶2(MMP-2)存在下被切割,从而恢复pro-TCE与T细胞的结合并激活T细胞,而且具有对肿瘤细胞的特异性杀伤能力。展示了一种合理的工程方法,用于有条件地激活TCE双特异性抗体,旨在在肿瘤环境中引起更高的治疗反应,以减少脱靶毒性。这种屏蔽策略也适用于其他抗CD3抗体克隆,表明可广泛应用于设计更安全的TCE双特异性抗体。这项研究展示了一种开发免疫调节疗法的方法,该方法优先考虑安全性并有可能推进癌症免疫治疗策略。
