在过去十年中,每年新的基于抗体的生物制剂获批数量大量增加,在过去十年中,FDA新批准了100种新型抗体,比之前批准的抗体总数增一倍多。
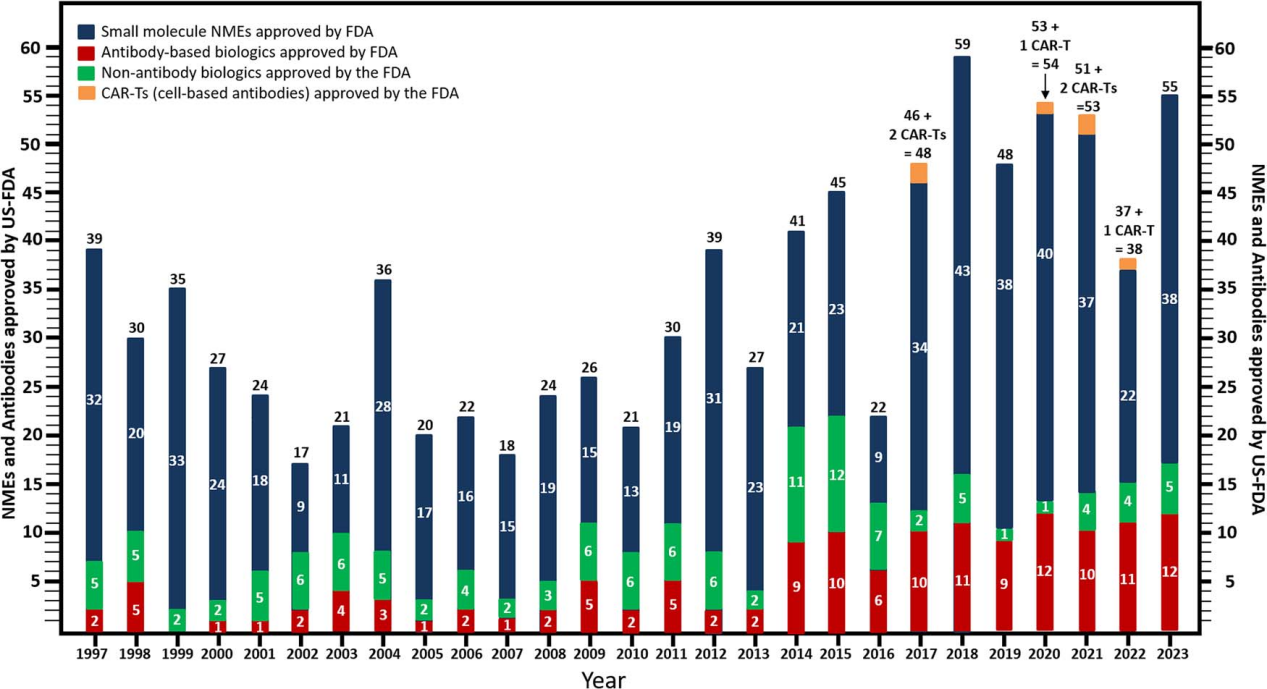
2023年美国FDA批准了12个治疗性抗体,其中8种是相对标准的IgG抗体,3种是二价的双特异性抗体,1是种三价双特异性抗体,2024年3月19日,WilliamR.Strohl在Antibody Therapeutics发表了一篇名为“Structure and function of therapeutic antibodies
approved by the US FDA in 2023”的文章,分析了2023年美国FDA批准的治疗性抗体的结构和功能。对这些新型抗体的批准情况进行了详细描述,为进一步研究和开发治疗性抗体提供了重要参考。

FDA批准的12种抗体结构特征概述
在2023年美国FAD批准的12种抗体中,他们的结构也有所不同。3种是典型的的IgG1κ抗体,其中一种结合了YTE长半衰期技术;5种铰链稳定的IgG4κ抗体,其中1种是FC沉默的;1种抗体为异二聚体IgG2κ的二价双特异性抗体;2种抗体是异二聚体二价双特异性抗体,包含κ和λ轻链;还有1种是采用罗氏CrossMab技术的三价异二聚体双特异性抗体。
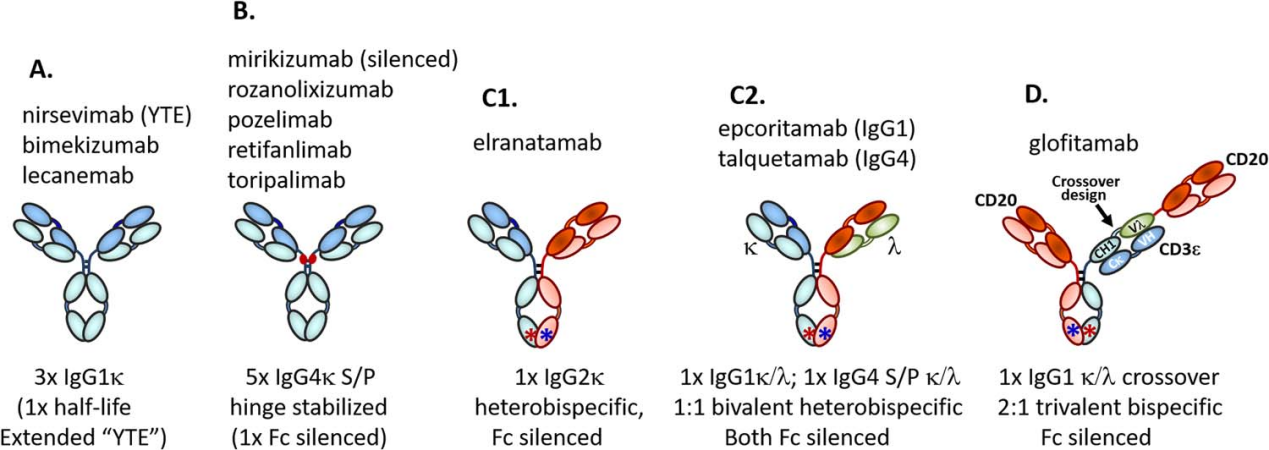
获批的这些抗体主要针对各种适应症,如阿尔茨海默病、多发性骨髓瘤、溃疡性结肠炎、牛皮癣和婴儿呼吸道合胞病毒。
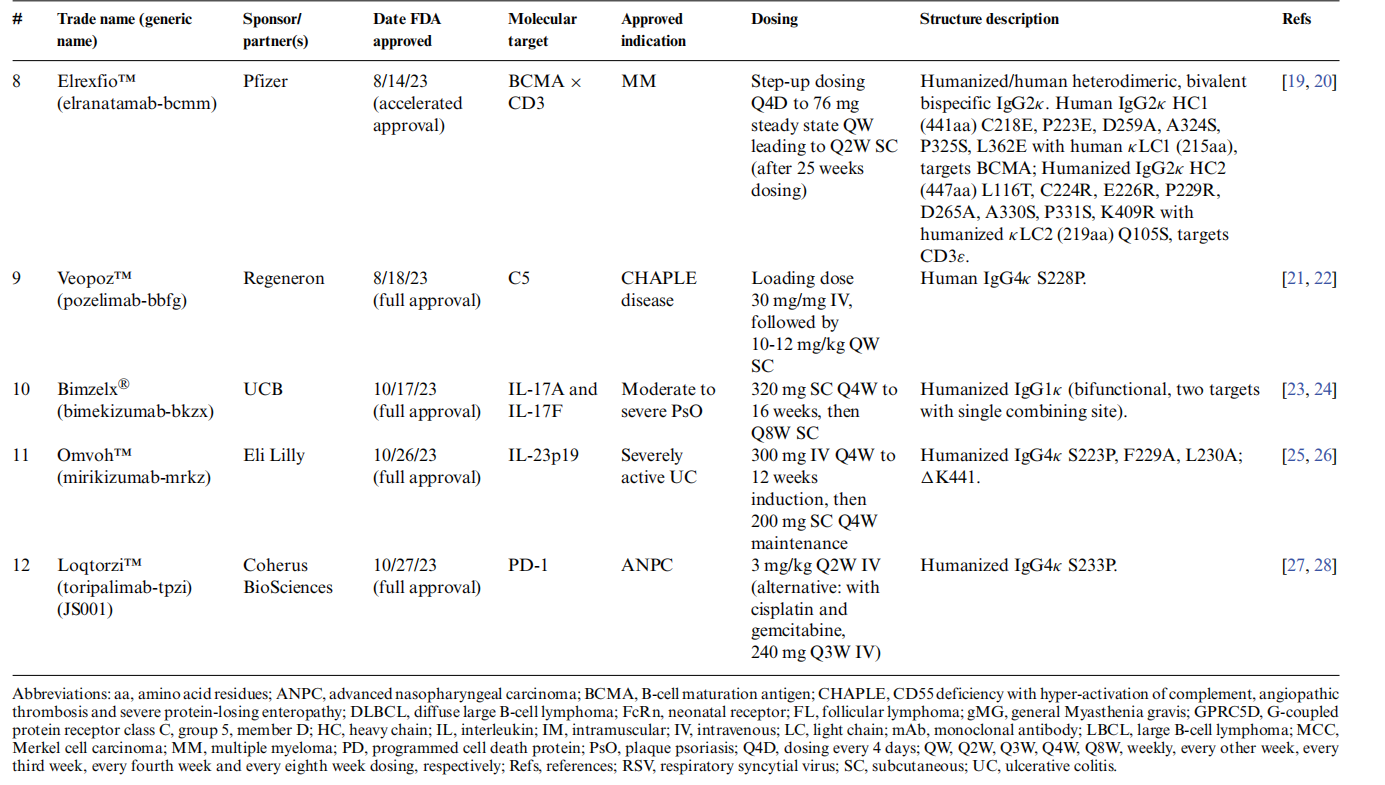
lecanemab-irmb (Leqembi®)
AD是最常见的痴呆形式,导致进行性认知和行为障碍,关于于AD发病机制的最流行的解释之一是“淀粉样蛋白假说”,其可以概括为淀粉样蛋白-β(Aβ)肽(Aβ40和Aβ42)的积累形成神经毒性老年斑,进而促进tau病理的发展,两者共同导致神经元细胞死亡和神经性退行性变。

(数据来源 Shajahan SR, et al. Front Aging Neurosci. 2024)
美国FDA批准用于治疗AD的首个抗体是Aduhelm(aducanumab),于2021年6月7日获批。关于AD治疗的抗体已经有2个抗体获得了美国FDA的批准,还有其他的抗体正在临床实验中。
lecanemab-irmb(Leqembi®)是2023年美国FAD批准的首个新型抗体,它是第二个获得美国FAD批准用于治疗AD靶向淀粉样蛋白-β(Aβ)途径的抗体,今年1月,Leqembi基于二期实验的生物标志数据获得了FAD的加速批准。
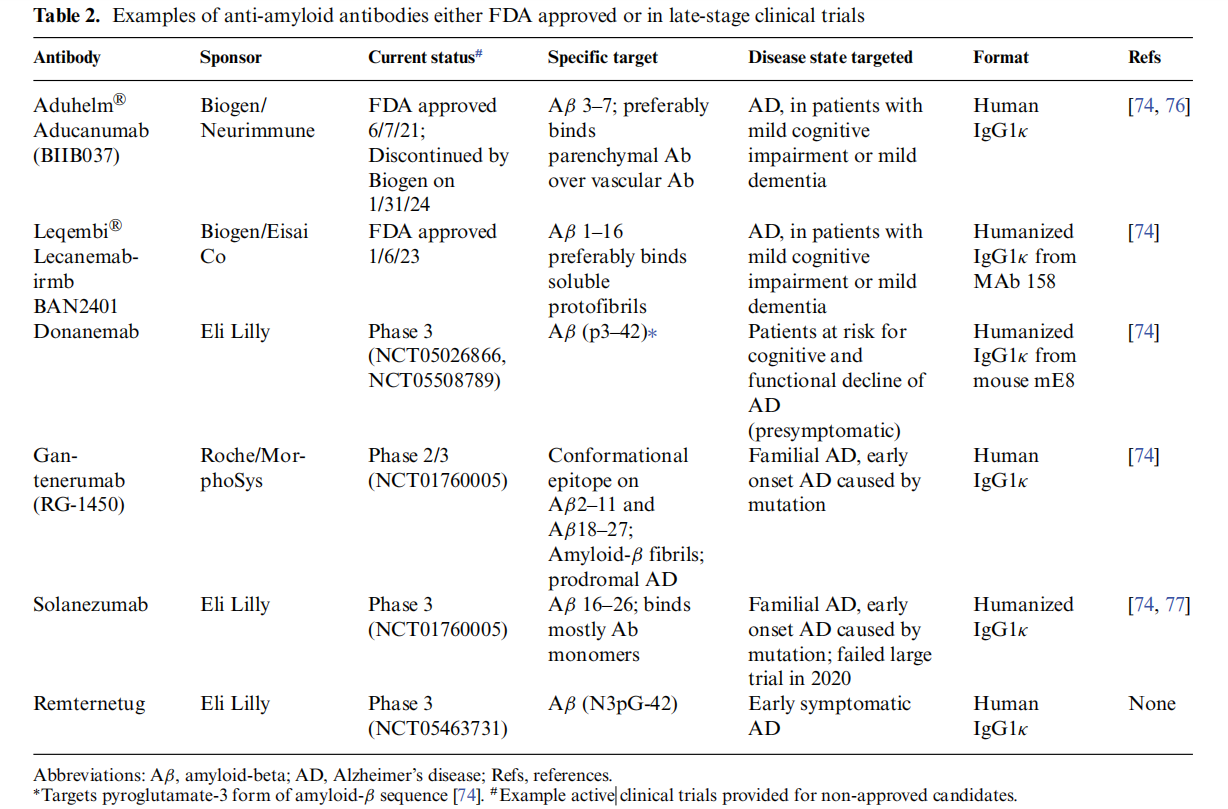
Leqembi是一种源于Mab158的人源化IgG1κ抗体,该抗体靶向Aβ42的残基1-15;它优先结合Aβ的有毒形式,包括Aβ低聚物和可溶性Aβ原纤维。Aduhelm靶向Ab的残基3-7,并倾向于结合更复杂的Aβ斑块,导致斑块体积减少。Lecanemab结合这些有毒低聚物和原原纤维的能力是其与Aβ原纤维和现有斑块结合能力的10-15倍,比Aβ单体结合能力强100倍。这与主要结合单体的solanezumab,以及更倾向于结合斑块和成熟原纤维的aducanumab和gantenerumab不同。可以看出抗体成功的关键与抗体结合的Aβ实际表位和抗体在体内结合的致病性Aβ形式有关。

Leqembi主要用于治疗轻度认知障碍或轻度痴呆患者,且在18个月的治疗过程中,Leqembi治疗组在ADAS-Cog14评分系统中表现出了47%的临床下降减缓,同时还显示出减少脑部淀粉样蛋白负担以及减缓tau病理发展速度的效果。
Epkinly™(epcoritamab-bysp)和Columvi™(glofitamab-gxbm)
非霍奇金淋巴瘤(NHL)是一种淋巴系统的恶性疾病,可以是惰性的,或进展缓慢的,或侵袭的,弥漫性大B细胞淋巴瘤(DLBCL)是一种侵袭性的NHL。
美国FDA于2023年批准了两种新的抗CD20抗体,epcoritamab和glofitamab,除此之外还有一些抗体正在临床实验中。
Epkinly™(epcoritamab-bysp)是一种不对称二价双特异性,FC沉默的人/嵌合IgG1κ/λ的抗体药物,它可以在同型二聚体配对中驱动正二聚体Fc的形成,在该抗体中,轻链配对问题通过使用Duobody技术控制Fab臂交换过程来解决,亲本抗体CD20和CD3ε分别被氧化,两种抗体混合然后还原,在CD3ε测发生生CH3(F413L)突变,CD20测发生K414R突变,通过亲本IgG重组驱动异源Fc形成。Epkinly™的剂量通过皮下途径给药,具有较长的半衰期和较低的抗药性反应率,这使得其在治疗方面具有一定的优势。
Columvi™(glofitamab-gxbm),也称为RG6026,是1种基于IgG1κ/λ的三价双特异性抗体,具有2个靶向CD20的结合位点,和一个靶向CD3ε的结合位点。用于治疗复发或难治性弥漫大B细胞淋巴瘤,并且在临床试验中表现出良好的总体反应率和持续完全缓解率。
Zynyz®(Retifanlimab)和Loqtorzi™(toripalimab)
PD-1是一种存在于活化的T淋巴细胞和B淋巴细胞的检查点受体,它通常与表达在抗原呈递细胞和肿瘤细胞上的PD-L1受体结合。一般正常情况下,PD-1通过抑制炎症T细胞活性来抑制免疫反应,帮助预防自身免疫反应。但是许多形式的癌症会过度表达PD-L1来利用PD-1/PD-L1调节轴,阻止T细胞杀死癌细胞。

(数据来源 Zhang K, Kong X, Li Y, Wang Z, Zhang L, Xuan L.Front Pharmacol. 2022)
Retifanlimab(Zynyz®)和toripalimab(Loqtorzi™)是美国FDA批准的第五种和第六种抗PD-1抑制剂单抗。他们都是铰链稳定的(S/P;56)IgG4κ同型抗体,这是目前抗PD-1抗体首选的IgG格式。
Retifanlimab(Zynyz®)与PD-1受体结合,阻断其配体PD-L1和PD-L2的相互作用,从而增强T细胞活性。基于POD1UM-201试验(NCT03599713)的结果,它被加速批准用于治疗转移性或复发性的MCC,它是一种罕见的侵袭性神经内分泌皮肤癌。
Toripalimab(Loqtorzi™)也是与PD-1受体结合。阻断其与PD-L1,PD-L2的相互作用,从而释放PD-1通路介导的T细胞激活抑制,toripalimab具有异常长的重链互补决定区-3(CDR-H3),在FG环中以不依赖于PD-1糖基化的方式结合。它主要用于治疗转移性或复发性局部晚期NPC。
Bimzelx®(Bimekizumab)
斑块型银屑病(PsO)是一种相对常见的皮肤慢性自身免疫性疾病,约2-5%的成年人患有此病, 其中约20%为中度至重度。
IL-17促炎细胞因子家族有6个结构相关的成员,IL-17A、IL-17B、IL-17C、IL-17D、IL-17E(又名IL-25)和IL-17F,它们在抵抗感染,特别是真菌感染中发挥重要作用。IL-17A主要由TH17 T细胞产生,而IL-17F由T细胞,先天免疫细胞和皮胞产生。IL-17A和IL-17F之间可以形成同型二聚体,也可以形成IL-17AF异源二聚体。
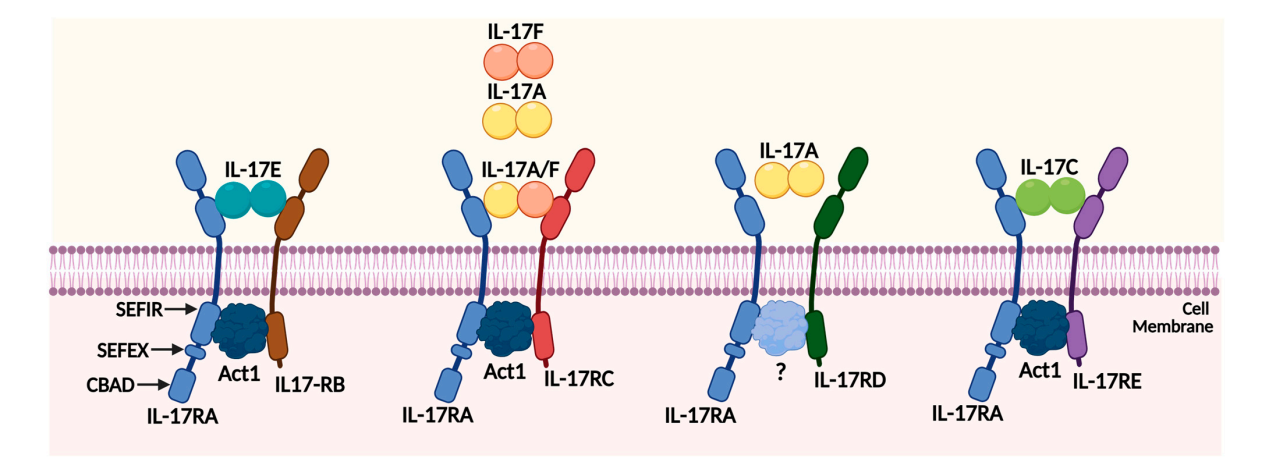
(数据来源 Chen Z, Qiao S, Yang L, Sun M, Li B, Lu A, Li F. Int J Mol Sci. 2023.)
Bimekizumab(Bimzelx®)是一种IgG1κ抗体,具有双重功能,可以结合IL-17A和IL-17F两种相关的细胞因子,使用相同的结合位点,因此具有双重特异性而非双特异性。
Omvoh™(Mirikizumab-mrkz)
溃疡性结肠炎是一种慢性,自身免疫相关的炎症性肠病,可导致消化道炎症和溃疡形成。IL-23是IL-12四螺旋束细胞因子家族的成员,是一种异二聚体细胞因子。由一种与IL-12p40结合的新型p19亚基组成,其作用是促进T辅助型17(TH17)细胞的扩增。IL-23结合由其同源IL-23R亚基和IL-12Rβ1组成的异二聚体受体,后者也与IL-12共享。研究表明,通过药物抑制IL-23p19可改善肠道炎症,阻断IL-23已被证明对自身免疫性疾病如PsO、炎症性肠病和类风湿性关节炎 有治疗作用。

(数据来源 Boehncke WH, et al. Expert Rev Clin Immunol. 2021)
Mirikizumab-mrkz(Omvoh™)是一种人源化的,FC沉默的IgG4单抗,它靶向IL-23p19亚基,不结合IL-12。它被FDA批准用于治疗中度至重度活动性溃疡性结肠炎(SA-UC)。
Elrexfio™(elranatamab-bcmm)和Talvey™(talquetamab-tgvs)
多发性骨髓瘤(MM)是一种B细胞恶性肿瘤,发病率呈上升趋势,由骨髓浆细胞不受控制的扩增引起。
自2015年获批以来,抗体CD38的抗体daratumumab(Darzalex®)一直是MM抗体治疗的标准药物,但是由于许多患者对其产生耐药性,并且daratumumab会导致健康NK细胞和T细胞互相残杀。新的靶点BCMA、CD33和GPRC5D陆续出现,2023年,两种新的双特异性TCE抗体被FDA批准用于治疗MM,Elrexfio™(elranatamab-bcmm),BCMA TCA × CD3ε和Talvey™(talquetamab-tgvs),GPRC5D × CD3ε TCE。
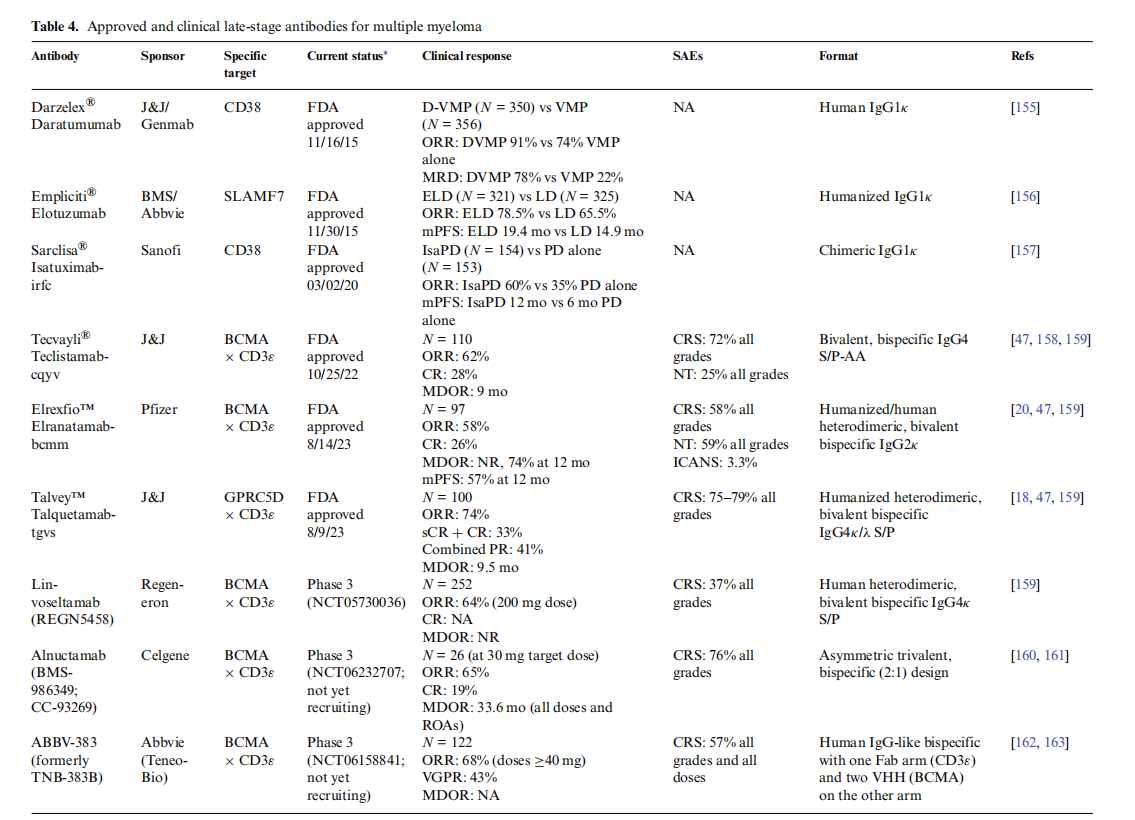
Elrexfio™(elranatamab-bcmm)是一种人源化的,FC沉默的基于IgG2κ的双特异性抗体,它由2种“亲本”抗体衍生而来,一种是抗BCMA单抗,一种是抗CD3ε单抗。他们的FC部分CH3结构域发生突变,促进异二聚化而非同二聚化,促使两个FC的形成具有异特异性。轻链的特异性由2个补偿性突变处理,CD3ε结合部分的CH1和CL各有一个突变。FC发生突变会抑制抗体结合FC受体和补体的能力。
Talvey™(talquetamab-tgvs)是一种IgG4κ/λ,S/P铰链稳定二价双特异性TCE抗体,使用Dubody控制的Fab交换过程产生的。它的其中一个Fab臂与T细胞表面表达的CD3ε受体结合,另一个Fab臂与MM细胞和非恶性浆细胞以及健康组织(如皮肤和舌角化组织的上皮细胞)表面表达的GPRC5D结合。
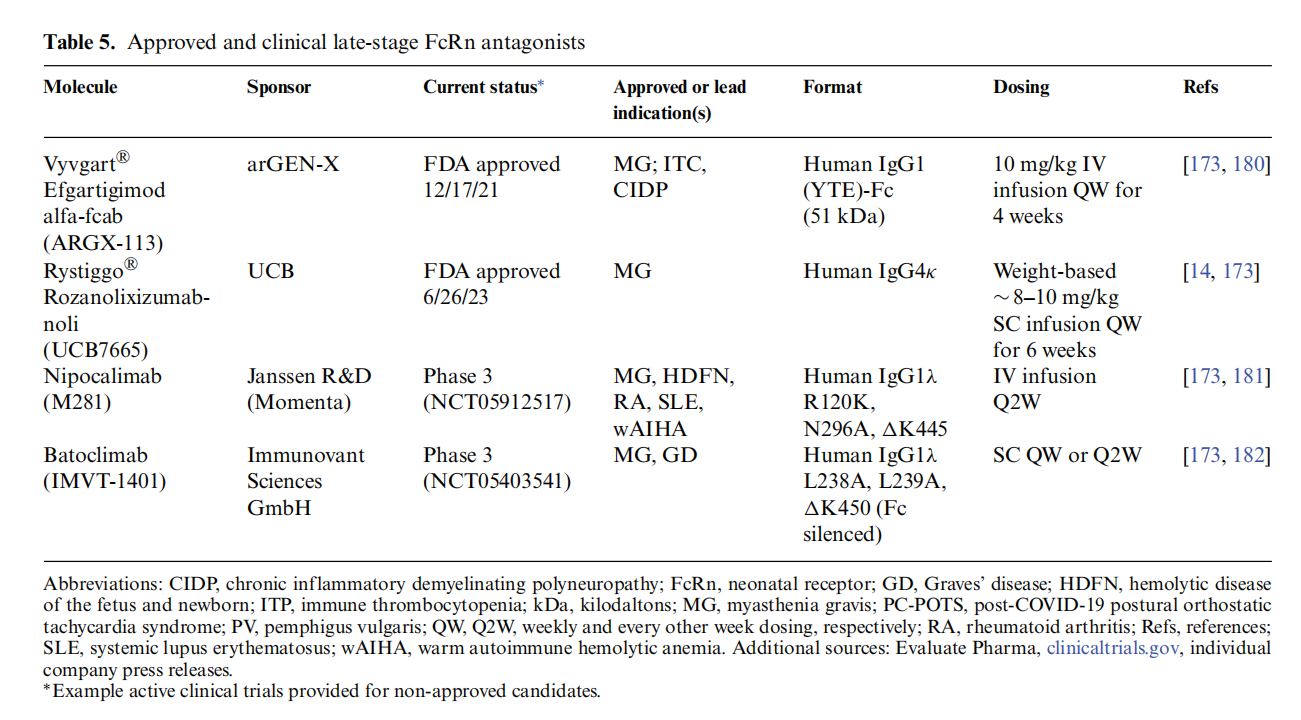
Rystiggo®(rozanoliizumab - noli)
自身免疫性疾病的特征是存在针对特定人类(自身)蛋白质的自身抗体。这些抗体介导的自身免疫性疾病包括全身性重症肌无力(gMG)。
FcRn维持内源IgG的稳态,显著延长IgG的半衰期。这是通过在酸性pH下FcRn胞饮结合IgG来实现的,保护其免受溶酶体降解途径的影响,然后将结合的IgG转运回细胞表面,从而在中性pH下将其胞吐回循环。
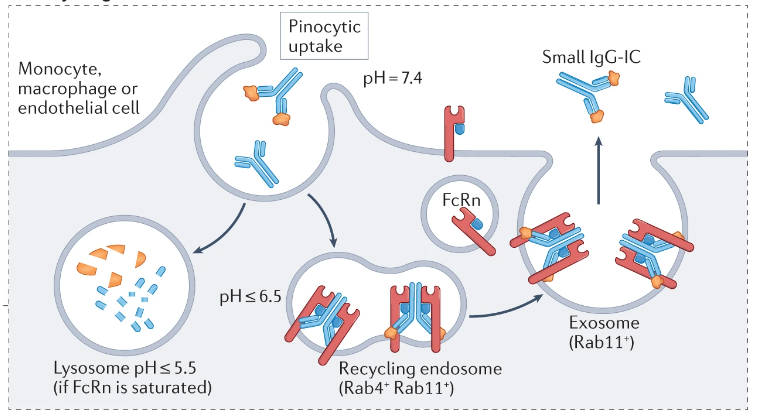
(数据来源 Pyzik M, et al. Nat Rev Immunol. 2023)
由于FcRn是IgG回收受体,无论是该受体的拮抗作用,还是对该受体的压倒性竞争,都会降低其回收血清IgG(包括致病性IgG)的能力。
Rozanolixizumab-noli(Rystiggo®),是一种IgG4κ,FcRn受体阻断抗体,已获得美国FDA批准,治疗具有AChR或肌肉特异性酪氨酸激酶(MuSK)自身抗体的成人gMG。 Rozanolixizumab及其Fab片段在pH 6.0和pH 7.4下均以高亲和力与人FcRn的α亚基结合,并与与受体结合的IgG直接竞争。Rozanolixizumab被证明可在体外抑制IgG循环。除了Rozanolixizumab以外还有其他的已经获得批准批准或者在临床实验中FcRn拮抗剂。
Veopoz™(Pozelimab-bbfg)
补体系统是一种快速作用的蛋白质-蛋白质相互作用级联,在对无菌和感染性免疫损伤的先天免疫反应中发挥着重要作用。补体级联可以通过三种不同的途径激活,即经典途径、旁路途径和凝集素途径。所有这三个途径均汇聚于末端补体途径,该途径由C5转化酶(C4bC2aC3b)将补体因子C5裂解为C5a和C5b启动。一旦形成,C5b就成为一个构件,招募C6、C7、C8和C9,形成膜攻击复合体(MAC)。

(数据来源Girardi G, Lingo JJ, Fleming SD, Regal JF. Front Immunol. 2020)
Pozelimab-bbfg(Veopoz™)是一种针对末端补体蛋白C5的人类铰链稳定IgG4k抗体,可通过与补体因子C5结合,阻断C5裂解为C5a(过敏毒素)和C5b来抑制末端补体激活,从而阻断膜攻击复合物的形成。它被美国FDA完全批准用于治疗成人和一岁以上儿童CHAPLE病患者,Veopoz™是美国首个批准用于治疗CHAPLE病的药物。
Beyfortus™(nirsevimab-alip)
呼吸道合胞病毒(RSV)是一种常见的季节性呼吸道病毒,是下呼吸道感染的最常见原因之一。 RSV是幼儿呼吸道疾病的主要病因,全球发病率为9.5%,死亡率为2.2%。

(数据来源 De Moerlooze L. Vaccines(Basel).2023)
Nirsevimab-alip (Beyfortus®)是一种的 IgG1κ型抗体,它含有YTE突变(M252Y/S254T/T256E),通过调节pH依赖性结合到新生儿受体(FcRn)来增加循环半衰期,Nirsevimab在婴儿中的终末半衰期为71天,是典型治疗性抗体体内半衰期的三倍多。这使得它可以在RSV季节开始时施用一次,并在整个季节持续有效。 Nirsevimab通过抑制病毒和细胞膜融合所需的F蛋白构象变化来中和RSV,从而阻止病毒进入。
小结
2023年美国FDA批准的这12种抗体,对于改善多种疾病的治疗具有重要意义,这些抗体的批准也反映了抗体治疗领域的快速发展。
