gasdermin(GSDM)家族成员广泛表达并可能发挥组织特异性作用,15年来,科学家们一直在尝试确定GSDM家族成员的结构和功能,迄今已取得一些进展:多个证据表明GSDM家族在生物和病理过程中扮演着不同的角色,包括细胞分化、细胞增殖、细胞死亡、线粒体稳态、抗微生物、炎症和肿瘤发生。近年来,这GSDM家族成员在促进细胞焦亡中的直接作用也得到了深入研究,引起了研究人员的极大兴趣。
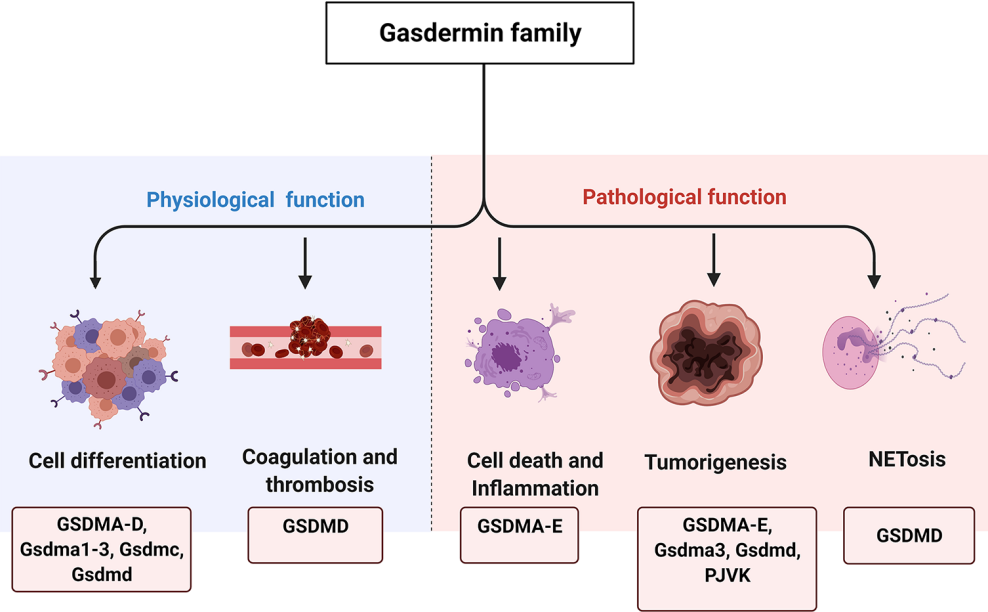
(数据来源Molina L, et al. Semin Liver Dis. 2022)
GSDM家族蛋白:
人类和小鼠基因组分别编码GSDM家族蛋白的6个(GSDMA、GSDMB、GSDMC、GSDMD、GSDME、DFNB59)和10个(GSDMA1、GSDMA2、GSDMA3、GSDMC、GSDMC2、GSDMC3、GSDMC4、GSDMD、GSDME、DFNB59)家族成员。
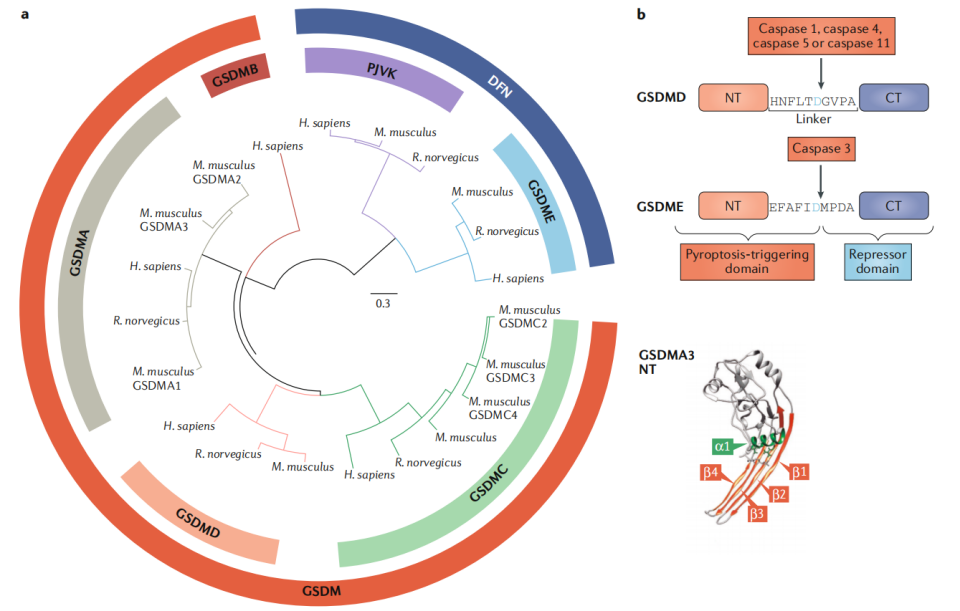
(数据来源Broz P, et al. Nat Rev Immunol. 2020)
GSDM功能机制:
GSDM家族的所有成员(DFNB59除外)包含一个细胞毒性N末端结构域和一个由灵活接头连接的C末端阻遏物结构域,对两个结构域之间的蛋白切割位点可由半胱天冬酶(Caspase)酶切加工释放对细胞毒性N端结构域的分子内抑制,使GSDM蛋白的N端结构域能够插入细胞膜并形成大的寡聚孔,从而破坏离子稳态并诱导细胞死亡。
(数据来源Wang K, et al. Cell. 2020)
而GSDM活性在多个水平上受调节,以防止自发孔形成并控制细胞表面孔的丰度。这些机制包括自身抑制结构、促进(或阻止)孔隙组装的蛋白水解切割事件、调节脂质结合和寡聚化的翻译后修饰,以及通过膜修复机制去除孔隙。
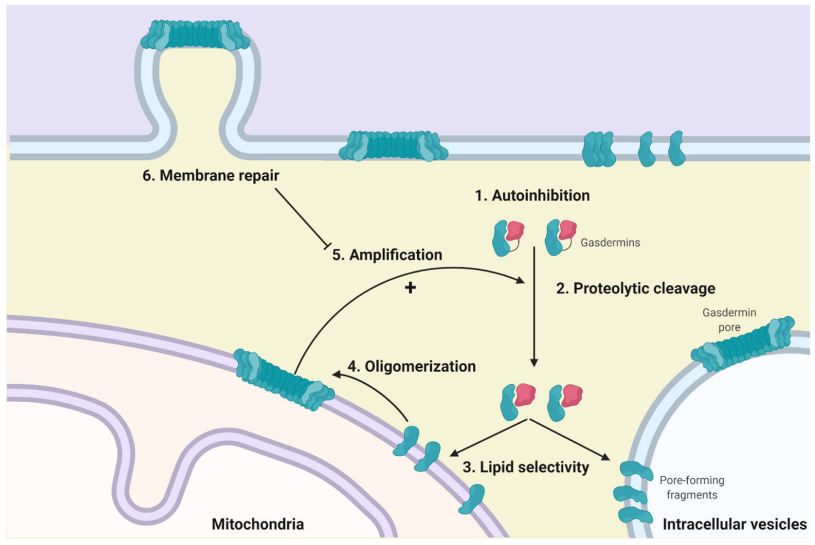
(数据来源Cao A, et al. J Mol Biol. 2022)
GSDMD蛋白:
在GSMD家族成员中,备受关注的便是GSDMD,作为第一个确定的细胞焦亡执行者,它作用于炎症半胱天冬酶(Caspase)的下游以响应细胞炎症调控。GSDMD的转录可能受到多种分子的调控:a.NF-κB激活在脂肪细胞中促进GSDMD的转录;b.DNMT (DNA甲基转移酶)介导的启动子区域的高甲基化导致NK92细胞中GSDMD的表达降低;c.在内皮细胞或巨噬细胞中,通过激活IRF1和IRF2, GSDMD的表达显著增强。
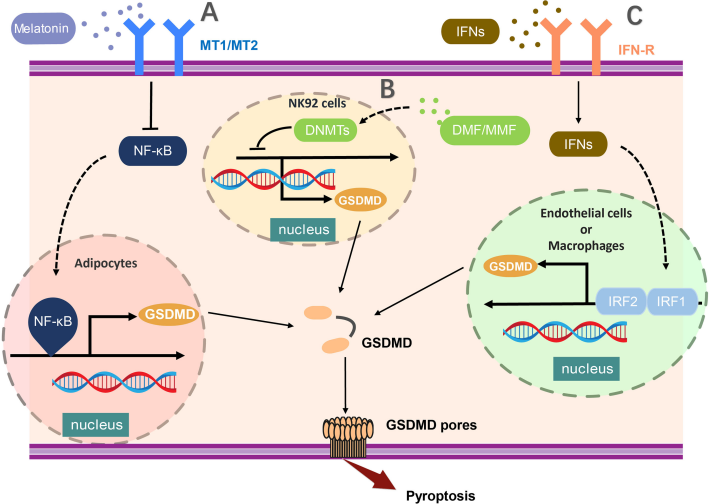
(数据来源Li Z, et al. Front Immunol. 2022)
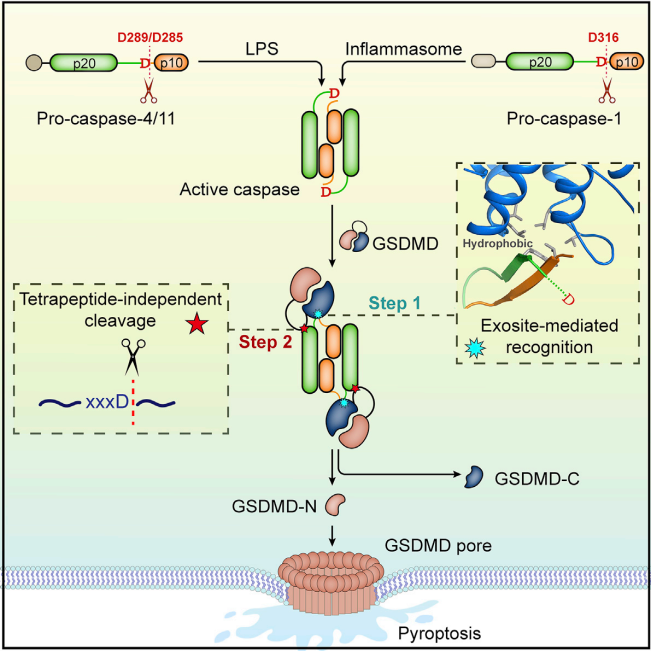
在典型的炎性体诱导的细胞焦亡过程中,GSDMD被活化的Caspase-1蛋白水解切割,产生具有膜孔形成能力的活性片段,从而允许通过非常规蛋白质分泌释放IL-1β和IL-18;非典型的炎性体通路则导致人类Caspase-4/5和小鼠Caspase-11的激活,GSDMD孔隙允许钾释放,导致NLRP3炎症小体的激活和IL-1β/IL-18成熟,进而GSDMD孔引起焦亡,推动成熟细胞因子的释放。
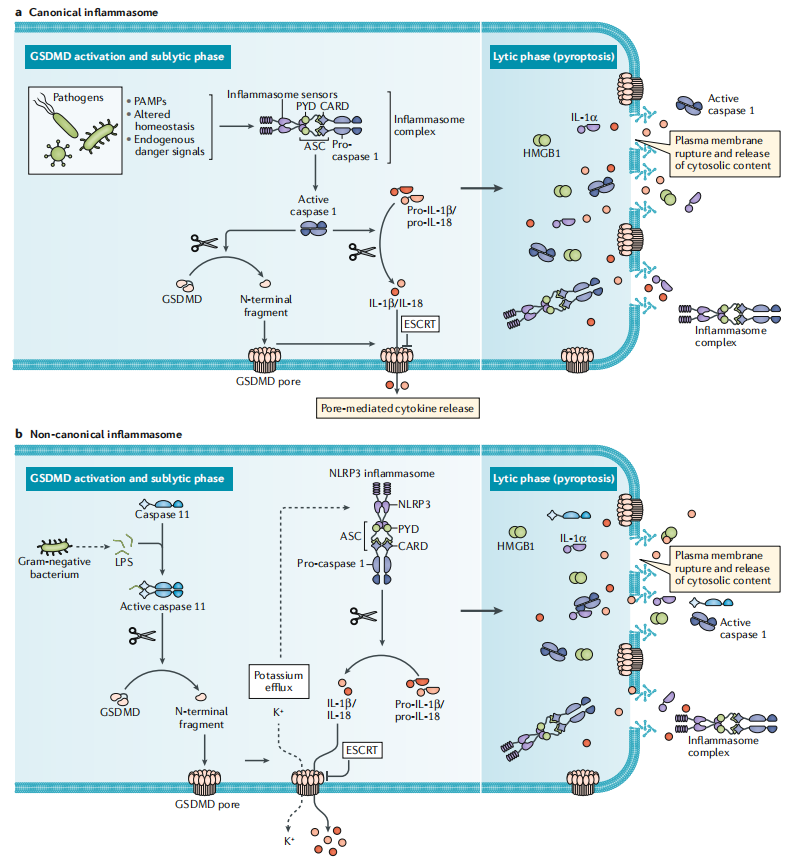
(数据来源Broz P, et al. Nat Rev Immunol. 2020)
目前大量报道揭示GSDMD在自身免疫性疾病或炎症性疾病中发挥关键功能。

GSDMD作为炎性体的共同协同效应物,通过禁止GSDMD的裂解或寡聚化来阻断GSDMD的某些小分子已被证明对多种疾病有效。到目前为止,GSDMD抑制剂(如NAS、DMF和双硫仑)也影响GSDMD的上游信号,如NF-κB、Caspase-1被修饰的反应性半胱氨酸共价切割。深入了解GSDMD的细胞焦亡调节机制和执行功能,不仅可以扩展我们现有的知识,还可以开发新型和更特异的抑制剂。
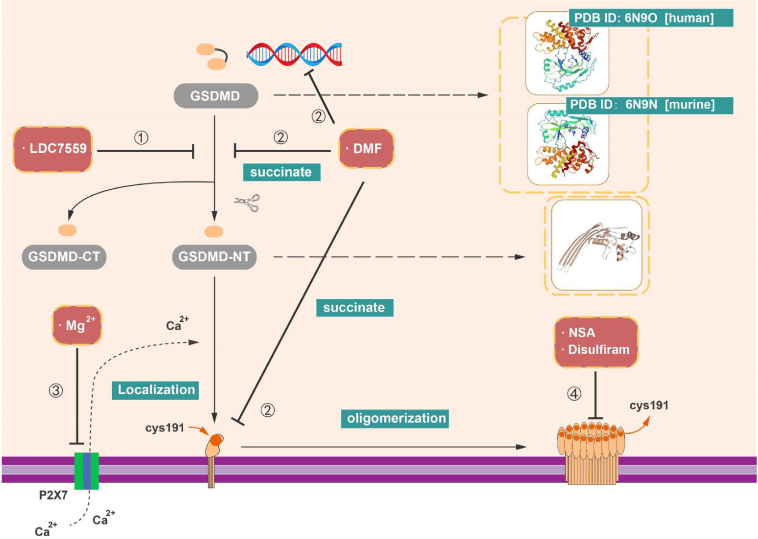
(数据来源Li Z, et al. Front Immunol. 2022)
小结:
作为GSDM家族中的明星成员,GSDMD的调控机制研究取得了很大进展,但在不同细胞类型或疾病中GSDMD激活的独特模式仍需要进一步探索。尽管已经鉴定出多种GSDMD抑制剂,但临床转化仍需要更具选择性和耐受性的抑制剂。GSDMD正在成为多种疾病中非常有吸引力的检查点,它为针对GSDMD相关疾病的机体进行治疗干预打开了新窗口。
武汉迈思生物研发团队拥有十多年重组蛋白和重组抗体研发经验,聚焦于真核哺乳细胞重组蛋白表达和单B细胞重组兔单抗开发,提供更简单、更高效的重组蛋白和重组抗体产品及开发服务。目前推出GSDM相关蛋白产品涵盖人源、鼠源GSDMD,人源GSDMB、GSDMC。
更多服务及产品内容欢迎咨询了解。咨询电话:15387173921(微信同号)。
