蛋白-小分子互作在药物开发中扮演着至关重要的角色,它们是药物作用机制的核心。随着药物化学和分子生物学的发展,研究小分子药物与蛋白质相互作用的实验技术日益增多,为药物设计、药物筛选和药物作用机制的理解提供了强有力的工具。本文将概述几种主要的蛋白-小分子互作研究方法,包括生物层表面干涉技术(BLI)、微量热泳动技术(MST)、小分子-蛋白质Pull-down技术、表药物亲和反应靶向稳定性(DARTS)、细胞热迁移技术(CETSA)和荧光偏振免疫分析法(FPIA)。每种技术都有其独特的优势和应用场景,选择合适的实验方法对于揭示药物与蛋白质之间的相互作用至关重要。

生物层表面干涉技术(BLI)
生物膜干涉测量法是一种光学无标记技术,用于实时监测生物分子间的相互作用,提供结合动力学和亲和力等数据。当可见光穿过生物膜层时,会在膜的两个界面反射形成干涉波。固定在生物传感器上的配体与分析溶液中的分子相互作用,导致生物膜层厚度增加,干涉光谱曲线向长波长移动,同时光波相位变化。通过监测这种相位变化,可以精确测定分子间的相互作用,并计算亲和力(KD)、结合速率(ka)和解离速率(kd)。BLI是研究蛋白质、抗体、核酸、多糖、脂类、小分子药物、病毒、细菌、细胞等生物分子间相互作用的强大工具。

(数据来源 RJi Y, et al. Adv Exp Med Biol. 2018)
微量热泳动技术(MST)
微量热泳动技术(MST)是一种新兴的生物分子相互作用分析技术,它通过监测生物分子在温度梯度中的迁移率变化来研究分子间的结合和解离过程,从而获得分子间相互作用的详细信息。MST技术在生命科学领域,如药物筛选、信号传导、分子检测和医疗诊断等方面有着广泛的应用。
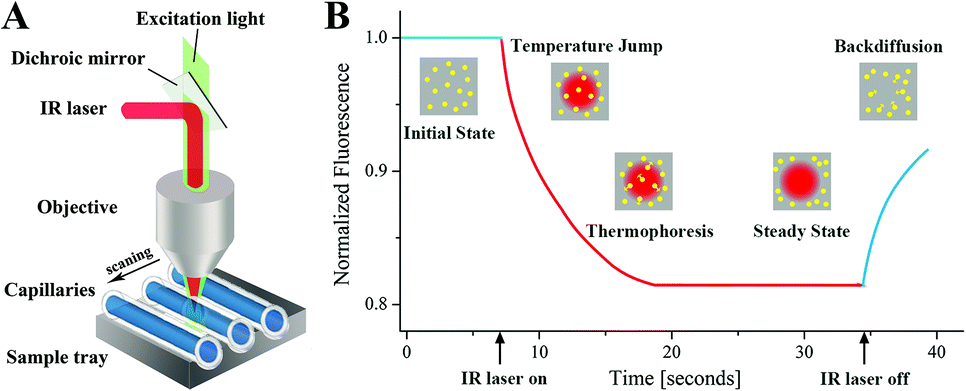
(数据来源 Liu Y, et al. Analyst. 2015)
小分子-蛋白质Pull-down技术
小分子-蛋白质Pull-down技术是通过化学修饰小分子化合物,例如生物素(Biotin)标记,可以利用亲和层析技术从细胞或组织中提取的蛋白质混合物中筛选出与小分子相互作用的蛋白质。随后,利用质谱技术对这些蛋白质进行鉴定和筛选,以识别小分子的特定结合伴侣。

(数据来源 Smith RJ, et al. STAR Protoc. 2023)
细胞热迁移技术(CETSA)
细胞热迁移技术(CETSA)是一种被用于评估细胞和组织内药物与靶蛋白结合效率的实验。当靶蛋白与小分子药物结合时,这种结合往往能增强蛋白质的热稳定性。在温度逐渐升高的过程中,未结合药物的蛋白质会逐渐降解,而结合药物的蛋白质则因为药物的保护作用而保持完整。因此,结合药物后的蛋白质在热熔曲线中表现出更高的稳定性,其曲线向更高的温度方向移动(右移)。检测方法主要有免疫印迹和蛋白质谱。
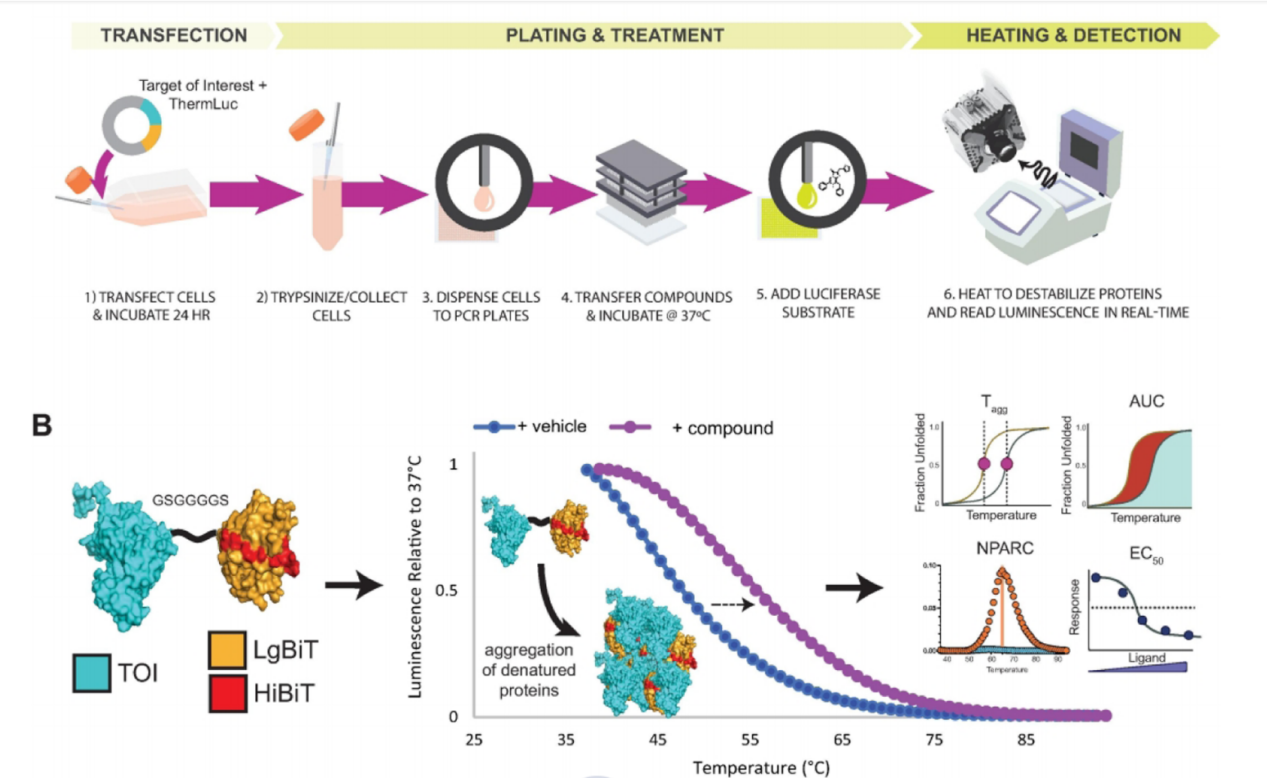
(数据来源 Sanchez TW, et al. ACS Chem Biol. 2022)
荧光偏振免疫分析技术(FPIA)
利用荧光偏振分析法(Fluorescence Polarization Immunoassay,FPIA),可以高效且精确地测定小分子药物与特定靶蛋白之间的相互作用。当小分子药物与靶蛋白结合后,其标记的荧光分子在溶液中的运动速度会减慢,这种变化会导致荧光偏振度发生显著变化。通过监测这种荧光信号的变化,FPIA能够快速地检测小分子与蛋白质的结合情况。
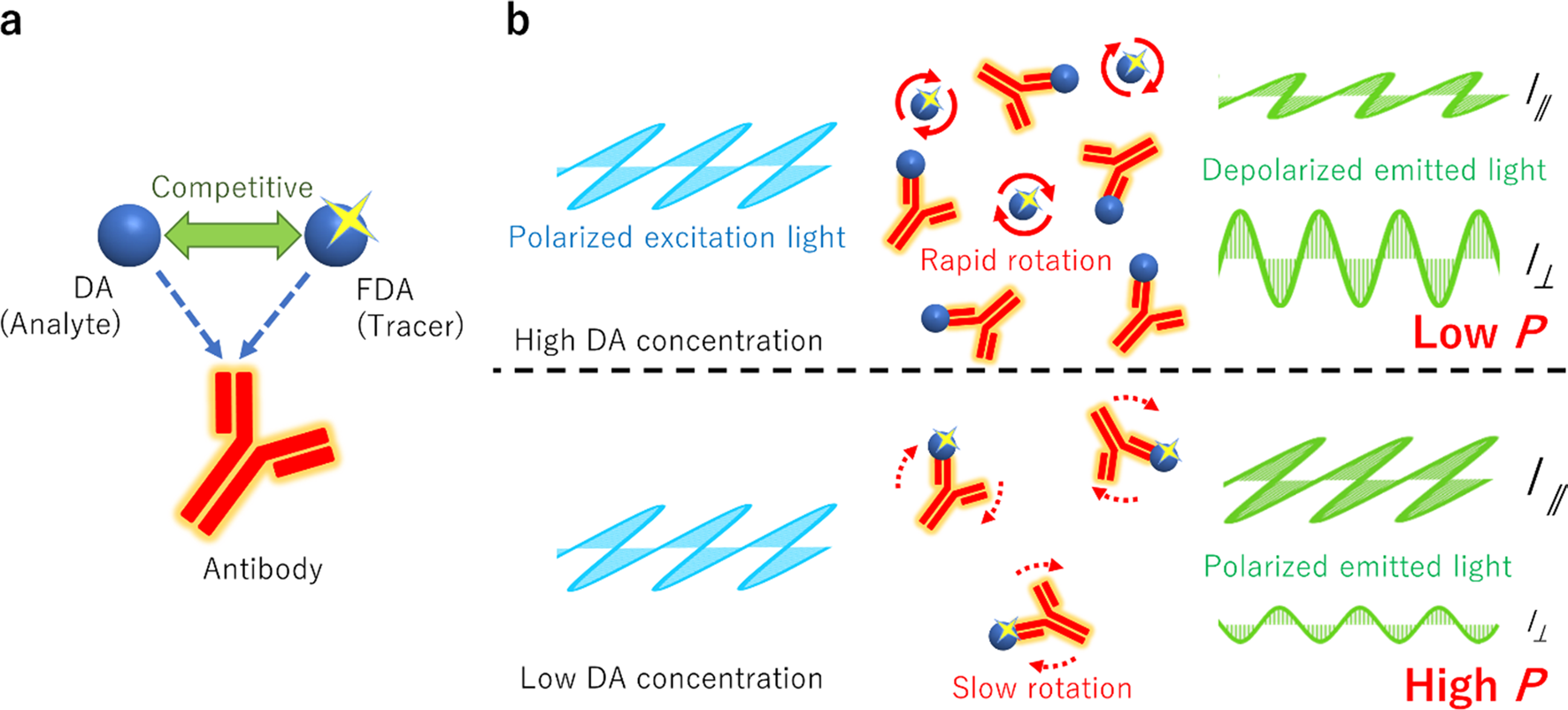
(数据来源 Liu YOgura Y, et al. Anal Sci. 2023)
药物亲和反应靶向稳定性DARTS
药物亲和反应靶标稳定性(DARTS)是一种新颖的靶标发现方法,特别擅长筛选小分子(SM) 靶标,而无需任何结构修饰。当小分子药物与其靶标蛋白结合后,会使得靶标蛋白对蛋白酶的降解敏感性下降,从而变得更稳定。DARTS方法能够通过追踪作为生物活性SMs受体的蛋白质稳定性的变化来揭示细胞或组织中的药物-靶标相互作用。DARTS可以与其他技术,例如C0-IP,SPR,MST等一起联合进行目标蛋白的鉴定和验证。
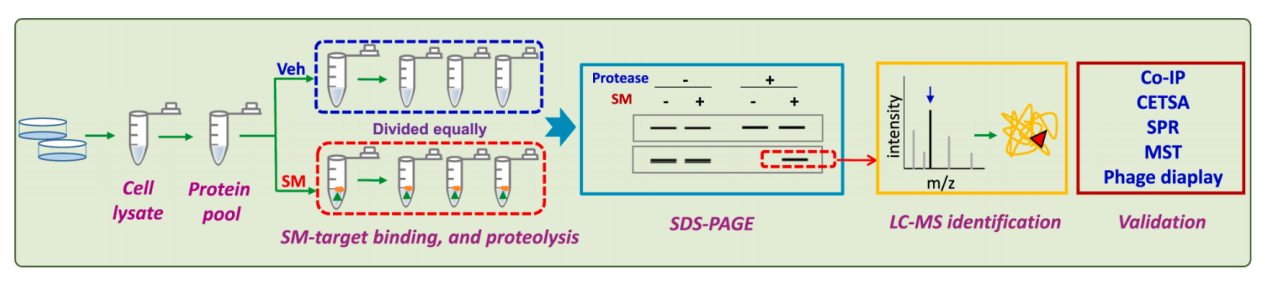
(数据来源 Ren YS, et al. Biochem Pharmacol. 2021)
小分子-蛋白互作技术比较
每种技术都有其独特的优势和局限性,选择合适的实验方法需要根据研究目的、可用资源和实验条件来决定。例如,对于需要在细胞内研究药物作用的情况,CETSA可能是一个更好的选择;而对于需要高通量筛选的研究,MST和FPIA可能更加合适。

