配文摘要
通过开发抗DCIR激动抗体,促进DCIR免疫受体酪氨酸抑制基序(ITIM)的磷酸化和含有酪氨酸磷酸酶-2(SHP2)的SH2的募集,以减轻炎症。研究人员还探索了通过抗体消耗DCIR+细胞来解决炎症。利用人DCIR敲入小鼠模型,研究人员验证了抗DCIR激动性抗体对实验性腹膜炎和结肠炎的抗炎作用。这些发现为针对DCIR开发炎症性疾病的变革性疗法提供了关键证据。
背景
树突状细胞抑制受体(Dendritic cell inhibitory receptor,DCIR)是一种C型凝集素受体,可选择性表达于骨髓细胞,包括单核细胞、巨噬细胞、树突状细胞和中性粒细胞。其在免疫调节中的作用已在小鼠模型和人类全基因组关联研究(GWAS)中得到证实,表明DCIR功能缺陷与对自身免疫性疾病(如类风湿关节炎、狼疮和干燥综合征)的易感性增加有关。然而,关于DCIR激活抑制炎症的机制知之甚少。
2024年5月23日,研究人员在JCI Insight上发表了一篇名为“Agonistic anti-DCIR antibody inhibits ITAM-mediated inflammatory signaling and promotes immune resolution”的文章,美国研究人员通过开发了抗DCIR激动抗体,促进DCIR免疫受体酪氨酸抑制基序(ITIM)的磷酸化和含有酪氨酸磷酸酶-2(SHP2)的SH2的募集,以减轻炎症。研究人员还探索了通过抗体消耗DCIR+细胞来解决炎症。利用人DCIR敲入小鼠模型,研究人员验证了抗DCIR激动性抗体对实验性腹膜炎和结肠炎的抗炎作用。这些发现为针对DCIR开发炎症性疾病的变革性疗法提供了关键证据。

树突状细胞抑制受体(DCIR)概述
免疫调节受体通过平衡激活和抑制免疫反应,在免疫稳态中起着至关重要的作用。抑制性受体通常通过位于细胞内的免疫受体酪氨酸抑制基序(ITAMs)转导抑制信号,以抵消邻近的免疫受体酪氨酸激活基序(ITAMs)受体的功能。树突状细胞抑制受体(DCIR)含有细胞外凝血素样结构域和细胞质结构域的ITIM基序,通过募集磷酸酶SHP-1和SHP-2提供抗炎信号。DCIR-/-小鼠在胶原诱导的关节炎(CIA)和实验性自身免疫性脑脊髓炎(EAE)模型中极易发病。此外,DCIR多态性与患者对类风湿性关节炎(RA)等自身免疫性疾病的易感性有关。系统性红斑狼(SLE)和原发性Sjögren’s综合征。因此,DCIR功能不足可能导致自身免疫。研究表明,树突状细胞和
巨噬细胞中的DCIR受体可抑制TLR依赖性炎症细胞因子的产生,如IL-1β、IL-6、TNFα、IL-12和IFNα。唾液酸化IgG连接DCIR会产生耐受性的DC和Treg。最近的一项研究表明,一种N-聚糖(NA2)结合DC上的DCIR可改善CIA和EAE症状。
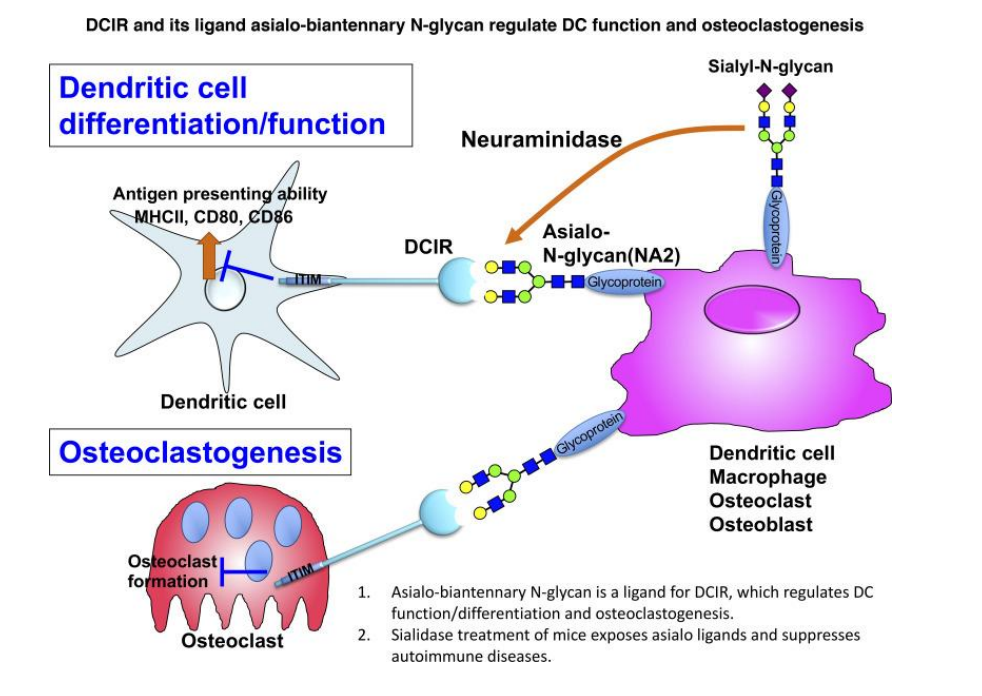
(数据来源Kaifu T, et al. J Exp Med. 2021)
DCIR在疾病细胞中被诱导表达
通过BLUEPRINT数据集比较了未受干扰的血液免疫细胞中DCIRmRNA的表达,发现DCIR的表达不仅在未成熟和成熟的常规DC(cDCs)中丰富表达,而且在中性粒细胞、经典单核细胞和巨噬细胞中也丰富。然而,DCIR在B细胞和T细胞中的表达较低。与其他免疫检查点受体一样,刺激后DCIR升高可以作为一种反馈机制,防止激活免疫细胞过度炎症。DCIR蛋白在炎症状态下由于LPS刺激而进一步被诱导,但是B细胞和T细胞上也很少发现DCIR。scRNAseq分析显示,在病变HS样本中,DCIR富集于组织浸润的中性粒细胞、单核细胞、巨噬细胞和组织常驻骨髓细胞,包括cDC1/2和朗格汉斯细胞。

一种RNA-seq分析表面,和正常样本比,自身免疫患者(包括CD,UC,HS)的DCIR水平身高,除了HS之外,抗tnfα治疗耐药的CD患者的黏膜组织scRNAseq数据表明,DCIR选择性地表达于病变中的经典型、中间型单核细胞和DCs。黏膜组织大量RNAseq数据进一步支持DCIR表达增强与抗炎治疗抵抗相关。

与RNAseq结果一致,免疫组织学染色也证实,在HS皮肤活检组织、CD黏膜组织和皮肤狼疮皮损的表皮和真皮层中,DCIR+细胞聚集增加。DCIR在疾病中的高表达为开发基于DCIR的治疗方法来抑制炎症髓系细胞的迁移和活化提供了理论基础。

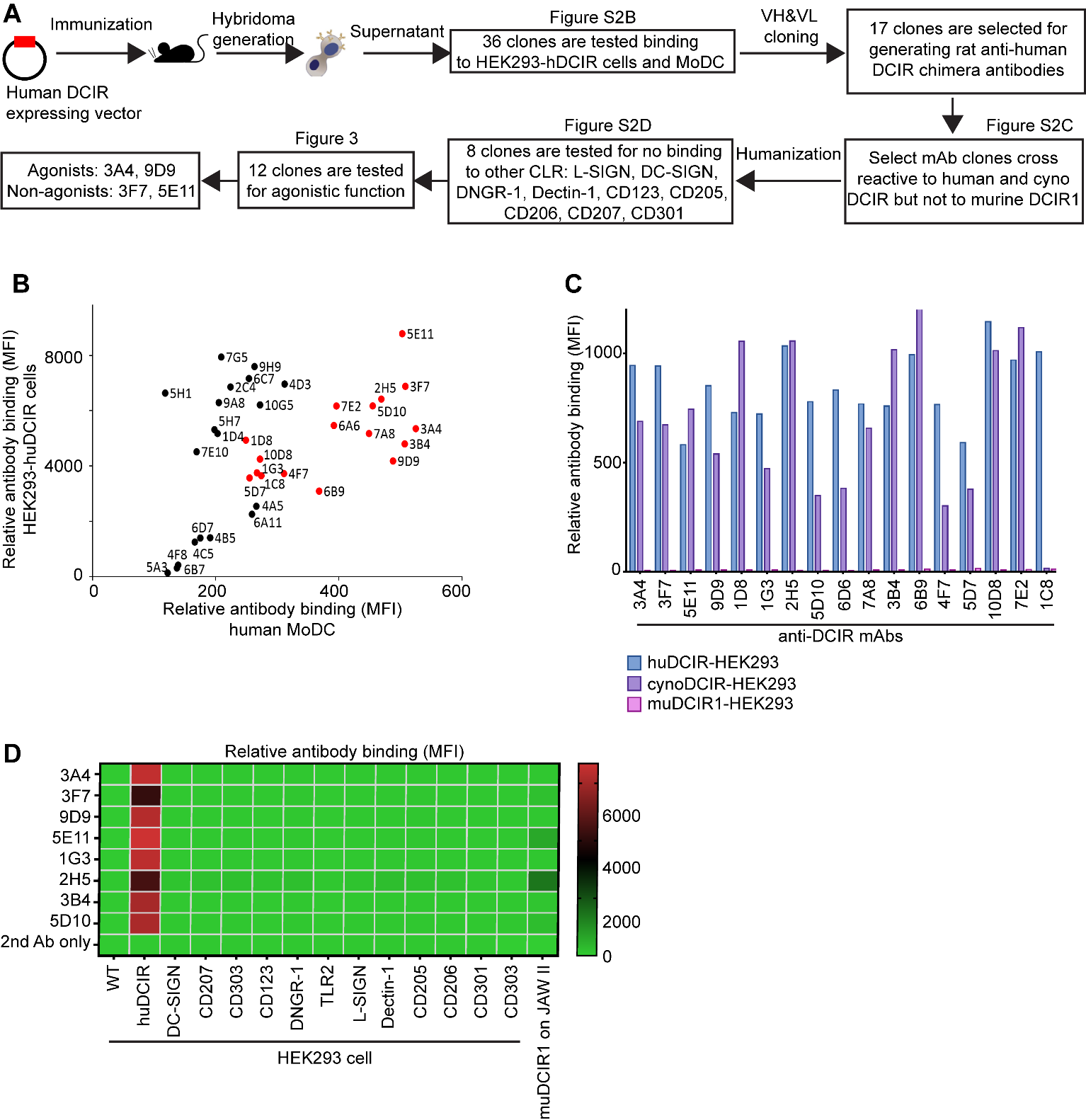
人源抗DCIR单克隆抗体的鉴定
研究人员为了研究DCIR作为治疗炎症性疾病的治疗靶点的潜力,生产了一种DCIR单克隆抗体,在抗体制备过程中,研究人员分离杂交瘤克隆的培养上清液,以寻找与过表达huDCIR的HEK293细胞和单核细胞来源的树突状细胞(MoDCs)结合的分泌抗体。将分泌强DCIR结合物的杂交瘤的重链和轻链可变区(VH和VL)克隆到人IgG1骨架中,并以嵌合单克隆抗体表达。它们与食蟹鼠(cyno)DCIR和huDCIR的交叉反应性也得到证实,但与小鼠DCIR1(muDCIR1)没有交叉反应性。最后,在去除大鼠来源的序列和根据艾伯维公司开发的高通量抗体人源化设计软件建议的密码子优化后,产生了完全人源化抗体。并发现其对人类和cynoDCIR具有特异性,但对其他选定的人类C型凝集素受体、模式识别受体和小鼠DC细胞系JAWSII上表达的muDCIR1无特异性。
抗DCIR单抗诱导酪氨酸磷酸化
通过免疫共沉淀鉴定DCIR酪氨酸磷酸化和SHP2的相互作用,在huDCIR过表达的HEK293细胞中筛选抗DCIR单克隆抗体;其中9D9、3B4和3A4克隆诱导了强烈的激动作用。研究人员生成HuDCIR激动性信号报告细胞系,以取代DCIRITIM基序。通过ITAMNF-κB信号激活测量荧光素酶活性来量化抗体介导的激动作用。甘露糖和NA2-聚糖是DCIR诱导DC耐受性的配体,发现与BSA结合并固定在板上的甘露糖和NA2-糖可以诱导激动作用,使用DCIR激动信号报告系统可以在50µg/ml时达到饱和。预处理甘露糖-BSA或NA2-glygan-BSA(50µg/ml),然后加入激动型抗DCIR抗体(9D9),并没有损害9D9诱导的信号传导。这些结果说明抗DCIR抗体进一步放大了DCIR的免疫耐受信号,即使被天然配体占据。

激动型抗DCIR抗体发挥免疫抑制功能
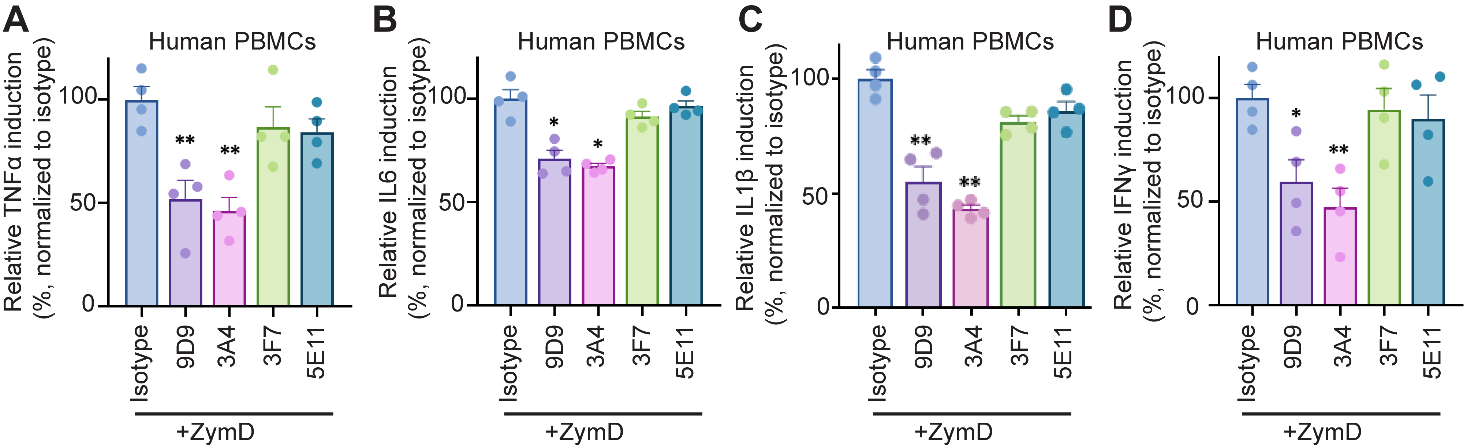
为了确保激动效应不是由抗体的结合差异引起,研究人员证实了抗体与人单核细胞的结合具有可比性。研究发现与过表达DCIR的HEK293细胞的抗体筛选结果一致,激动型抗DCIR单抗9D9和3A4在人单核细胞中触发了DCIR和SHP2的相互作用,在FC匹配的同型对照或非激动型抗DCIR单抗3F7存在的情况下,用抗人血清白蛋白免疫复合物(IC:HSA)刺激单核细胞可增加SYK和SHP2的相互作用,用激动型抗DCIR单抗9D9和3A4处理免疫复合物刺激的单核细胞,SHP2-syk的相互作用显著降低到与无刺激细胞相似的水平,同时促进SHP2和DCIR的相互作用。这些数据表明,DCIR-ITIM信号通路可能克服ITAM激活并竞争SHP2募集。事实上,激动型抗DCIR克隆9D9和3A4也损害了SYK和Fc受体γ链之间的相互作用。与同型抗体和非/弱激动抗体(3F7和5E11)相比,两种激动抗体(9D9和3A4)都降低了OCR。

激动型单抗9D9和3A4在酵母多糖-d(ZymD)刺激下抑制DECTIN1的激活,如单核细胞和PBMC的TNFα和IL6分泌减少所示,而非激动型单抗3F7无影响。
huDCIR-ki小鼠中可见浸润的DICR阳性细胞
研究人员设计出一种huDCIR-ki小鼠用于评估靶向huDCIR作为炎症性疾病治疗的潜力。在急性腹膜炎和结肠炎期间,huDCIR-KI小鼠中可见浸润的DCIR阳性细胞。在ZymD诱导的腹膜炎模型中,研究人员观察到在huDCIR-KI小鼠的腹腔液中出现大量的huDCIR阳性细胞。在DSS诱导的结肠炎模型中,研究人员也发现在结肠隐窝中有大量的huDCIR阳性细胞浸润。这些结果表明,在这些炎症性疾病模型中,DCIR阳性细胞都会明显增加,说明DCIR可能在这些疾病的发病机制中起重要作用。

激动性抗DCIR单抗改善实验性急性腹膜炎
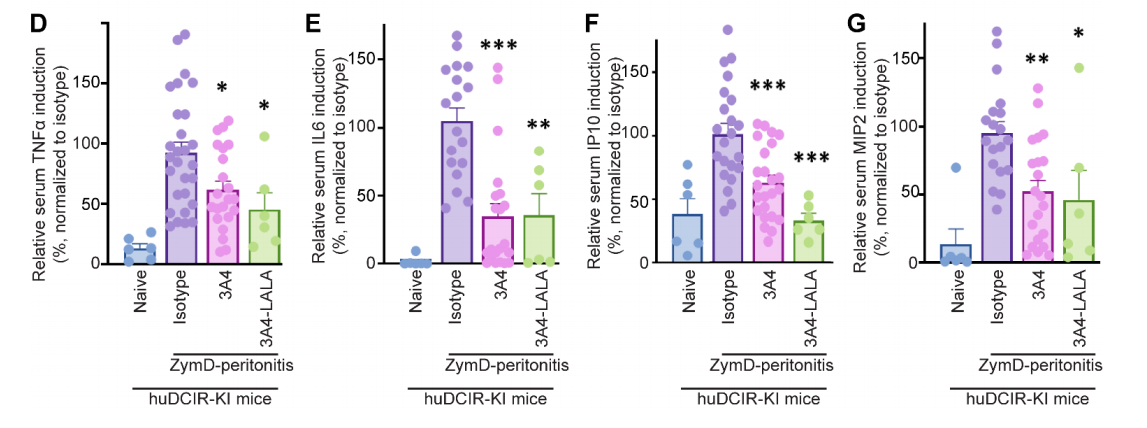
研究人员在ZymD诱导的腹膜炎模型中评估了激动性和非激动性单抗的疗效。发现与Fc匹配的同型对照组相比,激动克隆3A4和9D9的预防性治疗显著降低了huDCIR-KI小鼠的腹膜炎严重程度,表现为腹腔灌洗液中白细胞和中性粒细胞的聚集减少。在WT小鼠中未观察到激动克隆3A4治疗的显著效果。

为了消除抗体Fc部分对评估激动效应的影响,研究人员将WT3A4与LALA(L234A和L235A)突变的FcR结合能力受损的3A4变体进行了比较,发现与FcR结合相比,强激动作用对DCIR的保护作用更明显。
抗DCIR抗体通过ADCP和ADCC促进中性粒细胞清除
使用CellTrackerGreen染料标记了LPS诱导的中性粒细胞,并在使用一组抗DCIR抗体或Fc匹配的同型对照的情况下,将其与人单核细胞来源的巨噬细胞共培养,发现激动型克隆3A4和9D9,以及弱激动型克隆5E11和程度较轻的非激动型克隆3F7,都表现出增强的ADCP效应。使用商业ADCC报告系统,发现3A4、9D9和5E11也可以通过Fc介导的ADCC促进中性粒细胞清除,3A4 LALA突变体未能触发ADCC相关信号传导。
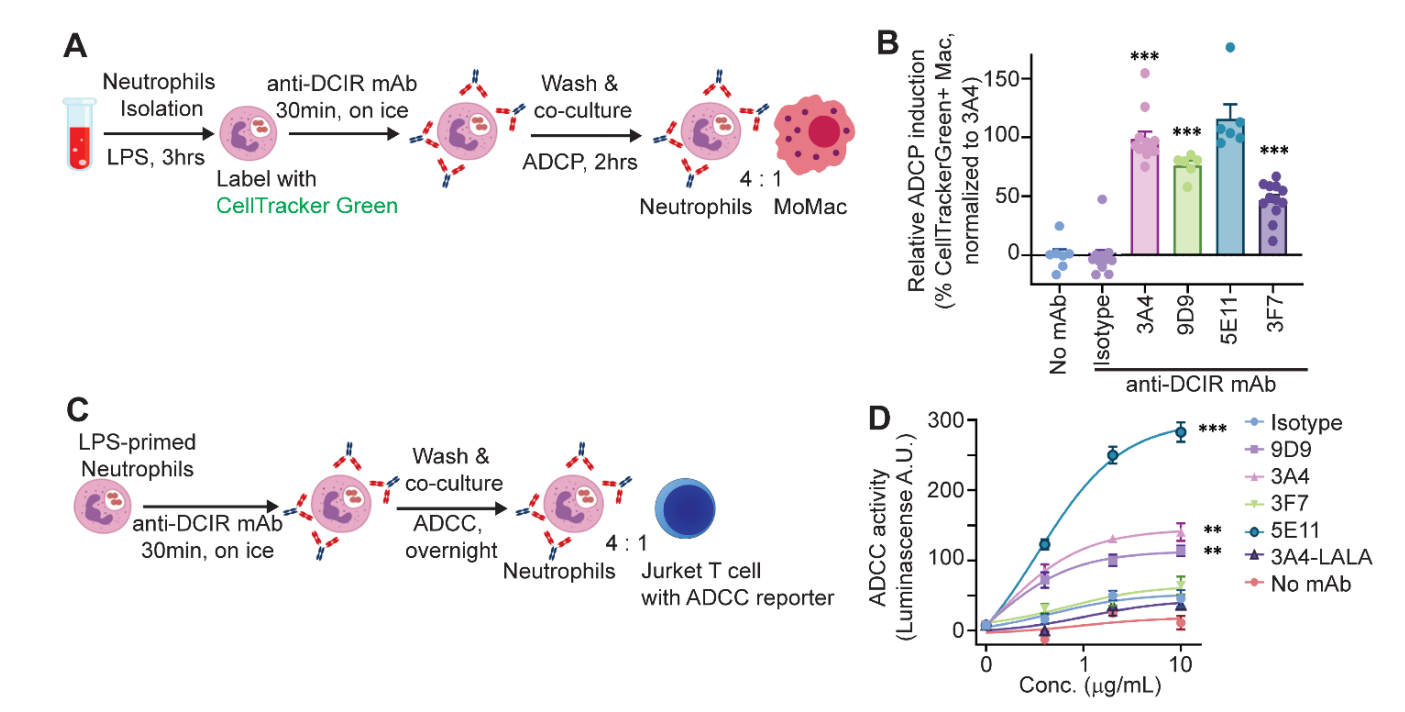
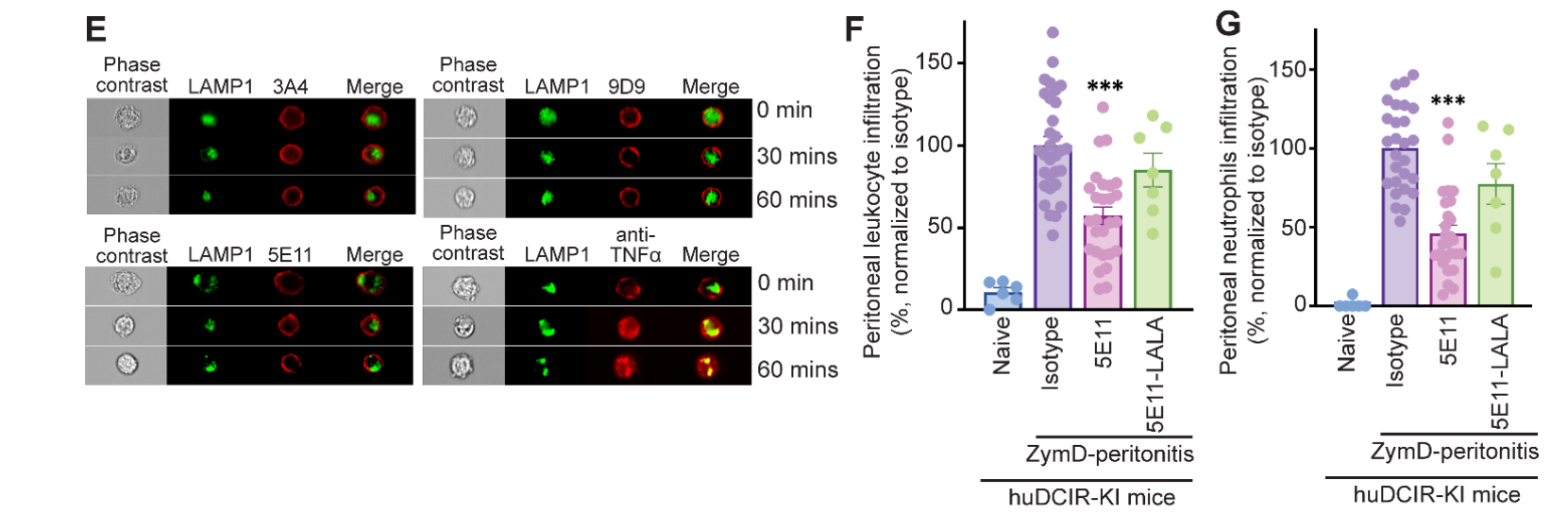
抗DCIR单抗未观察到明显的内吞作用,这些数据表明,我们的抗DCIR单抗可以提供一种克服DCIR内吞作用的方法,并促进抗体介导的对炎症DCIR+细胞的清除。为了进一步评估体内抗体介导的中性粒细胞清除作用,研究者在ZymD诱导的小鼠腹膜炎模型中比较了野生型和LALA突变的5E11克隆。结果显示,与Fc片段缺失的5E11 LALA相比,野生型5E11能显著减少腹腔中的白细胞和中性粒细胞积累。
为了最大限度发挥小鼠Fc受体CD16和CD32介导的ADCP和ADCC效应,研究者还制备了一种鼠IgG2b型的5E11抗体(5E11-mIgG2b)。在ZymD诱导的腹膜炎模型中,5E11-mIgG2b能显著减少腹腔中的白细胞和中性粒细胞积累,抑制炎症因子IL-6和TNF-α的产生,与抗Gr-1抗体的效果相当。

激动性抗DCIR单抗可减轻实验性结肠炎
研究人员通过使用激动性DCIR单抗(9D9),非激动性单抗(3F7),同型对照分别治疗DSS暴露前和DSS暴露后第三天的小鼠,发现激动性抗DCIR单抗9D9能显著减轻DSS诱导的结肠炎症,表现为减少体重下降。在DSS诱导结肠炎模型中,中性粒细胞激活和隐窝脓肿的程度与疾病严重程度相关。通过共聚焦激光内窥镜(CLE)检查,9D9抗体能降低中性粒细胞活化和结肠密集管的损伤。组织学分析也显示,9D9抗体治疗可减少结肠黏膜的溃疡和炎性细胞浸润,并减少黏膜腺体和粘膜下层的增生。9D9抗体还能显著降低炎症因子MIP-2的分泌,表明其可减少中性粒细胞的趋化和活化。总体而言,施用激动性抗DCIR单抗可显著改善DSS诱导的结肠炎。

小结
DCIR激动性抗体将SHP2招募到细胞内ITIM结构域,从而抑制了通常由其他促炎模式识别受体启动的免疫刺激SHP2-syk途径的激活。抗DCIR抗体可能通过Fc介导的中性粒细胞清除促进炎症的消退。这些发现揭示了抗DCIR单克隆抗体通过激动作用和细胞耗竭作用的免疫抑制机制,为针对DCIR寻求炎症性疾病的变革性治疗奠定了坚实的基础。与靶向单个受体相比,使用多价抗体交联多个免疫抑制受体可产生更强的抑制效果。未来的研究可以探索双特异性激动抗体设计的应用,将DCIR与另一种免疫抑制受体(如PD-1)聚集在一起,或者利用工程Fc区域增强与FcγIIB的交联。这些策略有可能通过增强共抑制复合物来显著改善免疫调节功能。
