背景
受体介导的内吞作用在众多疗法的成功中起着至关重要的作用,并且仍然是推进药物开发的核心。该过程始于配体与特定受体的结合,触发受体配体复合物的内在化和细胞内运输。随后将这些复合物引向不同的途径,要么朝着溶酶体降解或回收到细胞表面,影响治疗结果。

2025年J Control Release上发表了一篇名为“Receptor-ligand interactions for optimized endocytosis in targeted therapies”的综述,本综述研究了受体-配体相互作用作为内吞作用的关键调节剂,强调了它们在形成治疗设计和疗效中的作用。在选择受体-配体对和设计具有优化性质的配体方面取得的进展,使我们能够精确控制内化、内体分选和运输,为各种治疗应用提供量身定制的解决方案。例如RNA的疗法、抗体-药物偶联物(ADC)和靶向蛋白降解(TPD)平台等策略已被改进,以选择性地避免或促进溶酶体降解,从而提高治疗效果。通过连接受体介导的细胞内吞作用的基本机制和创新治疗方法,本文为推进精准医学提供了一个框架。
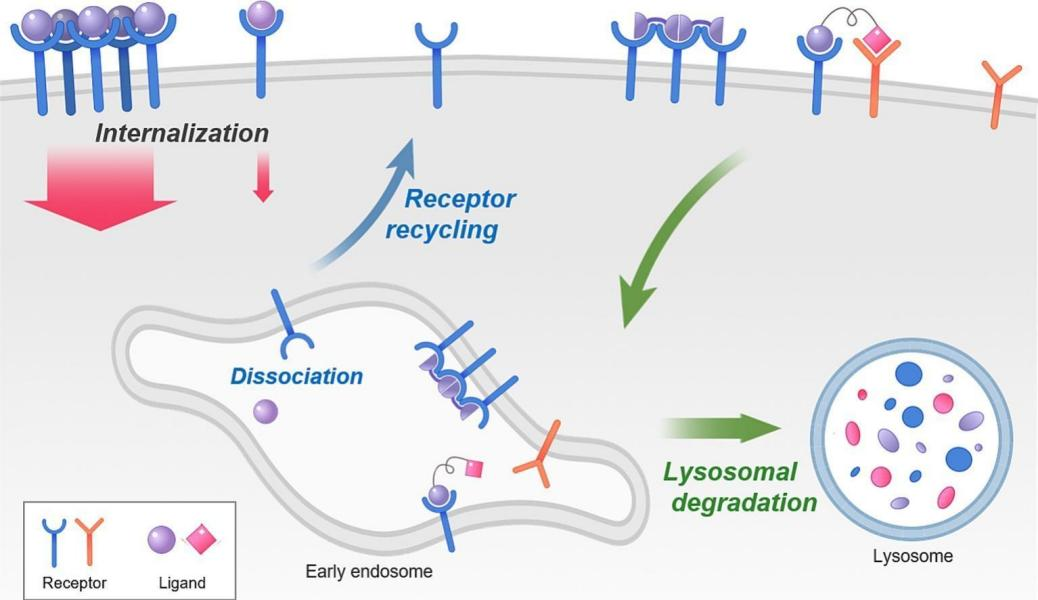
受体介导的内吞作用的过程
受体介导的内吞作用的过程主要包括受体和配体的结合形成受体配体复合物,然后通过各种内吞途径内化,例如网格蛋白介导的或非蛋白酶独立的内吞作用,将受体配体复合物转运到早期内体中。一旦内部化,受体配体复合物被分类为早期内体内的不同运输途径。在早期的内体中,内化复合物分为两种主要途径:再循环到质膜或运输到溶酶体降解。
内吞作用的强度和方向受受体配体配合物的内在特性(例如结合亲和力,配体位点特异性,受体聚类和pH依赖性分离曲线)调节。受体介导的内吞作用充当选择性转运机制,从而使细胞外信号精确地调节细胞内功能。
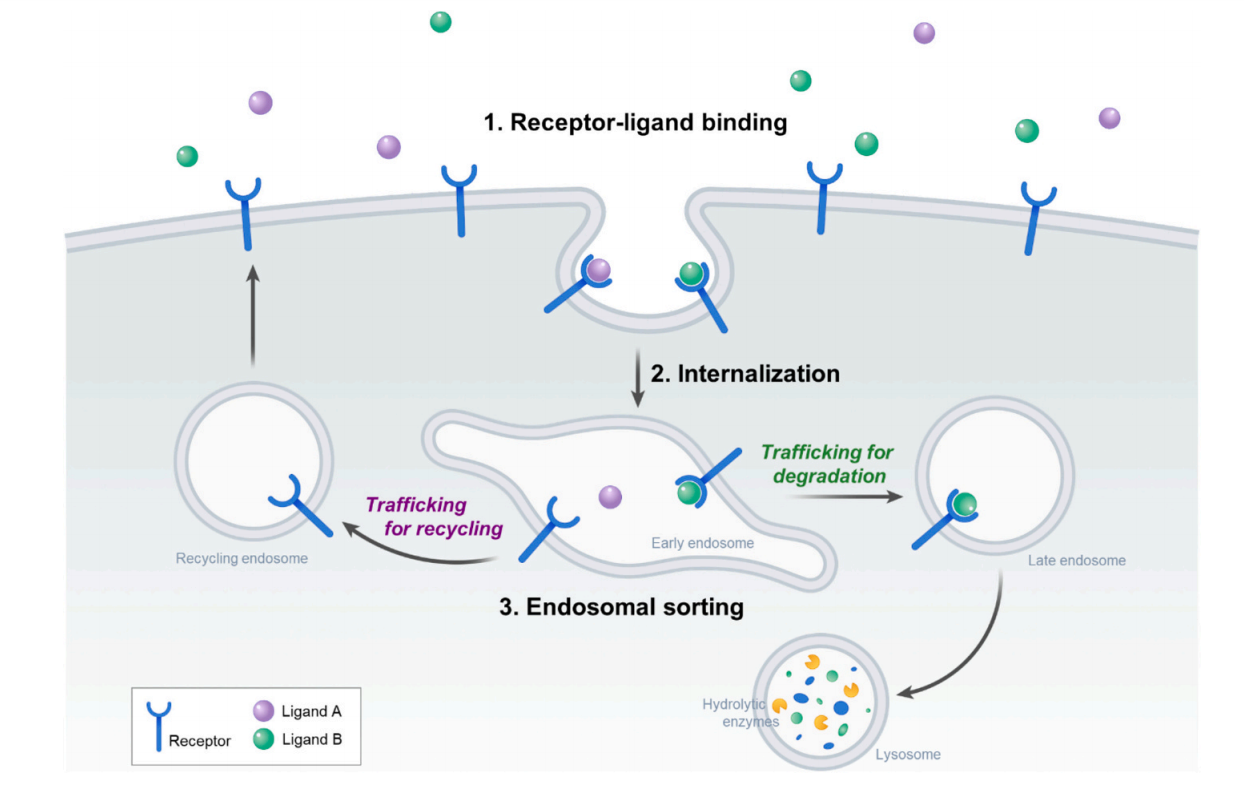
受体配体相互作用的研究进展
控制受体-配体相互作用以促进内化或诱导特定运输途径以优化治疗效果的治疗策略主要有通过多价相互作用进行有效的内在化,避免溶酶体降解,通过受体交联的溶酶体降解以及双功能配体平台靶向蛋白质降解。
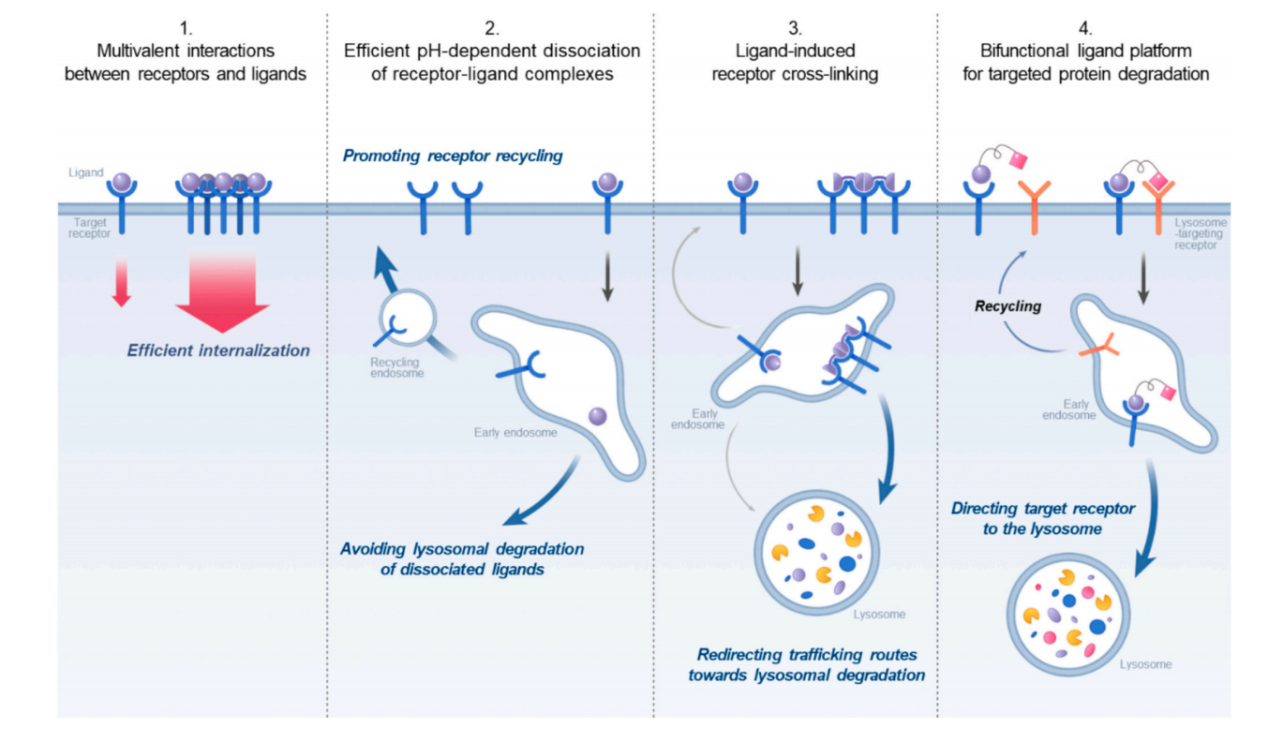
配体结合及其对内化的影响
结合亲和力:结合亲和力,受体结合位点,相互作用模式等因素显着影响内化效率。
多价性:对受体结构分析发现受体可能存在多个配体结合结构域,这种多价相互作用显着增强了结合亲和力,提高灵敏度和选择性,同时促进有效的内在化。
最近的研究表明,针对ASGPR和甘露糖受体(如特定细胞类型)的靶向受体和甘露糖受体等受体的三价配体。Tri-galnac结合物特异性定位在肝细胞中,而多价甘露糖配体靶向巨噬细胞和上皮细胞。这些受体中多个碳水化合物识别域的存在允许与多价配体同时相互作用,从而增强了复合物的亲和力和稳定性。受体架构并通过策略性设计配体的重要性,以补充配置来优化治疗应用的绑定和内在化。

受体聚集:受体聚类在多价性中起着至关重要的作用,细胞膜上的单价受体可以在结合多个配体时聚集,从而显着增强了受体配体复合物的内在化。将成纤维细胞生长因子受体(FGFR)1簇成较大尺寸的聚类刺激了更有效的内在化。二价抗体的结合诱导FGFR1二聚化,促进网格蛋白介导的受体内吞作用。相比之下,将FGFR1聚集到具有四抗抗体的较大的低聚物中,通过网格蛋白介导的和网格蛋白独立的途径增强了快速有效的受体内在化。IL-2R的内在化也受受体聚类大小的影响,并且需要优化最佳受体聚类水平以调节内在化效率。

pH依赖性解离:在早期内体的酸性环境中,配体从其受体中快速解离可以促进受体回收利用并促进配体释放到细胞质中。相反,在酸性条件下保持与受体结合的配体更可能将受体配体复合物引导到溶酶体降解,从而影响治疗效果。
优化受体-配体相互作用以增强治疗效果
选择合适的配体并优化关键性质设计配体以增强疗效非常重要,例如结合亲和力、配体位点特异性和多价性等属性会影响受体聚集,进而影响受体-配体内部化的效率。受体-配体复合物的解离谱、受体交联以及针对受体的双功能分子也会影响决定细胞内转运途径,如回收或溶酶体降解。

通过多价配体设计增强内在化:配体的最佳多价性使其能够与受体同时结合,导致其复合物大量内化,并增强递送药物的治疗效果。设计多价结合配体并选择特定的结合位点,可通过实现更强的结合亲和力、促进受体聚集、提高内化效率来增强靶向治疗,直接促进药物递送和治疗效果。
通过优化受体配体解离来避免溶酶体降解的策略
内体解离驱动的治疗药物胞质递送:将能在早期内体中高效解离的配体进行偶联,来实现治疗性药物的细胞质传递的治疗策略。这种解离使受体能够回收回到细胞膜,而偶联的药物则被释放到细胞质中。这一策略的代表性例子是开发基于RNA的药物,并将其与GalNAc配体偶联,这些配体能特异性地靶向肝细胞并通过受体介导的内吞作用增强RNA传递,从而实现高效的细胞质RNA传递。
促进受体循环和维持功能的配体工程:通过优化受体-配体对或工程化具有定制解离和相互作用曲线的配体,可以实现持续的受体介导的细胞反应,特别是在免疫调节方面。

在治疗中增强溶酶体降解的策略
治疗性抗体平台和靶向溶酶体蛋白降解技术,这些疗法通过促进受体-配体复合物被溶酶体降解来释放治疗药物或消除致病受体,从而增强治疗效果。在这种情况溶酶体降解发挥重要作用。
改变运输途径促进溶酶体降解
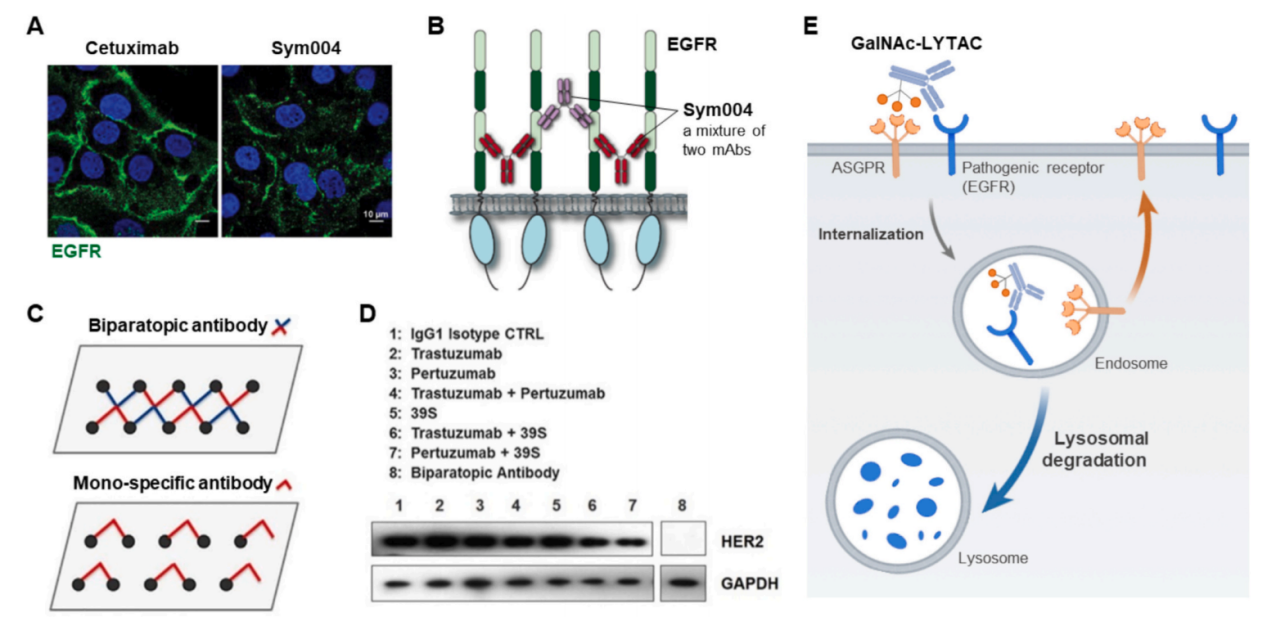
受体交联:指配体诱导的目标受体的聚类,其中配体结合到同一受体的多个位点或桥接不同的受体分子。它可以增强受体聚集,促进了高效的内部化,将受体复合物重新定向到溶酶体进行降解,并减少了受体回收,受体交联提高抗体治疗的治疗效果。在抗体治疗中,双特异性抗体和抗体药物偶联物(ADC)都通过受体交联,将这些受体定向至溶酶体,从而提高疗效。
通过促进溶酶体靶向受体来增强靶向蛋白质降解
靶向蛋白质降解(TPD)代表了一种创新的治疗策略,旨在降解与疾病相关的蛋白质,作为治疗各种疾病的至关重要的机制。其中溶酶体靶向嵌合体(LYTACs)是一种由不同配体组成的双功能配体,这些配体既能结合病原性受体又能结合溶酶体靶向受体。通过利用受体-配体相互作用,LYTAC平台持续引导病原性受体(如EGFR、HER2和PD-L1)向溶酶体降解。
总结
本文探讨了受体-配体相互作用在靶向疗法中的关键作用,需要优化这些相互作用来增强受体介导的内吞作用,从而提高治疗效果。受体介导的内吞过程,包括配体结合、内吞、内体分类和细胞内运输。受体-配体复合物的特性(如结合亲和力、配体的多价性、受体聚集和pH依赖性解离)对内吞效率和细胞内命运的具有重要影响。战略性地设计的受体-配体相互作用对于指导特定的转运途径至关重要,这些途径有助于溶酶体降解和选择性去除与疾病相关的蛋白质。通过优化这些相互作用,无论是通过仔细选择受体-配体对还是通过配体工程,可以提高内化效率并显著改善治疗效果。
