背景
20世纪70年代,随着可变基因重排和体细胞超突变的发现,围绕抗体多样性产生机制的谜团在很大程度上得到解决。免疫球蛋白由两个独立的结构域(可变区和恒定区)组成,这两个结构域分别赋予特异性和效应功能。然而,自这些早期发现以来,人们对影响抗体整体结构的可变域和恒定域之间的交流进行了一系列观察,这提示免疫球蛋白具有比之前认为的更复杂、更相互关联的功能。另一个尚未解决的问题是“限制性”抗体反应的发生,其特点是尽管具有巨大的潜在组合多样性,但仅使用少数可变区基因片段。
2025年3月20日约翰霍普金斯大学Arturo Casadevall在《Nature reviews immunology》上发表了一篇名为“New insights into antibody structure with implications for specificity, variable region restriction and isotype choice”的文章,将最近与免疫球蛋白结构和功能相关的发现置于这些重要的、历史上未解决的问题的背景下,提出了一个新的模型,用于在没有自身反应的情况下如何实现抗体特异性。

抗体多样性的问题
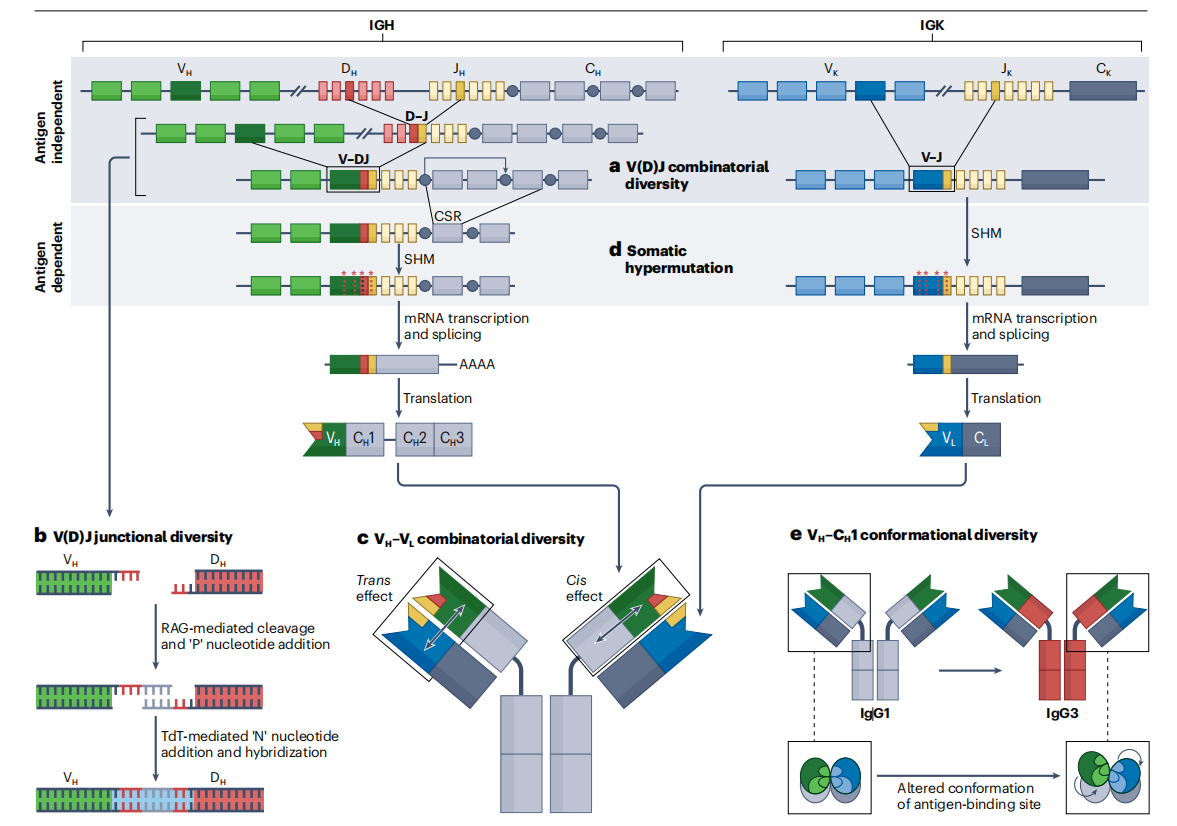
抗体多样性(GoD)的问题是由S. Tonegawa和他的合作者在20世纪70年代的工作解决的,他证明GoD是通过重新排列和连接单独的V、D和J遗传元件来构建编码免疫球蛋白重链和轻链可变结构域的可变基因来实现的。这一发现为他赢得了诺贝尔奖。目前的接受的是一种混合模型,即抗体多样性既来自种系编码的基因片段,也依赖于体细胞突变。抗体的多样性主要通过V(可变区)、D(多样性区)和J(连接区)基因片段的重排以及体细胞超突变(SHM)来实现。
免疫球蛋白的结构多样化通过一系列不同的机制产生抗原的特异性结合表面。在B细胞发育的抗原不依赖阶段,组合多样性通过以下排列产生:(1)V基因片段与J和/或D基因片段的重组;(2)轻链和重链的不同配对。连接多样性也通过V(D)J基因片段连接过程中核苷酸的随机插入或删除而产生。在B细胞发育的抗原依赖阶段,体细胞超突变和已组装的可变区基因的选择通过一种称为亲和成熟的过程进一步使序列多样化。
免疫球蛋白多样性的另一个来源出现了-构象多样性-涉及可变区基因和恒定区基因的不同组合。免疫球蛋白分子的重链和轻链之间的相互作用发生在Fab内(在VH-CH1和VL-CL之间的界面)。恒定结构域不赋予可变区域序列多样性,而是通过界面接触影响相邻可变区域编码的旁位的构象状态。
对可变区域限制的见解
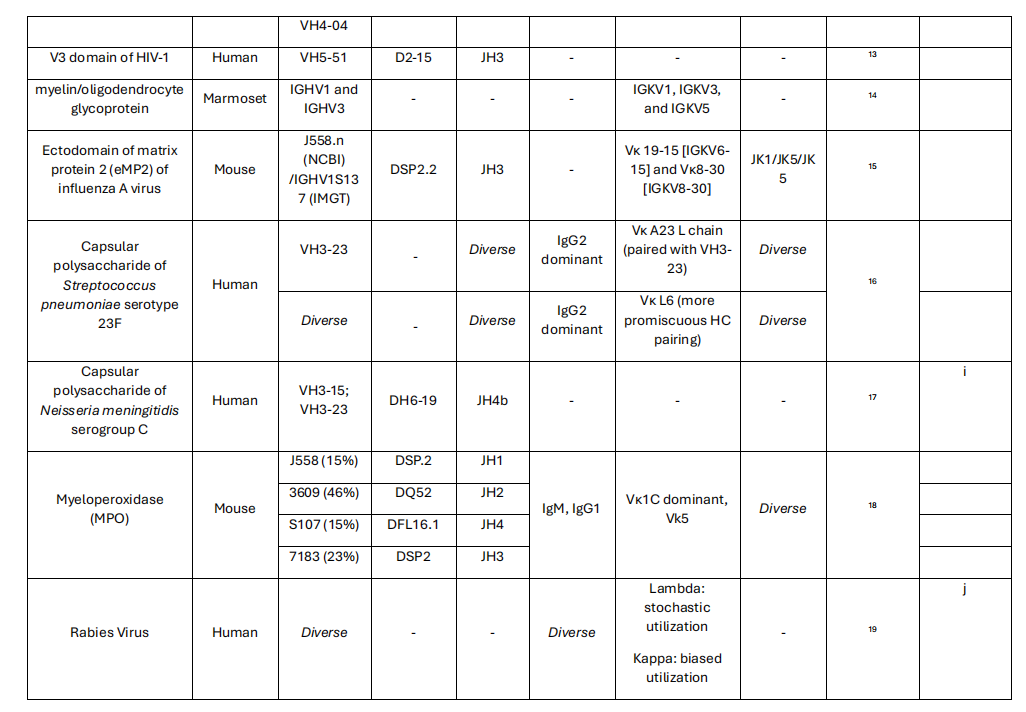
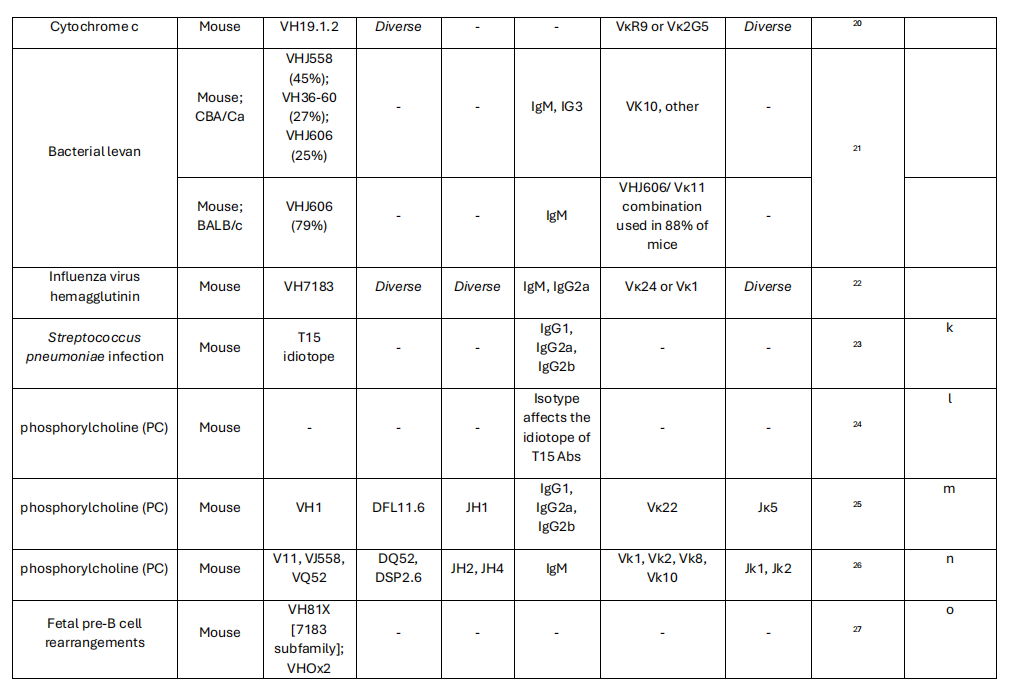
尽管高可变互补决定区3(CDR3)环是决定抗体特异性的关键因素,因为它具有D和J基因片段的连接多样性,限制性重链可变区基因(CDR1和CDR2)的种系序列所贡献的特征序列基序对于赋予一般特异性的重要性。从结构的角度来看,由一组有限的基因表达的抗体可变区可能与特定的重链恒定区1(CH1)结构域相互作用,产生有利于结合某些抗原的构型。可变区基因残基在CH1界面上的高度保守性为以下理论提供了证据:某些可变区- CH1配对最适合靶向特定抗原。这可能会引起对某些抗原的同型限制性抗体反应,以及具有相同可变区域的同型转换单克隆抗体特异性改变的现象。


抗体构象的柔韧性
抗体是动态分子,在几个区域具有构象灵活性,Fab的整体布置由重链和轻链的可变区(VH和VL)和恒定区(CH1和CL)之间的角度关系来定义,称为弯头角。弯头角根据轻链基因的使用而不同,弯头角在λ轻链的Fab中比kappa轻链的Fab变化更大。可变区和恒定区之间的界面很小,弯角的分子决定因素主要存在于每个链的可变区和恒定区之间的连接体残基中。在重链开关区域(位于CH180上游的区域)中有一个分子“球窝”结构基序,该区域限制了较大的弯头角。λ轻链比kappa轻链具有更大的结构灵活性,这可能有利于难以靶向构象多样性的表位。
免疫球蛋白可变区和恒定区功能偶联的新证据表明,CH1结构域是抗体Fab区和Fc区之间携带结构信息的相互作用残基网络的主要枢纽。CH1在确定抗体特异性方面起着至关重要的作用,CH1是Fab中唯一的重链常数结构域。
CH1和VH结构域界面处CH1初级序列的差异会改变弯头角,跨越VH和CH1的结构相互作用残基网络在Fab内形成了一个结构上重要的支架。
Fab内的分子间二硫键在同型之间以特有的方式不同。人和小鼠IgG1分子在CL的C端Cys残基和重链铰链区的第一个残基之间存在链间桥,但在其余的IgG同型中,相同的CL Cys残基与CH1结构域分子内二硫键N端重链中的Cys残基相连。

抗体结构的整体观点
传统观点认为抗体由两个独立的功能模块组成:Fab区域(负责抗原特异性)和Fc区域(负责免疫效应功能)。这种模块化模型假设Fab区域和Fc区域之间相互独立,功能上互不干扰。最新研究表明,抗体的可变区和恒定区之间存在复杂的相互作用,这种相互作用对抗体的整体功能至关重要。
在免疫球蛋白序列发生遗传变化(通过V(D)J重组、体细胞超突变和连接多样性)后,类别转换重组(CSR)(通过切换恒定区域改变抗体同型)在微调抗体特异性方面发挥了更大作用。整个抗体结构的构象相互作用也可能对我们理解调理吞噬作用的关键过程有重要意义。抗体-抗原复合物对吞噬细胞上FcR的亲和力必须高于未结合抗体。如果抗原与Fab结合时Fc可能发生构象重排,这可能通过相互作用残基的重新定位直接增加对FcR的亲和力。类别转换重组(CSR)改变了抗体常量结构域,从而改变了抗体的同型,可影响抗原结合可变区(同源表位)的配置。
抗体的特异性和亲和力主要由针对可变区CDR环一级序列的多样化机制决定。一个相互作用的CDR残基的单个突变可能比整个CH1结构域的替换对抗体特异性的影响更大。

抗体限制的新观点
由于CH1结构域还通过共价和非共价相互作用限制了轻链的构象自由,因此VL基因元件的使用也取决于CH1。这一观点与抗体合成的个体发生一致,即首先发生VH-CH重组,然后发生轻链重组。某些同种型更容易发生自身免疫反应,这可能是由于B细胞在选择后发生额外重组事件,导致VH-CH1配对的抗原特异性发生变化。抗体反应中的可变区限制可能部分是由于CH1在避免自身反应的同时对抗原结合所施加的结构限制,这极大地限制了可接受的V(D)J组合,尽管负责GoD的机制具有巨大的潜在组合多样性。这种结构限制是为了在避免自身反应的同时实现高特异性。
总结
这篇文章提出了关于抗体结构和功能的新观点,强调了抗体的可变区和恒定区之间的相互作用对特异性和效应功能的影响。CH1域通过约束VH区域的结构,对抗体的抗原结合特异性和自身免疫反应性起关键作用,并解释了抗体限制和同种型选择的耦合现象。文章强调了从整体结构角度理解抗体功能的重要性,这对于抗体药物的设计和开发具有重要的指导意义。
