背景
上皮细胞黏附分子(EpCAM)是一种抗体药物偶联物(ADC)的肿瘤抗原,在许多上皮癌中高度表达。然而,EpCAM ADC的临床进展一直充满挑战,主要是因为它们在胃肠道等正常高表达组织中的毒性。CLDN3在上消化道恶性肿瘤中与EpCAM共表达,且在正常组织中存在极少,使其成为开发高效治疗ADC的理想靶点。
2025年3月8日在Exp Hematol Oncol上发表了一篇名为“Development of a bispecific antibody-drug conjugate targeting EpCAM and CLDN3 for the treatment of multiple solid tumors”的文章,该文章开发了一种靶向EpCAM和CLDN3的双特异性ADC(BsADC),旨在避免在EpCAM高表达的正常组织中产生毒性。筛选的亲本单克隆抗体对肿瘤细胞株具有较高的结合和内吞活性。然后,将它们修饰成单价结构,并选择结合和内吞活性降低的克隆。将这些克隆组合成双特异性抗体(bsab),最终选择具有恢复结合和内吞活性的分子作为先导分子。通过可裂解的连接子将Drutecan(Dxd)与bsab结合,产生BsADCs。EpCAM和CLDN3的高表达能有效抑制肿瘤细胞的生长,表明了其抗肿瘤作用。重要的是,它们与EpCAM高表达但CLDN3低表达的细胞的结合能力较弱,这意味着它们对EpCAM高表达的正常组织的毒性很小。此外,BsADCs在小鼠体内表现出良好的药代动力学和较低的毒性。这些发现表明,靶向EpCAM和CLDN3的BsADCs有望用于治疗多种实体肿瘤。

EpCAM和CLDN3在多种肿瘤中共过表达
EpCAM在多种癌症中表现出广泛且升高的表达,特别是在结直肠癌恶性肿瘤中,但是它也经常在健康组织中适度表达,主要集中在胃肠道、肾脏和胰,因此会存在正常组织中毒性的潜在性。
研究发现在33种人类癌症类型中,CLDN3的表达模式与EpCAM密切相似。CLDN3在肿瘤细胞中高表达,但是在正常组织中不表达,CLDN3是一个有前景的肿瘤相关抗原(TAA),可以作为靶点开发与EpCAM结合的抗体偶联药物(BsADC)来治疗多种实体瘤。

BsADCs亲本抗体的选择及制备过程
研究人员选择了单价形式下表现出显著减少的结合和内吞活性的克隆,进一步降低非恶性组织中的毒性风险。gp120抗体被用作EpCAMX gp120或gp120X CLDN3 bsab与EpCAM或CLDN3单价臂的非结合臂。为了避免重链错配,使用了knob-into-hole技术和crossmab技术来防止轻链错配的问题。在卵巢癌细胞OVCAR-3和肺癌细胞NCI-H1781中评估他们的结合和内化活性,发现与亲本单克隆抗体相比,大多数bsab恢复了结合和内化活性。3种BsAb(BsAb1,EpCAM-AXCLDN3-C;BsAb2,EpCAM-BXCLDN3-C;BsAb3,EpCAM-DXCLDN3-C)表现出更好的结合和内化活性,这可能是由于两组的协同作用,这三种BsAb对OVCAR-3肿瘤细胞的结合活性呈剂量依赖性。
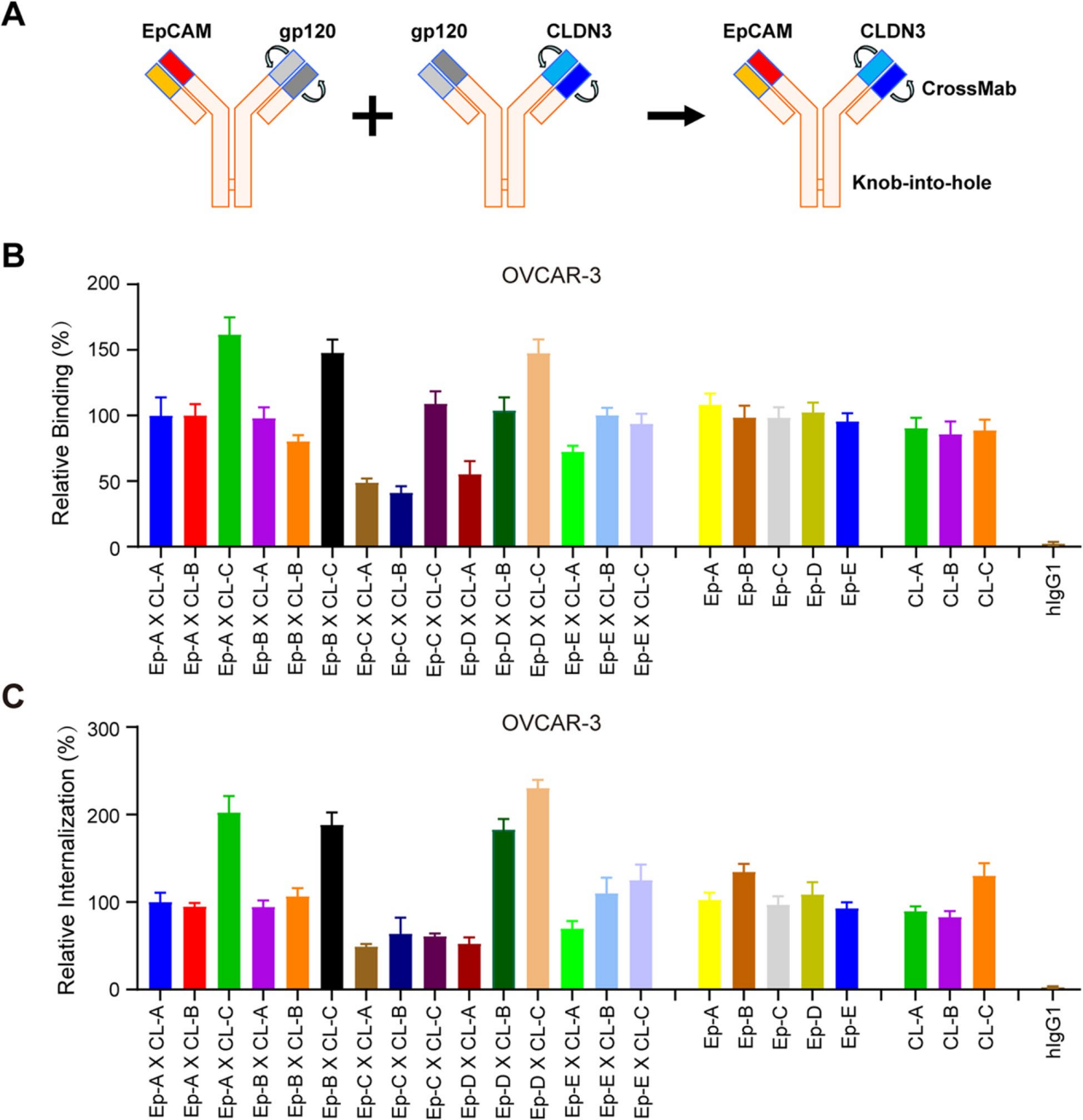
EpCAMXCLDN3 BsADCs在体内外均表现出显著的抗肿瘤活性
EpCAMXCLDN3 BsADCs通过GGFG连接子将Dxd负载物与3个BsAb上的内源性半胱氨酸残基生物偶联而产生的。
BsADCs的细胞毒性作用在体外实验中检测,在EpCAM和CLDN3高表达的OVCAR-3和NCI-H1781癌细胞中,观察到对BsADCs的体外抗增殖反应呈剂量依赖性。药物偶联后的BsADCs对EpCAM和CLDN3阳性细胞的生长抑制活性明显增强,且对EpCAM和CLDN3阳性细胞有靶向特异性生长抑制作用。
在小鼠异种移植模型中评估BsADCs的体内抗肿瘤活性,第28天的肿瘤生长比较表明,与IgG-ADC治疗相比,BsADCs治疗导致了显著的肿瘤消退。其中BsADC 3显示出最佳的抗肿瘤效果。
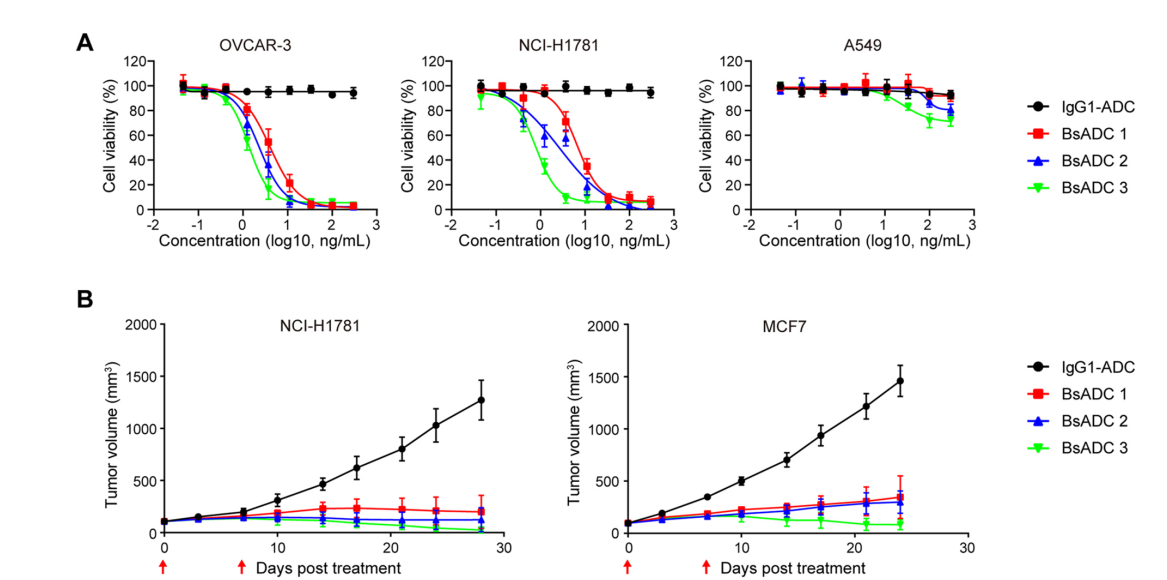
BsADC 3对表达EpCAM的正常组织具有较低的毒性
EpCAMXCLDN3双特异性抗体偶联药物(BsADC)在EpCAM高表达、CLDN3低表达的细胞上显示出减少的结合和细胞毒性活性。
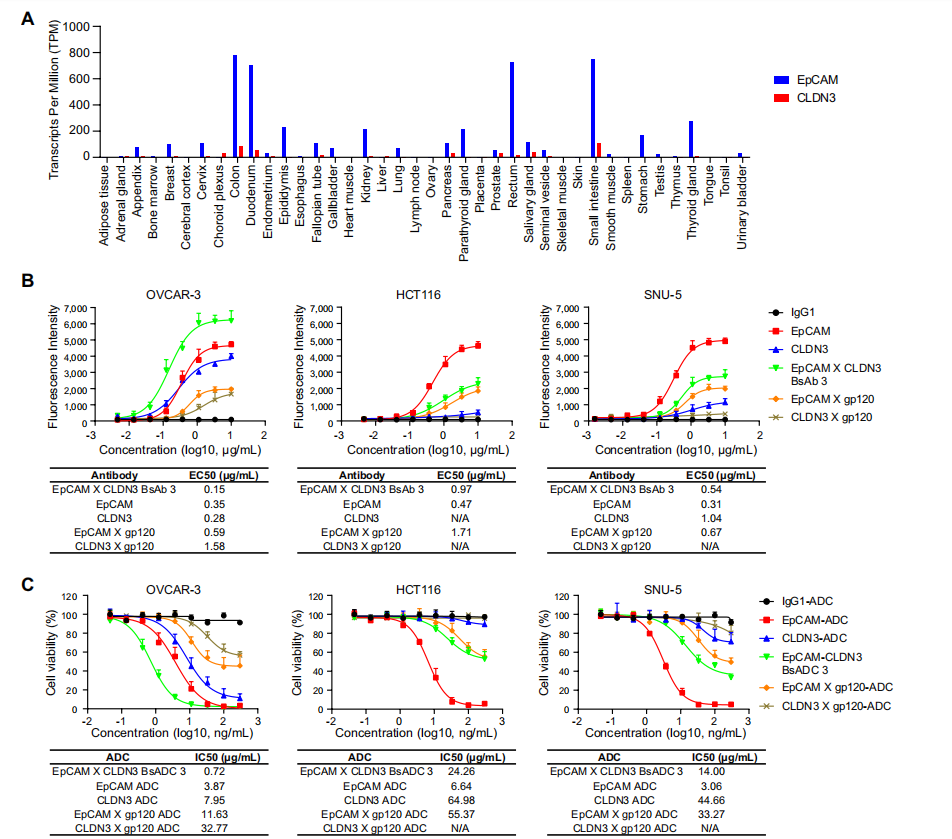
BsADC分子对EpCAM和CLDN3高表达的肿瘤细胞具有较强的结合活性,并且对OVCAR-3细胞表现出比其亲本双价抗体更强的ADCC、ADCP和CDC效应。BsADC分子与EpCAM高表达但CLDN3低表达的HCT116细胞结合较弱,并且对HCT116细胞的ADCC、ADCP和CDC效应也弱于EpCAM亲本双价抗体,因此可能能够最大程度减少对正常组织的毒性副作用。BsAb3对OVCAR-3表现出较高的ADCC、ADCP和CDC活性,而对HCT116的活性相对较低,进一步表明BsAb3可能降低对正常组织的靶外毒性作用,同时保留对肿瘤细胞的细胞毒性作用。
BsADC 3可以对双重高表达的肿瘤细胞保持较高的细胞毒活性,同时降低对EpCAM中度表达的细胞的细胞毒活性,从而有助于扩大临床的治疗窗。
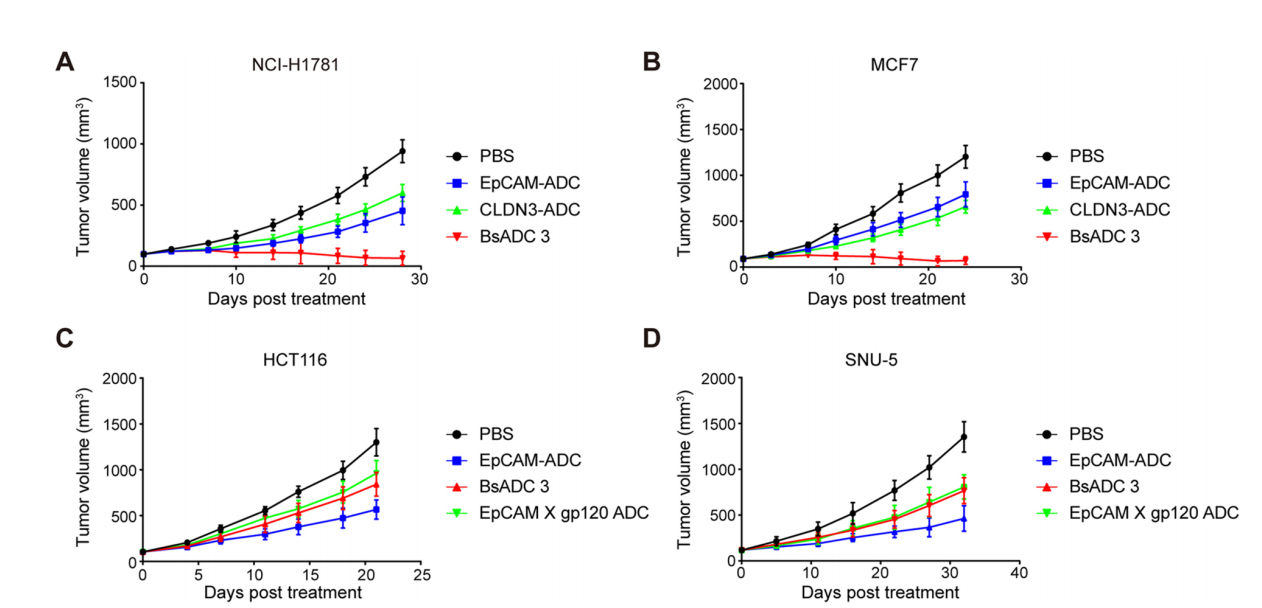
BsADC 3在小鼠模型中具有良好的药代动力学和安全性
BsADC 3具有IgG1动力学和良好的体内稳定性,EpCAM X CLDN3 BsADC 3具有良好的PK和安全性,在治疗EpCAM和CLDN3表达的肿瘤方面具有潜在的应用价值。

总结
BsADCs作为最有效的生物治疗药物之一具有巨大的潜力。构建一个良好的BsADC必须考虑许多关键因素,如靶点选择、格式、结合亲和力和功能活性。合理的目标选择从根本上决定了BsADC的作用机制,是其成功的最关键的一步。CLDN3和EPCAM在多种肿瘤中高表达,CLDN3在正常组织中低表达,使其成为开发抗体治疗的一个有吸引力的靶点。EpCAM X CLDN3 BsADC在体内外治疗多种肿瘤具有良好疗效。BsADC被设计用来增加载荷递送的选择性,增强其内吞作用以提高疗效,最小化非恶性组织毒性风险,并克服肿瘤细胞的逃逸机制。基于BsADC的治疗方法可以彻底改变现有的癌症治疗选择,并在对抗癌症方面取得重大进展。
