背景
肿瘤浸润性调节性T细胞(TI-Treg)是肿瘤微环境(TME)中促进免疫逃逸和推动肿瘤进展的关键成分。尽管目前已有多种治疗方法可清除TI-Treg细胞,但大多数方法的疗效不佳,且存在诱发免疫相关不良事件(irAEs)的风险。最近的研究表明,CC趋化因子受体CCR8在小鼠和人类的效应性TI-Treg细胞上高度特异表达,提示CCR8有望成为选择性清除TI-Treg细胞治疗各种癌症的一个有前景的靶点。

2025年1月30日华中科技大学同济附属医院高庆蕾教授团队在Trends Immunol上发表了一篇名为“CCR8: a promising therapeutic target against tumor-infiltrating regulatory T cells”本文将从CCR8的表达、功能和调控等方面对CCR8的最新研究进展进行综述,并总结CCR8靶向治疗的研究现状。后者具有良好的疗效和安全性,代表了下一代推定癌症免疫疗法的重要类别。
CCR8的表达
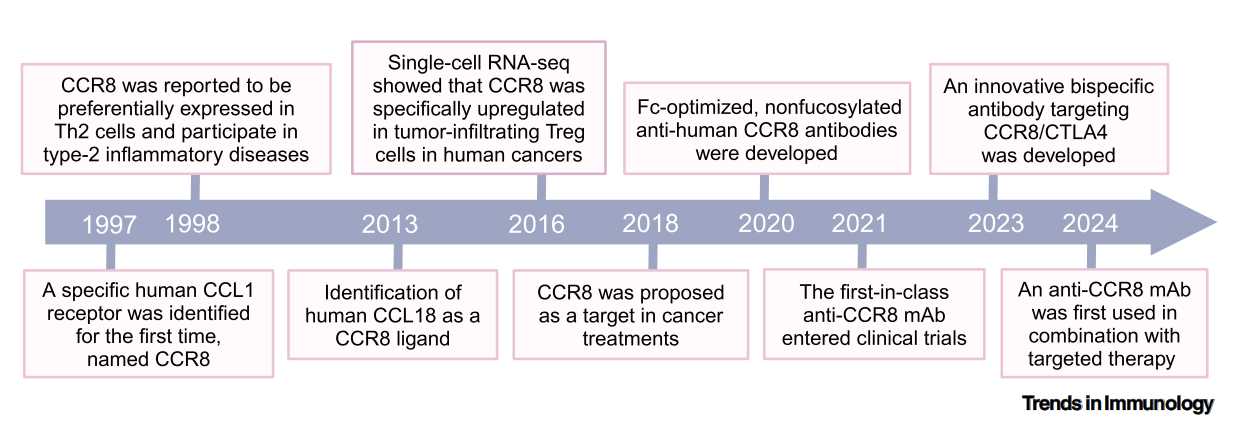
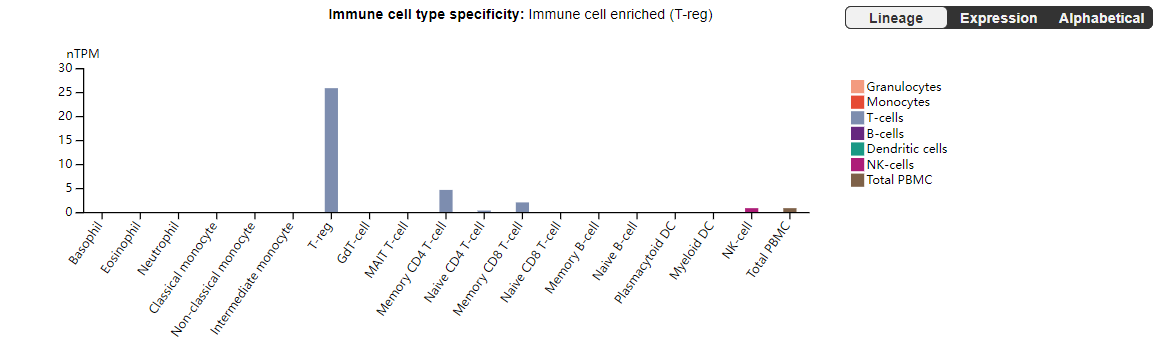
CCR8最早于1997年在单核细胞和胸腺中被鉴定,之后被证明在CD4+辅助性T(Th)2细胞上表达,除此之外,在NK细胞上也检测到CCR8的表达。最近,通过单细胞RNA测序(scRNA-seq)分析的人类肿瘤样本显示,在人类乳腺癌、结直肠癌和非小细胞肺癌中,CCR8表达特异性上调的TI-Treg细胞中。
(数据来源 uniprot)
CCR8的结构
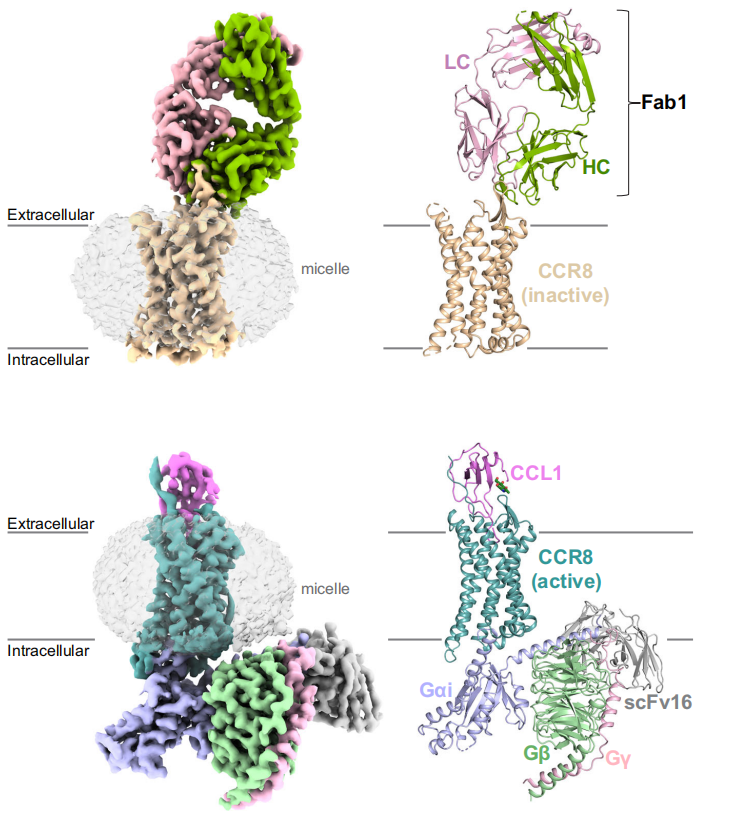
CCR8是一种7次跨膜蛋白,由7次跨膜结构域,N端胞外区,C端胞内区组成。在七次跨膜结构域之间存在三个胞外环(ECL1、ECL2、ECL3)和三个胞内环(ICL1、ICL2、ICL3)。ECL2在CCR8的配体结合中起着关键作用,是抗体识别的主要位点之一;ICLs则参与受体的信号传导和构象变化。CCR8是一种G蛋白偶联受体,CCR8被内源性CC基序趋化因子配体1(CCL1)激活,并与抑制性信号传导蛋白GI偶联。当CCL1与CCR8结合后,CCR8发生构象变化,导致Gi蛋白的α亚基(Gαi)与受体结合。Gi蛋白的α亚基通过其C末端的α5螺旋与CCR8的跨膜结构域形成极性相互作用和疏水相互作用;同时,Gi蛋白的β和γ亚基(Gβ和Gγ)与CCR8的胞内环和C端结构域相互作用,进一步稳定复合物。Gαi的结合导致其GDP被GTP取代,从而激活Gαi,进而抑制腺苷酸环化酶的活性,减少cAMP的生成,从而改变细胞内的信号传导。
(数据来源 Sun D, et al. Nat Commun. 2023)
CCR8的功能
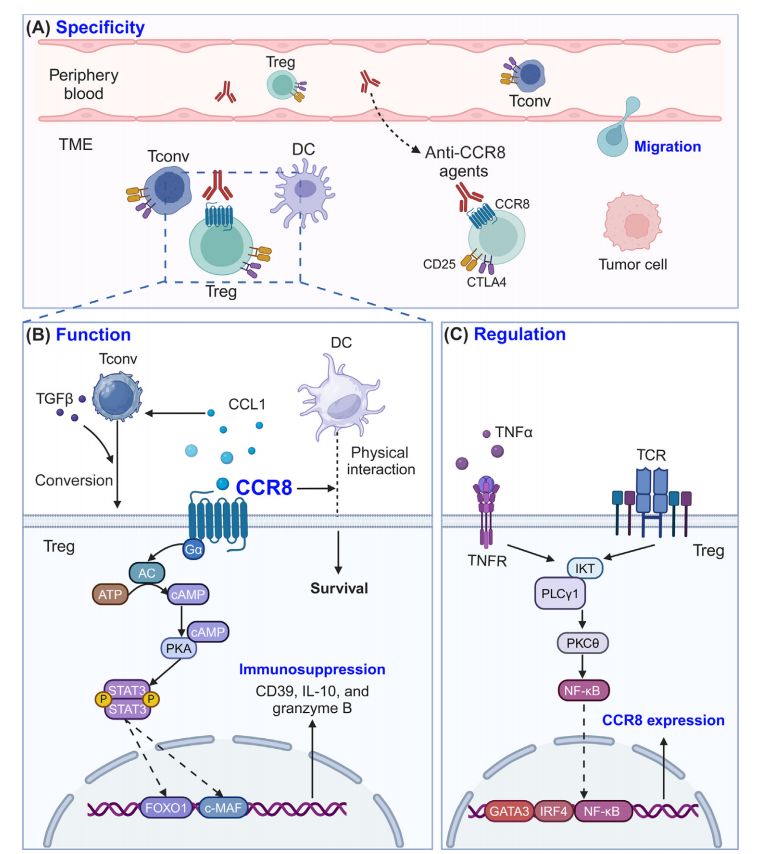
人CCR8是一种具有CCL1、CCL8、CCL16和CCL18四种配体的趋化因子受体。CCR8在肿瘤浸润性T调节(TI-Treg)细胞上高表达,抗CCR8药物可以特异性靶向CCR8高表达的TI-Treg细胞。CC趋化因子配体1(CCL1)- CCR8调控Treg细胞迁移和募集到肿瘤微环境(TME),以STAT3依赖的方式影响Treg细胞的免疫抑制功能,并通过与树突状细胞(DC)的物理相互作用促进Treg细胞存活。非Treg CD4+T细胞上的CCL1-CCR8能够以转变生长因子(TGF)-β依赖的方式将常规T细胞转化为Treg细胞。T细胞受体(TCR)和肿瘤坏死因子受体(TNFR)2介导的NF-κb信号可以调节Treg细胞上CCR8的表达。
抗CCR8药物的进展
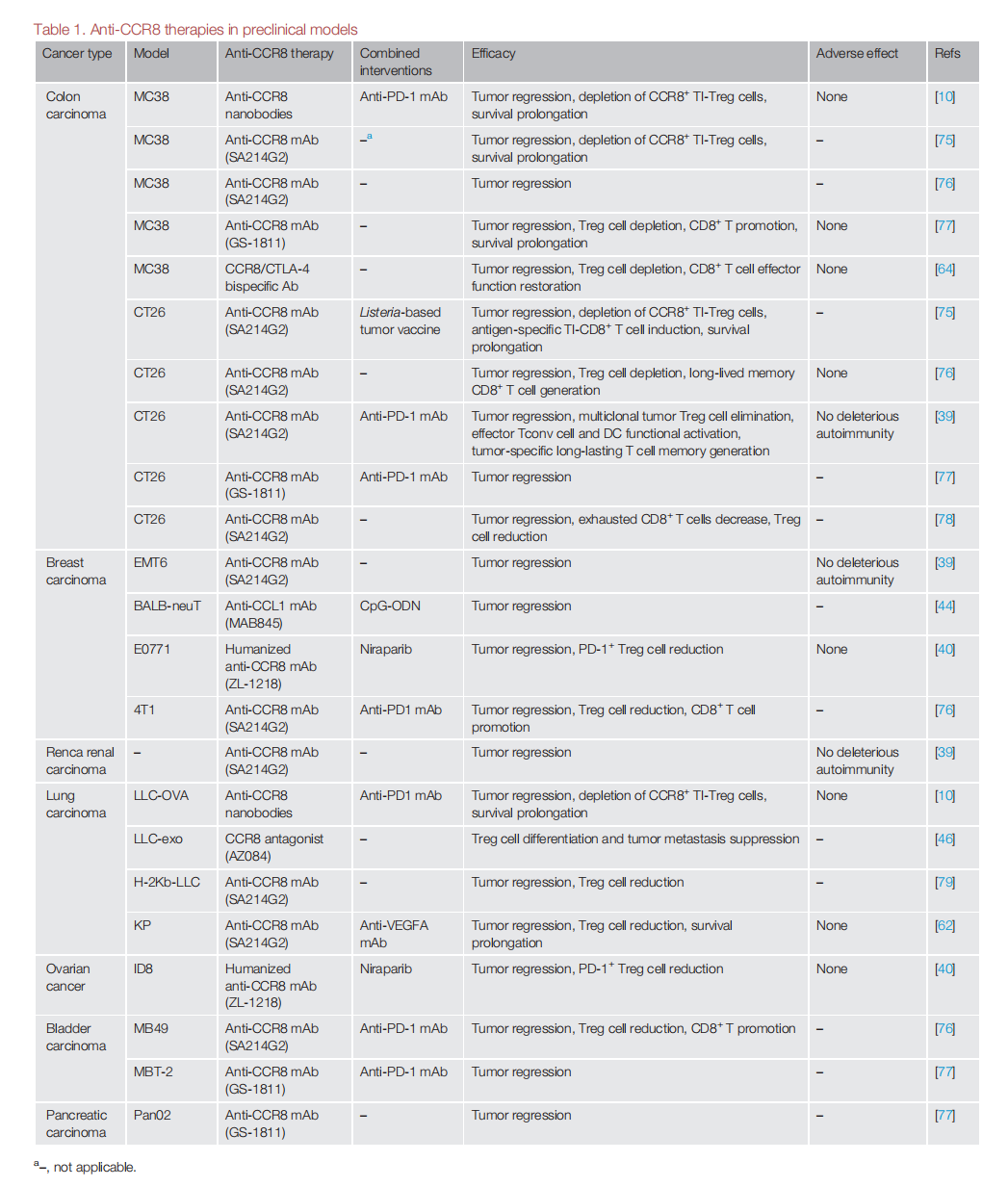
由于TI-eTreg细胞中CCR8表达较高,使用抗CCR8药物可以有效靶向TI-Treg细胞,同时对Tconv和外周Treg细胞的影响最小。抗CCR8药物能清除eTreg细胞,减轻CD8+细胞毒性T淋巴细胞(CTLs)的衰竭,促进肿瘤特异性记忆Tconv细胞的发育,激活树突状细胞(DCs),并与其他针对Treg细胞的策略相比引发较少的自身免疫反应。多种针对CCR8的治疗方法正在开发中,包括单克隆抗体、拮抗剂和双特异性抗体等。
抗CCR8药物可以与其他癌症疗法联合治疗,抗CCR8单克隆抗体可能通过清除Treg细胞,使冷肿瘤转化为热肿瘤,从而增强对抗PD-1单克隆抗体的敏感性。CCR8抗体联合PD-1或VEGF药物可以产生协调抗肿瘤作用,且无明显不良反应。
在CT26荷瘤结直肠癌小鼠模型中,抗CCR8 mAb治疗显示促进肿瘤特异性CD8+T细胞的扩增,并诱导持久的记忆反应,显著提高PD-1阻断的治疗效果。在接受抗PD-1单抗治疗的癌症患者中,约有15%的肿瘤生长加速,这种现象被称为超进展性疾病(HPD),其部分原因是Treg细胞活性增强以及Treg和Tconv细胞比例失衡。同时使用抗CCR8药物损害Treg细胞可能减少HPD。
抗CCR8 /CTLA-4双特异性抗体GBD201不仅通过增强ADCC诱导Treg细胞清除,而且通过阻断CCL1-CCR8信号通路抑制Treg细胞迁移。相比单独的抗CCR8和CLTA-4单克隆抗体具有完全的阻断活性和强大的结合特性,具有相似或更好的体内肿瘤生长抑制作用。
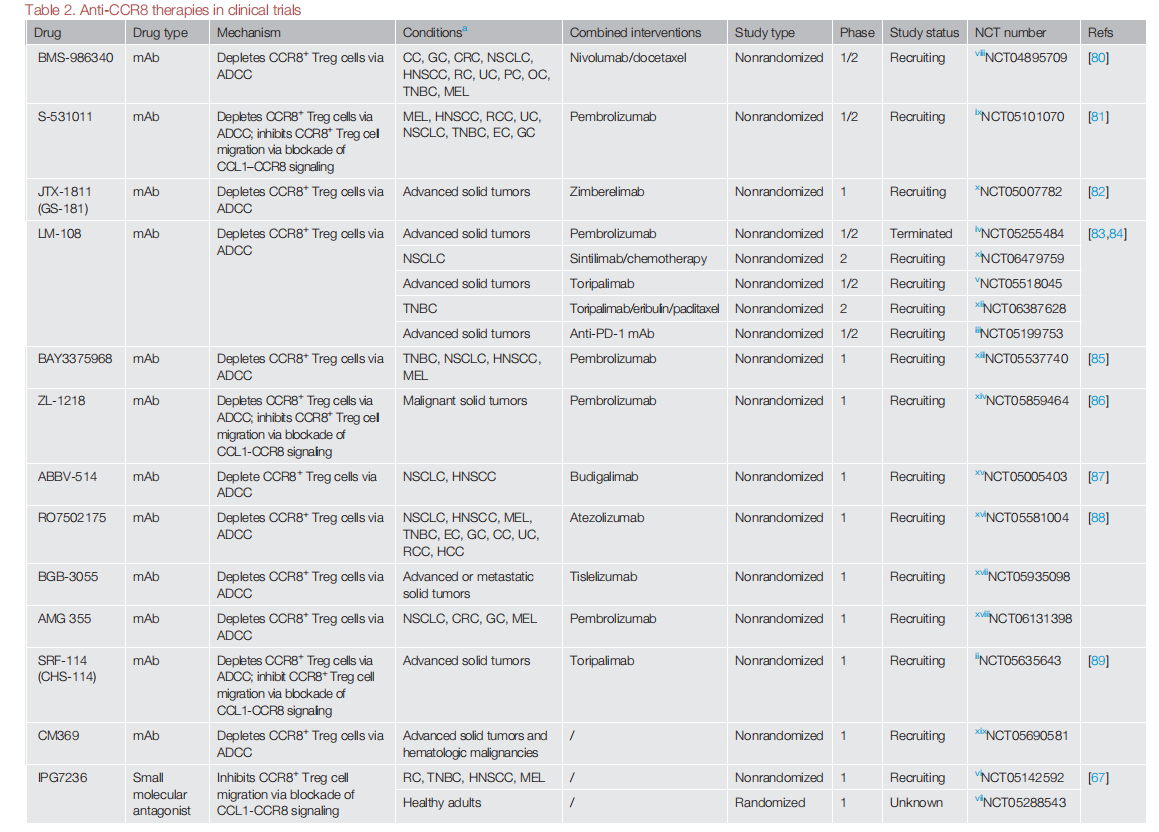
抗CCR8单克隆抗体有许多已进入1/2期临床试验,SRF114(一种抗CCR8单抗)(NCT05635643)的1期剂量递增试验最近报告了其在15例晚期实体瘤患者中去除CCR8+Treg细胞的安全性和稳健效应的初步结果。
对抗CCR8单抗(LM-108)(NCT05199753、NCT05255484和NCT05518045)的三项首次人体剂量递增阶段1/2试验结果进行的汇总分析报告,在36例胃癌患者中,LM-108联合抗PD-1单抗具有令人鼓舞的抗肿瘤活性(ORR: 36.1%,p < 0.001)。疾病控制率(DCR):72.2%;中位无进展生存期:6.53个月),尤其是在抗PD-1单抗治疗耐药的11例患者中(ORR: 63.6%;Dcr: 81.8%)。
总结
CCR8在TI-Treg上高表达,抗CCR8药物显示出良好的抗肿瘤疗效,同时最大限度地减少了靶内/非靶毒性。但是它也面对了挑战,例如靶向CCR8作为抗肿瘤治疗可能会产生一些副作用,例如皮肤相关的irae,加重正在进行的自身免疫性疾病。CCR8在不同肿瘤类型中的表达差异,以及TME中有关CCR8表达的多种因素的影响。这表明需要我们进行全面评估,以评估抗CCR8疗法在不同癌症中的潜在差异疗效。抗CCR8药物的临床评估仍处于起步阶段,需要在更大规模的临床试验中进行进一步评估。CCR8已成为实体瘤中针对TI-Treg细胞的一个有前景的治疗靶点,而抗CCR8药物代表了下一代肿瘤免疫疗法的一个重要家族。
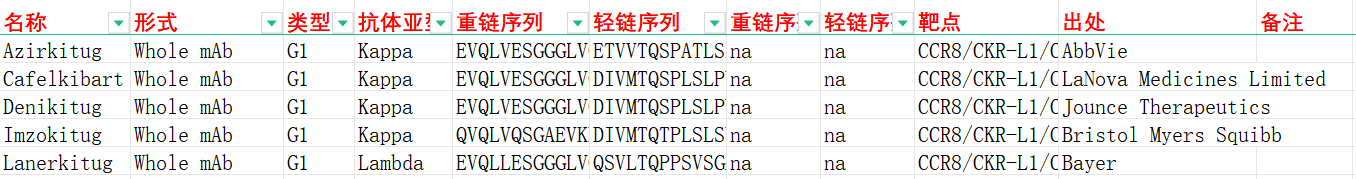
我们收集整理一批CCR8相关抗体序列信息。文档可关注公众号“迈思生物”,号内回复“CCR8”下载。