糖类抗原CA125,又称粘蛋白16(MUC16),是一种由MUC16基因编码的糖蛋白,表达于卵巢上皮性肿瘤和其他各种苗勒氏管起源的病理和正常组织中,并可在血清中检测到。它是最常用的卵巢癌标志物,主要用于卵巢癌,特别是上皮性卵巢癌的辅助诊断,也可作为绝经后妇女良,恶性盆腔肿瘤的鉴别诊断指标。
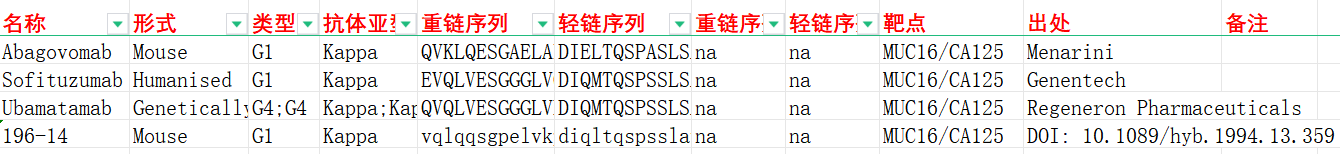
CA125的结构
MUC16是一种分子量在300-500万Da之间的跨膜粘蛋白,黏液糖蛋白MUC16由三个区域组成:C端结构域、串联重复序列(TR)区域和N端结构域。C端结构域是MUC16最小的部分,在跨膜结构域附近含有283个氨基酸,多项研究揭示了其致癌潜力。TR区域,被称为CA125,占据了MUC16的大部分,由近60个重复组成。没有完全相同的重复序列,但所有重复序列都在第59位和第79位含有两个保守的半胱氨酸,这被认为对维持粘蛋白结构具有关键作用。N端结构域是离膜最远的结构域,由12068个氨基酸组成,具有丰富的糖基化潜在位点,如O-链糖基化和N-链糖基化。
(数据来源ZhangM, et al. Biochim Biophys Acta Rev Cancer. 2021)
CA125诱发肿瘤发生和转移的机制
CA125的结合糖蛋白是一种间皮素,CA125与GPI连接的间皮素相互作用启动癌细胞黏附到间皮上皮,促进卵巢癌腹膜转移。CA125与siglec-9等抑制性受体结合,下调CD16等激活性受体,抑制免疫应答和ADCC。CA125除了通过与间皮素的相互作用和下调免疫系统的作用在转移中发 挥作用外,CA125还有直接致癌的作用。CA125通过P13K/Akt依赖途径促进蛋白质合成并抑制卵巢癌细胞凋亡。β-Catenin参与细胞粘附和多细胞聚集体的形成,多细胞聚集体是肿瘤转移的载体;抑制GSK-3β介导的磷酸化可抑制β-catenin的表达。MUC16通过激活Rho GTPase诱导p120ctn向细胞质转运,促进卵巢癌细胞的增殖和迁移。

(数据来源ZhangM, et al. Biochim Biophys Acta Rev Cancer. 2021)
CA125的治疗策略
单克隆抗体靶向CA125:Oregovomab是一种对CA125具有高亲和力的鼠单克隆抗体,可刺激宿主对表达CA125的肿瘤细胞产生细胞毒性免疫反应。它被研究作为晚期卵巢癌患者的维持一线治疗和复发性疾病的治疗选择。
疫苗接种:使用模拟CA125结构和功能的抗独特型单克隆抗体(如abagovomab)进行疫苗接种,诱导机体产生针对CA125的主动免疫反应。
双特异性抗体:开发双特异性抗体,如REGN4018,可以同时结合CD3和MUC16(CA125)。这种抗体可以通过激活CD3+T细胞来促进对高MUC16表达的卵巢癌细胞的免疫清除。
CAR-T:MUC16-CTD修饰的CAR - T细胞分泌IL-12,不仅表现出增强的肿瘤定向细胞溶解,而且促进内源性免疫系统突破CAR T治疗对实体恶性瘤的限制。

(数据来源ZhangM,etal.BiochimBiophysActaRevCancer.2021)
我们收集整理一批CA125相关抗体序列信息。文档可关注公众号“迈思生物”,号内回复“CA125”下载。