CD59是一种膜结合蛋白,是膜攻击复合物抑制因子(MACIF)。通过结合组装膜攻击复合物(MAC)的C8和C9补体起作用,从而阻止渗透孔完全形成所需的C9的多个拷贝的结合。这种抑制剂似乎具有物种特异性。参与T细胞活化与蛋白酪氨酸激酶的信号转导。CD59是人类细胞上唯一的MAC膜结合抑制剂,也是抵抗补体末端途径激活的最后一道防线。

(数据来源 Couves EC, et al. Nat Commun. 2023)
CD59分布:
CD59主要在细胞膜上表达,存在多种类型的细胞中,主要存在红细胞,单核细胞,内皮细胞,神经元等细胞中,参与多种生理和免疫过程。
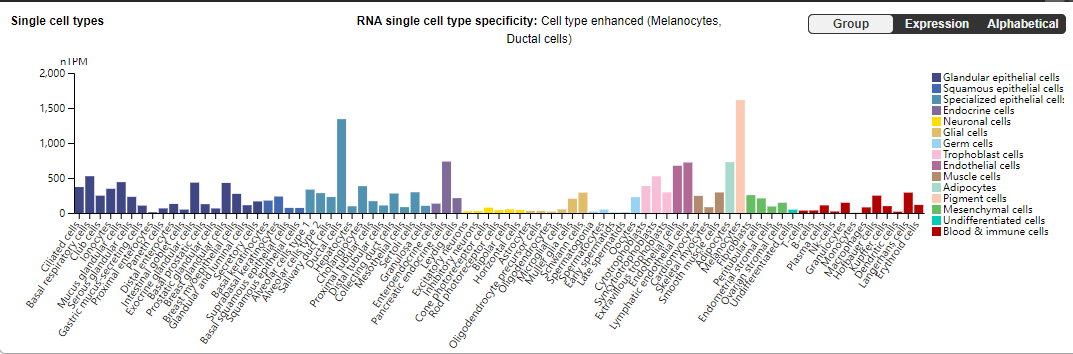
(数据来源 the uniprot)
CD59结构:
CD59是一个由基因CD59编码的糖基磷脂酰肌醇锚定的膜蛋白。CD59是一个相对扁平的、具有高度紧密空间结构的圆盘状分子,由3个串联的β折叠片、5个突出于表面的环以及1个短的α螺旋组成。这种独特的结构使得CD59能够有效地抑制补体激活,从而保护细胞免受补体介导的攻击。
CD59抑制膜攻击复合物的结构基础:CD59通过与补体蛋白C8和C9结合在细胞膜上,阻止膜攻击复合物(MAC)孔的插入和聚合,从而抑制MAC的形成。CD59与C8结合抑制膜攻击复合物的结构基础包括CD59与C8的TMH2的主导β链结合,形成连续的反平行β-折叠,CD59的C端β链与C8的MACPF结构形成连续的反平行β-折叠,CD59的芳香族残基填充了C8的TMH2结构中的空隙,影响了C8的结构弯曲和膜插入位置。
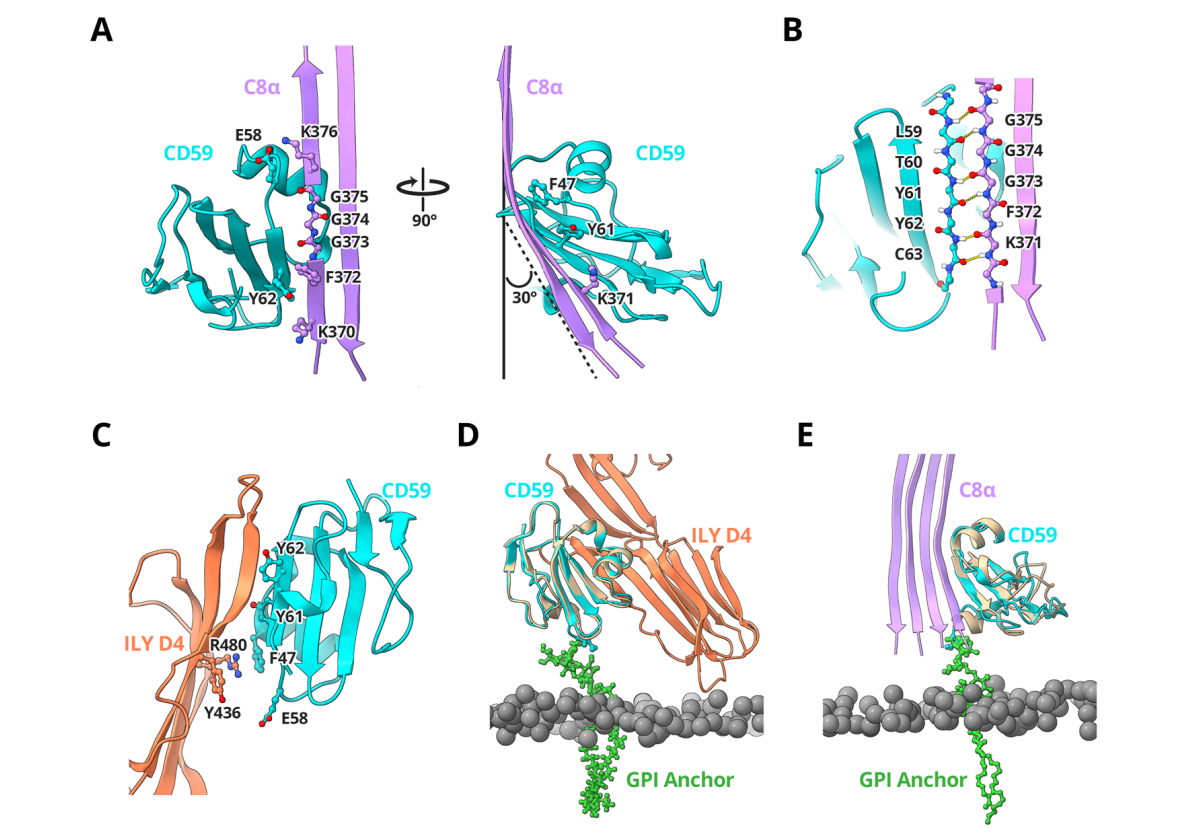
(数据来源 Couves EC, et al. Nat Commun. 2023)
当与C8结合时,CD59通过捕获C9的延伸β-发夹,阻止其穿过脂质双层,从而阻止膜插入和聚合。CD59与C9结合的机制类似于CD59与C8结合的方式,通过捕获C9的延伸β-发夹来防止其穿过脂质双层。阻止C9的插入会限制后续单体的结构转变并间接停止MAC聚合。

(数据来源 Couves EC, et al. Nat Commun. 2023)
CD59与疾病的关系:
CD59与阵发性睡眠性血红蛋白尿症(PNH)
阵发性睡眠性血红蛋白尿症(PNH)是一种罕见的血液病,其特征是溶血、凝血和骨髓衰竭。CD55和CD59缺乏而导致PNH红细胞补体异常激活。补体激活的经典、凝集素和替代途径导致C3转化酶的形成,将C3裂解为C3a和C3b,从而导致C5转化酶的形成,将C5裂解为C5b,从而激活末端补体成分并形成膜攻击复合物(MAC)。在正常红细胞(RBC)中,GPI 锚定表面蛋白CD55和CD59分别通过阻断C3转化酶和膜攻击复合物来抑制补体激活。在缺乏CD55和CD59的情况下,GPI缺陷的PNH RBC会出现不受控制的补体激活和裂解。这表明CD59在PNH的发病机制中发挥重要的作用,CD59可以作为PNH疾病诊断的重要靶标。

(数据来源 Colden MA, et al. Front Immunol. 2022)
CD59与糖尿病
CD59在糖尿病发展中起到了多种作用。研究表明,CD59在糖尿病患者中由于持续高血糖导致的糖基化而失活,这会导致细胞内信号通路的激活,释放出促炎和促凝血细胞因子,以及生长因子,从而损害多种蛋白质的功能。此外,CD59在胰岛中的表达量下调与糖尿病相关,这可能影响胰岛素的分泌。CD59的下调会显著降低胰岛素分泌的能力,进而影响血糖水平的调节。CD59的下调通过影响与胰岛素释放相关的SNARE蛋白复合物的相互作用,进一步减少了胰岛素颗粒与细胞膜之间的融合事件,从而降低了胰岛素的释放。

(数据来源 Blom AM. J Intern Med. 2017)
CD59与肿瘤细胞
CD59在各种癌细胞系和肿瘤组织中高表达,影响肿瘤微环境中免疫细胞的功能和表型。肿瘤细胞和免疫细胞之间的关系与CD59密切相关。CD59在肿瘤细胞表面的表达可以保护肿瘤细胞免受免疫攻击,通过阻止膜攻击复合物(MAC)的形成来发挥作用。CD59的过表达可以有效增强肿瘤细胞对补体系统溶解的抵抗力,从而保护肿瘤细胞免受免疫系统的攻击。此外,CD59的沉默可以增强补体介导的肿瘤细胞凋亡,进而抑制肿瘤生长。免疫细胞如NK细胞、巨噬细胞和T细胞可能通过与CD59的相互作用来调节其活性,影响肿瘤细胞的免疫逃逸和生长。靶向CD59是一个很有潜力的肿瘤免疫治疗策略。
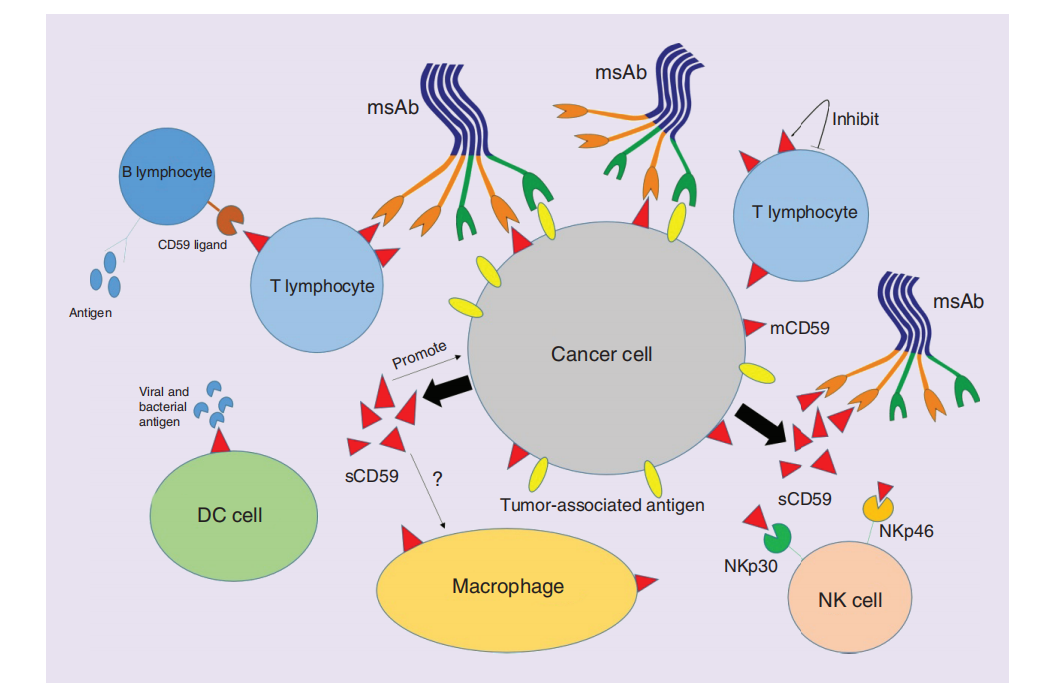
(数据来源 Zhang R, et al. Future Oncol. 2018)
我们收集整理一批CD59相关抗体序列信息。文档可关注公众号,号内回复“CD59”下载。

