背景
传统的癌症治疗手段包括手术、化疗和放疗,这些方法往往针对性较差,在杀死肿瘤细胞的同时,也会损伤正常细胞,从而产生一系列的副作用。单克隆抗体是肿瘤靶向治疗的有力工具,但是由于单克隆抗体分子较大(约150kDa),限制了它们进入致密肿瘤组织中的隐蔽表位,并可能损害治疗效果。此外,单克隆抗体的半衰期较长可能导致安全问题,进一步限制其在成像或放射免疫治疗等领域的应用。单域抗体(sdAbs)最初在骆驼科动物或鲨鱼中发现,通常称为纳米抗体或VNAR,已成为传统治疗性抗体的有前途的替代品。这些sdAbs具有许多优异的物理化学和药理学特性,包括体积小、溶解性和热稳定性好、表位更容易接近以及组织穿透性强。sdAbs的动物来源所固有的挑战限制了它们在临床上的使用。近年来,已经开发出各种创新的人源化技术,包括互补决定区(CDR)移植或全人源sdAbs的完全工程化,以减轻潜在的免疫原性问题并增强其兼容性。

2024年7月3日研究人员在Acta pharmaceutica Sinica. B上发表了一篇名为“Single-domain antibodies as therapeutics for solid tumor treatment”的文章。该文章对sdAbs进行了全面的探讨,强调了它们的独特特点和人源化方法的进展。概述了基于sdAb的药物和治疗策略开发的最新进展及其在实体肿瘤治疗中的潜力,例如sdAb-药物偶联物、多特异性sdAb、基于sdAb的递送系统和基于sdAb的细胞疗法。
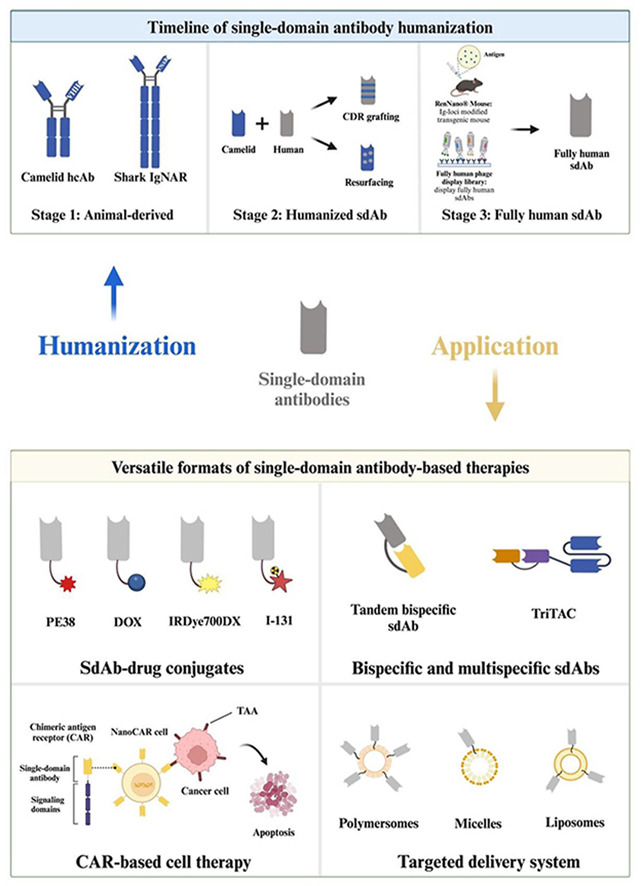
单链抗体的人源化和全人源化单链抗体
抗体人源化是指抗体可变结构域的FR中异种序列被人类序列取代鼠源抗体人源化的成功为单链抗体人源化铺平了道路。sdAb的人源化主要采用两种策略,包括CDR移植和表面重塑,CDR移植是将精心挑选的异种抗体CDR移植到人类FR中的过程,而表面重塑是通过将非人类抗体唯一暴露在表面的FR残基替换为人类抗体FR中的相应残基来实现的。

全人抗体是一类完全由人类自身序列组成的抗体。由于不存在其他异质序列,全人抗体被认为是非免疫原性的,不需要人源化,适合长期用作体内治疗剂,尤其是在治疗不同类型的癌症方面。目前已开发出多种方法来产生全人抗体,例如噬菌体展示技术,单B细胞筛选,另一种产生全人抗体的重要方法是使用免疫球蛋白(Ig)位点修饰的转基因小鼠。将小鼠的Ig基因替换为人类的基因,这些转基因小鼠在免疫目标抗原后可以产生全人抗体。随着结构生物学的快速发展和大量蛋白质结构数据的出现,基于计算的抗体人源化方法也已通过同源性建模或人工智能(AI)被设计出来,用于生成人源化甚至完全人源抗体。
单域抗体在实体肿瘤治疗中的多种形式
sdAb具有体积小、稳定性好等显著特点,易于工程化,因此非常适合与其他蛋白和效应域融合,可同时作用于肿瘤部位,以获得更好的治疗效果。根据抗体修饰策略不同及与sdAb偶联的不同融合部分,抗肿瘤sdAb主要可分为以下几类:通过将单链抗体与毒素、多肽和化学物质融合而形成的单链抗体-药物偶联物;具有不同抗原结合位点的多特异性单链抗体;使用纳米载体的单链抗体递送系统,以及基于单链抗体的细胞疗法,例如嵌合抗原受体(CAR)-T细胞疗法。

基于单克隆抗体的药物偶联物
由于传统ADC的分子量较大,阻碍了其在实体肿瘤治疗中的应用,基于单链抗体的药物偶联物也称为纳米抗体-药物偶联物(NDC),是ADC由吸引力的替代品。与ADC类似,NDC可以通过智能接头将细胞毒性有效载荷与高亲和力单链抗体偶联,从而选择性杀死肿瘤细胞。由于单链抗体分子尺寸小,NDC能够以高亲和力结合抗原,并识别抗原上独特的隐藏表位,从而减少脱靶效应。这些优势拓宽了单链抗体在实体肿瘤治疗中的应用,使其能够与多种类型的药物(如毒素、化疗化合物、光敏剂和治疗性放射性核素)联合使用。目前已有许多用于治疗实体肿瘤的已获批准或处于中后期临床试验的单克隆抗体药物。
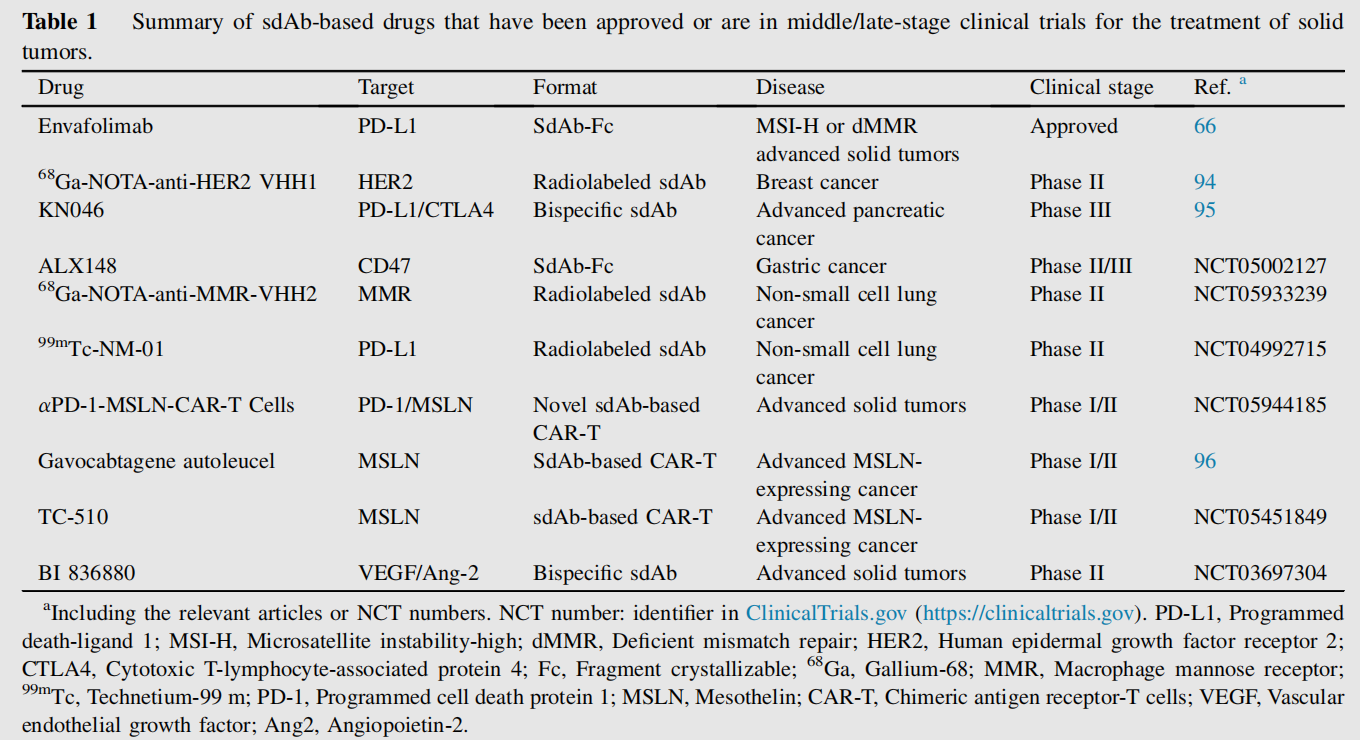
双特异性和多特异性单克隆抗体
由于sdAb的尺寸很小,因此只需通过连接肽与其他抗体进行基因融合,即可轻松将其设计成双特异性或多特异性形式。这种基于sdAb的双特异性抗体(称为bsNbs)通常表现出优越的特性,包括稳定性、良好的溶解性和出色的生产产量,为治疗实体肿瘤开辟了一条新途径。2022年全球首个基于sdAb的双特异性抗体Ozoralizumab的上市标志着一个重要的里程碑,开启了bsNbs的新时代。双特异性单克隆抗体串联形式虽然体积小、易于制备,但其较短的半衰期成为其应用的障碍。延长其半衰期的一种可行方法是与另一种针对新生儿Fc受体(FcRn)或人血清白蛋白(HSA)的抗体偶联,以生成多特异性单克隆抗体。

(数据来源Tanaka Y. Expert Opin Biol Ther. 2023)
基于单克隆抗体的靶向递送系统
纳米粒子(NPs)是一类粒径小于200纳米的固体胶体粒子,主要包括脂质体、胶束、白蛋白基纳米粒子和聚合物纳米粒子。在基于纳米颗粒的靶向递送系统中,所有纳米颗粒都依赖于表面的靶向配体来实现足够的特异性。由于单链抗体体积小,且无Fc结构域,因此适合修饰在纳米颗粒表面。利用基于单链抗体的靶向递送系统,可以保护载药药物免受氧化还原和酶促反应的影响,从而维持局部药物浓度处于较高水平。此外,这些系统可以最大限度地降低免疫原性并避免药物的潜在副作用,从而提高治疗效果。
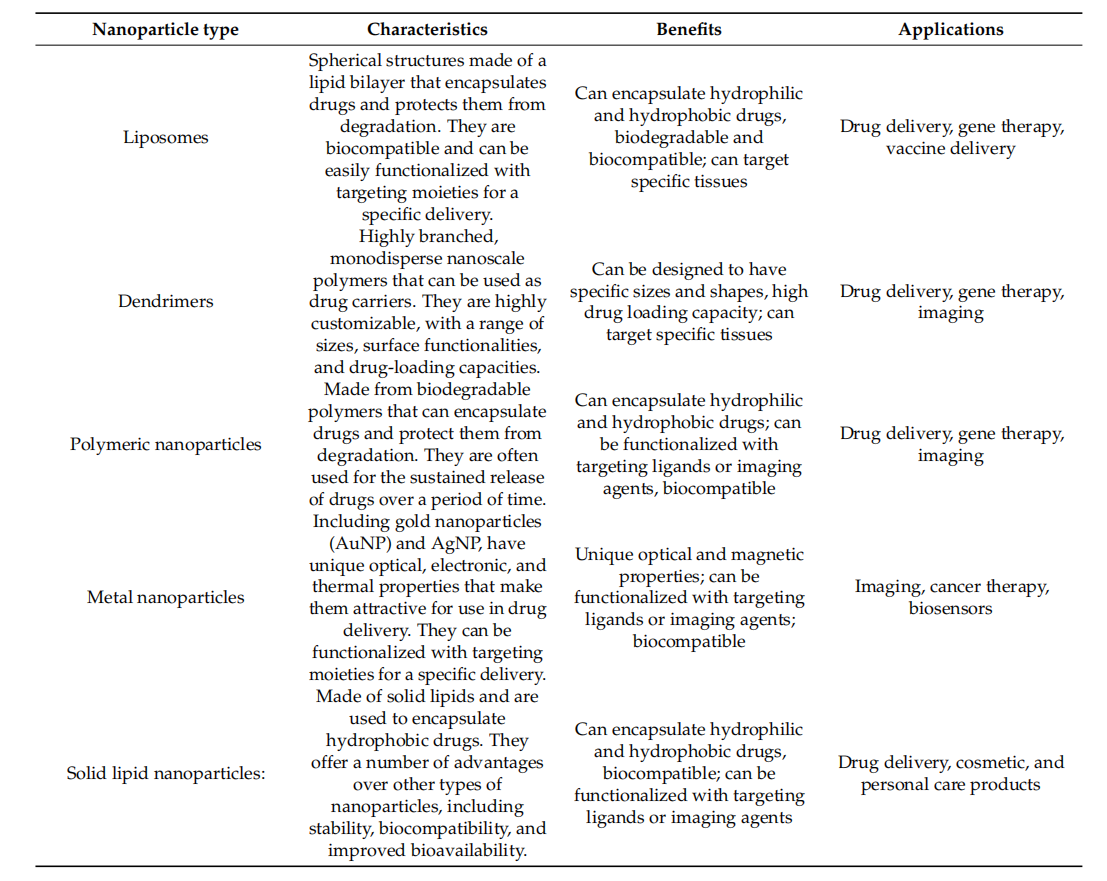
(数据来源 Yusuf A, et al. Polymers (Basel). 2023.)
基于单链抗体的CAR-T细胞疗法
CAR-T细胞通过靶向结构域(通常是scFv)识别其靶抗原,并通过胞内激活结构域(通常是CD3ζ)和共刺激结构域(4-1BB,CD28,OX40)激活。一些研究表明,scFvs潜在的免疫原性和不稳定特性可能会限制抗CAR免疫反应的临床疗效,并导致T细胞过早衰竭。由于sdAb的稳定性和低免疫原性,目前已有大量基于sdAb的CAR-T细胞被制备出来,并且表现出与传统CAR相同的功能。大量实体瘤相关抗原(TAA)已被用作基于sdAb的CAR-T细胞的靶标,例如HER2和MUC1。Ciltacabtagene autoleucel(cilta-cel,也称为Carvykti™)是一种基于sdAb的抗B细胞成熟抗原(BCMA)CAR-T细胞产品,经FDA批准用于治疗复发或难治性多发性骨髓瘤。
总结与展望
基于sdAb的药物和治疗策略开发在实体肿瘤治疗中具有很大的潜力,例如sdAb-药物偶联物、多特异性sdAb、基于sdAb的递送系统和基于sdAb的细胞疗法。随着合成免疫学和人工智能技术的发展,全人源sdAbs的发现和优化过程有望进一步加速,为实体肿瘤治疗带来更多创新和有效的治疗方法。
