蛋白质-蛋白质相互作用(PPI)在生物体功能中发挥重要作用,参与细胞周期调控,信号转导等细胞生物学过程。传统的分析PPI的检测方法有免疫共沉淀(Co-IP)、GST,Pull-Down,但是他们的检测是体外检测,不能真实反应细胞内蛋白质之间的相互作用。而新发展的邻近标记技术(PL)可直接在自然条件下的活细胞内进行,有利于捕获体内瞬时发生或微弱的蛋白互作关系。在蛋白质互作中起作用,在转录组、蛋白质组空间动态及组蛋白修饰上,亚细胞定位,药物靶标的发现也有重要的应用。邻近标记(PL)方法与基于质谱(MS)的定量蛋白质组学相结合已成为表征PPI的有力方法。
邻近标记技术原理
邻近标记技术(PL)使用工程化酶,例如过氧化物酶或生物素连接酶,它们在基因上标记到目标蛋白(POI)。PL 酶将惰性小分子底物转化为短寿命反应性物质,它们从酶活性位点扩散出去,共价标记邻近的内源性物质。底物分子通常包含一个生物素手柄,以便随后使用链霉亲和素珠富集标记物种,并通过质谱法(蛋白质)或核酸测序(RNA)鉴定它们。
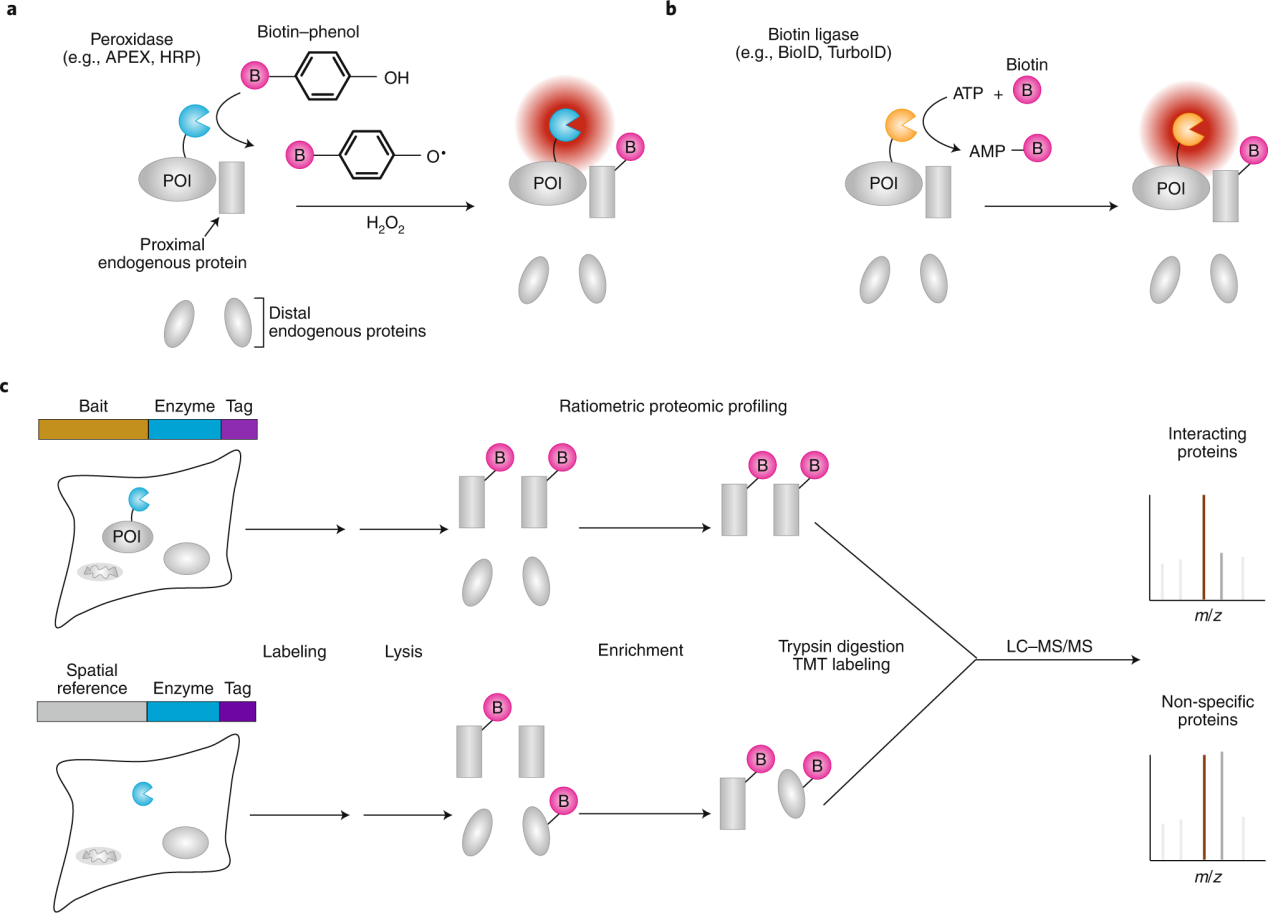
(数据来源 Qin W, et al. Nat Methods. 2021.)
邻近标记方法的类型和发展
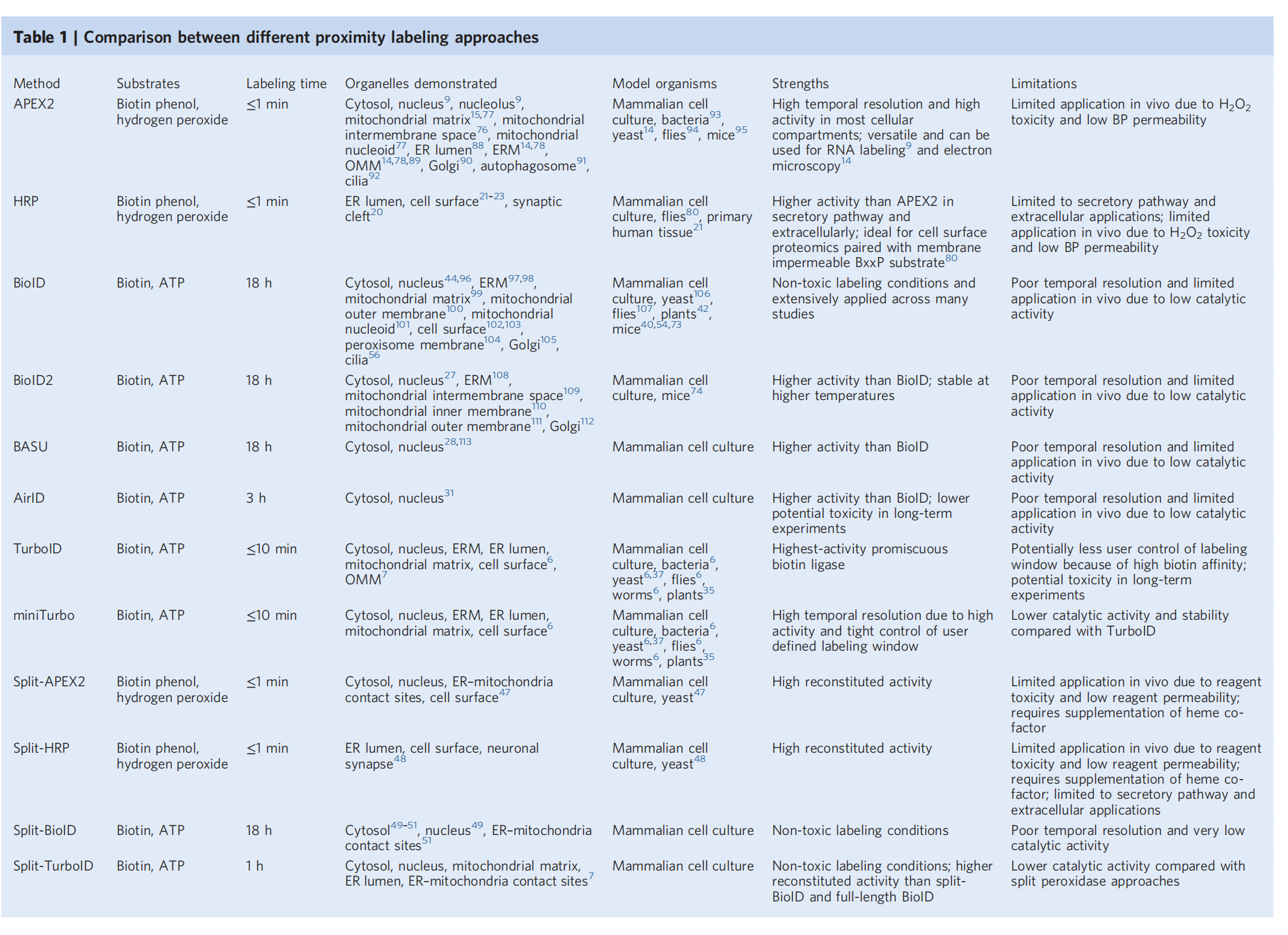
邻近标记方法主要有两大类,过氧化物酶标记法(例如APEX,APEX2,Split-APEX2)和生物素标记法(例如BioID、TurboID、miniTurbo、Split-TurboID)。
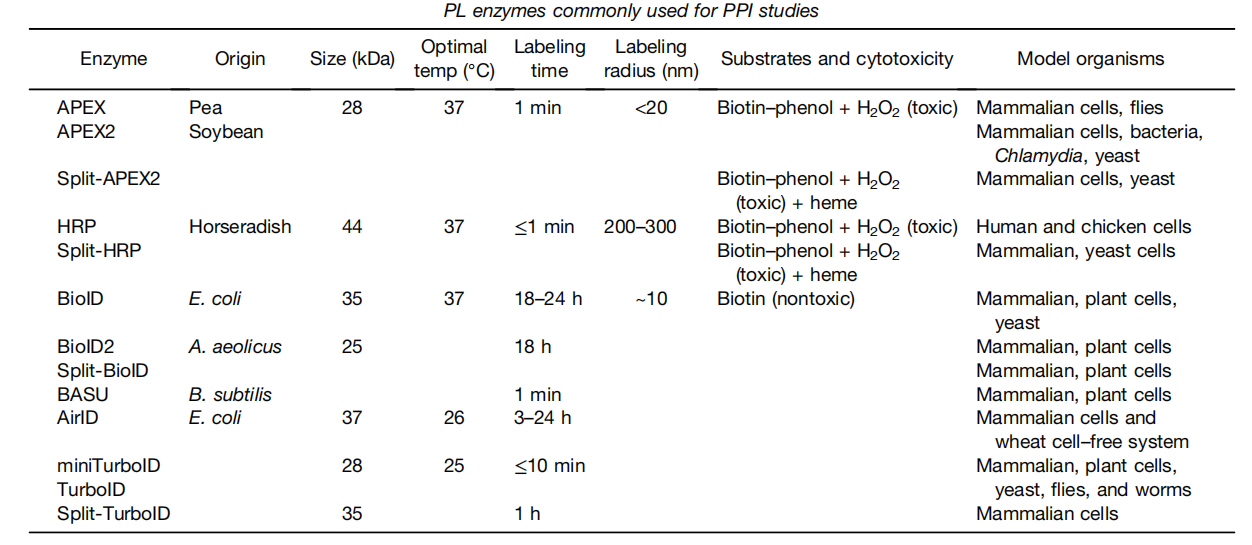
(数据来源 Mathew B, et al. Mol Cell Proteomics. 2022.)
基于生物素连接酶的邻近标记
BiolD系列的邻近标记
BiolD:是一种利用大肠杆菌生物素连接酶BirA的变体,分子量为35 kDa,BioID能够共价标记10nm半径内蛋白质上的赖氨酸残基。鉴于BioID的大分子量阻碍了其在某些融合蛋白中的靶向性,并且需要较长的标记时间。
BioID2:Kim等人在2016年开发了一种名为BioID2的较小酶,分子量为27 kDa,来源于Aquifex aeolicus。与BioID相比,BioID2具有更高的选择性靶向融合蛋白,需要较少的补充生物素,并且表现出对邻近蛋白质的增强标记的优势。BioID2不仅提高了蛋白质与蛋白质相互作用的筛选效率,而且还允许特异性调节生物素标记半径。
TurboID 系列的邻近标记
TurboID :2018年基于酵母展示的BirA定向进化开发了新的PL酶TurboID(35 kDa),TurboID有15个突变碱基对,使其能够利用ATP将生物素转化为生物素-AMP,这是一种反应性中间体,随后共价标记附近的蛋白质。它是生物活性最高的生物素连接酶,它可以利用某些细胞和生物体内的内源性生物素,在添加外源性生物素之前就显示出生物素化活性。由于通过酵母分泌途径进化,TurboID在内质网腔中的活性明显高于BioID。
miniTurbo:miniTurbo也是基于酵母展示的BirA进化开发的,分子量仅为28kDa,miniTurbo存在N端结构域缺失和13 bp突变。这进一步减少了对融合蛋白转运和功能的潜在干扰。miniTurbo对生物素的亲和力较低,这使得它无法在缺乏高浓度外源生物素的情况下进行标记,从而可以更严格地控制标记时间窗。
基于过氧化物酶的邻近标记法
HRP:辣根过氧化物酶(HRP)是第一个能够将芳基叠氮化物生物素试剂转化为自由基的近距离标记酶。仅在分泌途径中有活性,如内质网管内和细胞表面。该方法有利于研究细胞膜结构域的蛋白质组成。此外,当与质谱分析相结合时,它允许研究细胞表面的分子相互作用。
APEX:APEX是2012年Martell等从二聚豌豆或大豆抗坏血酸过氧化物酶中提取了一种称新型近距离标记酶。APEX缺乏二硫键和钙结合位点,分子量较小(约28 kD),具有单体功能。APEX靶向细胞内的细胞器或特异性蛋白复合物。在H2O2条件下,用生物素-酚处理活细胞仅1分钟后,APEX催化生物素-酚单电子氧化形成生物素-苯氧基。这种自由基可以与标记半径内的相互作用的酪氨酸残基或邻近蛋白质的酪氨酸残基反应形成共价加合物。虽然这些自由基的寿命极短,但它们共价标记了APEX附近的内源性蛋白。最近,这项技术在确定人类线粒体基质、膜间隙(IMS)蛋白质组和线粒体钙单向转运体拓扑结构中的蛋白质组成方面发挥了至关重要的作用。

(数据来源 Mathew B, et al. Mol Cell Proteomics. 2022)
APEX2:APEX2是将APEX进行定向进化,利用酵母展示平台和荧光激活细胞分选(FACS)筛选产生的变异体。与APEX相比,它表现出更好的热稳定性和更高的生物素化活性。APEX2应用于电子显微镜时也更敏感,使用APEX2,染色可以实现跨大视野,不需要特殊设备。该方法可替代间接测量技术(如亚细胞分离),并可用于蛋白酶可及性测试或蛋白印迹法,以精确确定重要蛋白的亚细胞定位和膜拓扑结构。
基于Split-PL的邻近标记法
Split-PL系统可用于研究时空定义的二元蛋白复合物和膜接触位点的其他相互作用成分。PL酶(如HRP、APEX2、BioID或TurboID)被分为两个相互作用不佳的非功能片段,当与两种相互作用的蛋白质融合时,片段可以重新组装以恢复活性。
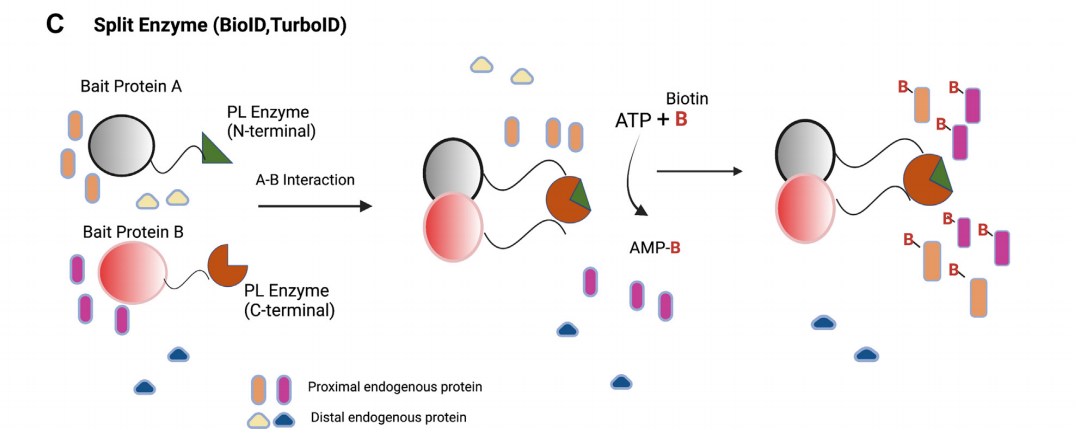
(数据来源 Mathew B, et al. Mol Cell Proteomics. 2022)
Split-BioID:Split-BioID的分子量为35 kDa。它能够验证蛋白质与蛋白质的相互作用,并同时标记属于活细胞中相应复合物的其他相邻蛋白质,从而弥补亲和纯化和BioID方法的局限性。split-BioID系统有效地降低了背景生物素化。
Split-TurboID:split-TurboID其分子量为35 kDa。将Split-TurboID作用于FRB-FKBP二聚体体系,rapamycin处理后,TurboID的两个非活性片段重组形成产生生物素-5 ' -AMP的活性酶。Split-TurboID有低亲和力和高亲和力两种形式。在生物素孵育不到1 h的情况下,两种方法均可催化邻近性标记,其活性不仅远高于split-BioID,而且也高于全长BioID。
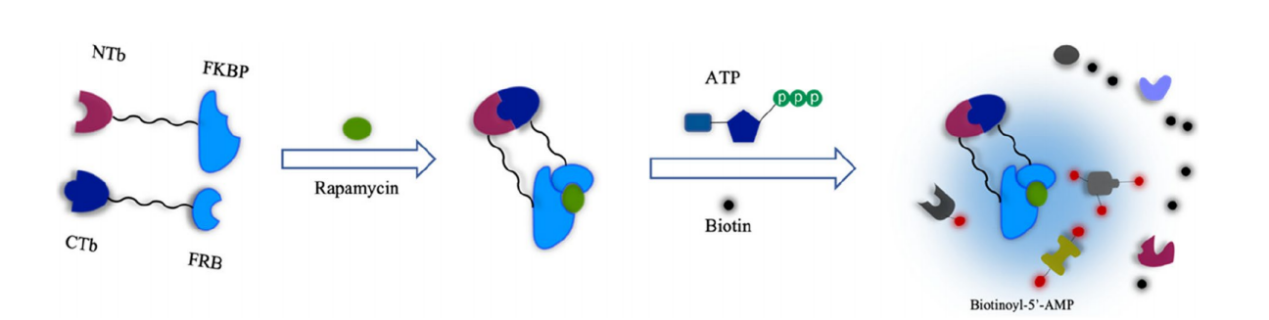
(数据来源 Guo J, et al. Cell Commun Signal. 2023)
Split-APEX2:plit-APEX2方法。该酶分为AP和EX两部分,AP为从酵母展示文库中筛选的含200个氨基酸的N端片段,EX为含50个氨基酸的C端片段。Split-APEX2技术已被应用于哺乳动物细胞膜、非编码RNA支架和线粒体相关内质网接触位点。
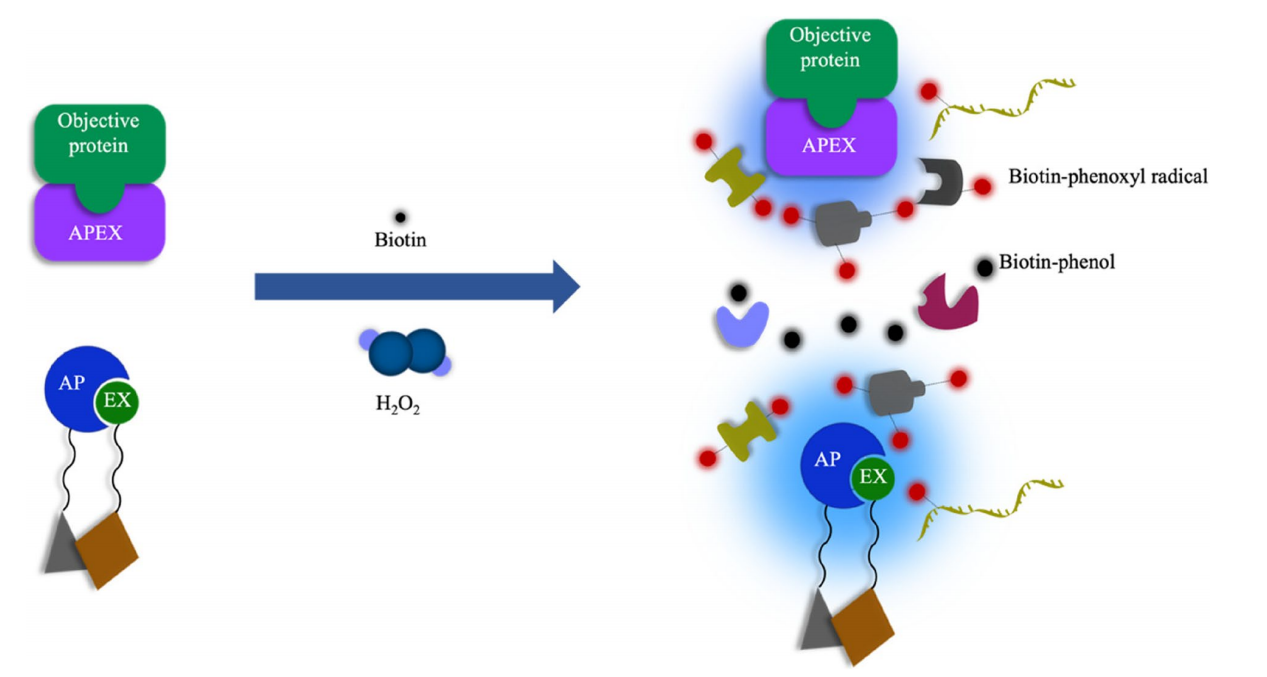
(数据来源 Guo J, et al. Cell Commun Signal. 2023)
邻近标记技术的应用
蛋白质-蛋白质相互作用(PPI)网络分析:利用PL识别单个PPI,破译不同蛋白的空间关系,构建蛋白质相互作用网络。
亚细胞区域的蛋白组成分析:用于分析特定亚细胞区域的蛋白质组成,如线粒体、内质网和细胞核等。
膜接触位点(MCSs)的研究:有助于研究细胞器之间的相互作用,尤其是在膜接触位点的蛋白质。通过使用PL技术,可以识别和研究这些位点上的蛋白质,从而更好地理解细胞内通讯和物质运输。
用于测定蛋白质的拓扑结构:可以揭示膜蛋白的拓扑结构,帮助理解其在信号传导和分子运输中的功能角色。
蛋白质-核酸相互作用的分析:用于研究DNA-蛋白质和RNA-蛋白质相互作用,包括转录因子与基因组特定位点的相互作用。

(数据来源 Yang X, et al. Plant Commun. 2020)
新的标志物或者靶点蛋白发现:邻近标记技术可以用于研究药物与其靶蛋白和RNA的相互作用,这对于药物开发和靶标验证非常重要。通过这种方法,可以确定药物的直接作用靶点,以及药物可能影响的信号通路和生物学过程。
E3泛素连接酶底物的鉴定:通过邻近标记技术,可以鉴定E3泛素连接酶的底物,这对于理解药物如何通过泛素-蛋白酶系统来调控蛋白质的稳定性和功能非常重要。
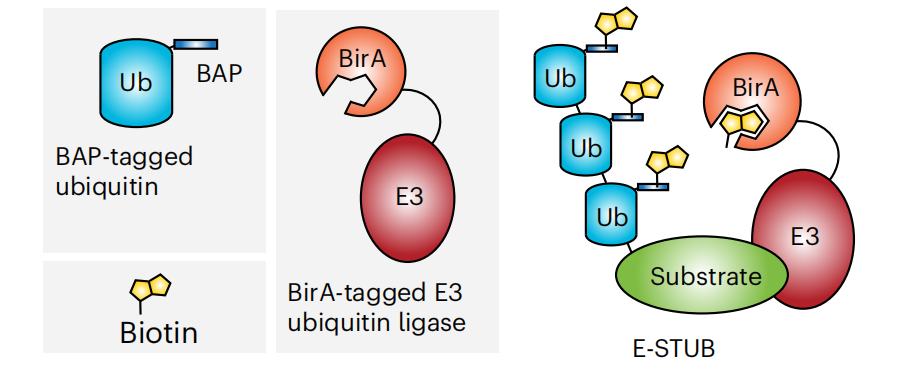
(数据来源 Huang HT, et al. Nat Chem Biol. 2024. )
邻近标记的重要技术考虑
选择合适的邻近标记:在选择用于特定类型实验的最佳酶时,需要考虑不同酶的特性。例如,APEX和HRP需要特定的底物和H2O2,这限制了它们在动物体内的应用。BioID和TurboID则因为其更高的催化活性和更快的动力学,更适合在动物体内使用。
(数据来源 Cho KF, et al. Nat Protoc. 2020)
2. 通过实验验证与PL酶的融合不会破坏诱饵蛋白的天然功能和定位是至关重要的。
3. 为了产生诱饵-酶融合,首选内源性基因组位点的CRISPR敲入或低滴度慢病毒递送,而不是瞬时反式感染,以最大限度地减少因诱饵过表达而产生的伪影。
4. 输入材料的数量(如细胞数量)和标记时间需要根据目标蛋白质组的大小仔细衡量,以确保有足够的生物素化材料用于高覆盖深度的MS检测。
