Tregs是肿瘤免疫排斥的主要屏障,选择性地消耗或抑制肿瘤中的Tregs并保留健康组织中的Tregs(维持免疫稳态所需)是消除肿瘤的可行策略,与其他免疫疗法联合使用效果会增强。通过人类原代Tregs中CD74的基因缺失,研究人员发现CD74KO Tregs在肿瘤内的肌动蛋白细胞骨架组织和细胞内细胞器中表现出缺陷,导致激活减少,Foxp3表达降低,肿瘤积累减少。CD74是肿瘤浸润性Treg的特异性调节因子,CD74可能是调节肿瘤Tregs的潜在治疗靶标。
调节性T细胞(Tregs)是维持体内平衡和控制免疫反应所必需的异质群体。Tregs也可抑制肿瘤免疫,Treg的可塑性使他们能够根据组织发展优化的机制来有效调节免疫反应,从而适应他们所处的微环境。然而,Treg对外部信号的适应也会引起Treg不稳定,这与从抑制功能向促炎功能的转变有关,并可能导致自身免疫的发展,或者加强抗肿瘤反应。因此,全面表征与个体组织或病理相关的Treg特征应有助于设计优化的免疫疗法。
2024年4月17日ElisaBonnin等研究员在nature Communications上发表了一篇名为“CD74 supports accumulation and function of regulatory T cells in tumors”的文章。研究人员发现人类肿瘤浸润性Tregs选择性的过表达MHCII类不变链CD74。CD74先前被描述为抗原呈递细胞生物学的调节剂,但其在Tregs中的功能仍然未知,为了了解CD74在Tregs中的作用,研究者从原代人Tregs中产生CRISPR-Cas9 CD74敲除(CD74KO)细胞,发现它在肿瘤组织中的功能完全失调。在稳态下,CD74KO-Treg表型、存活和抑制能力在体外和体内都不受影响。因此,CD74是肿瘤浸润性Treg的特异性调节因子和干扰Treg抗肿瘤活性的靶标。
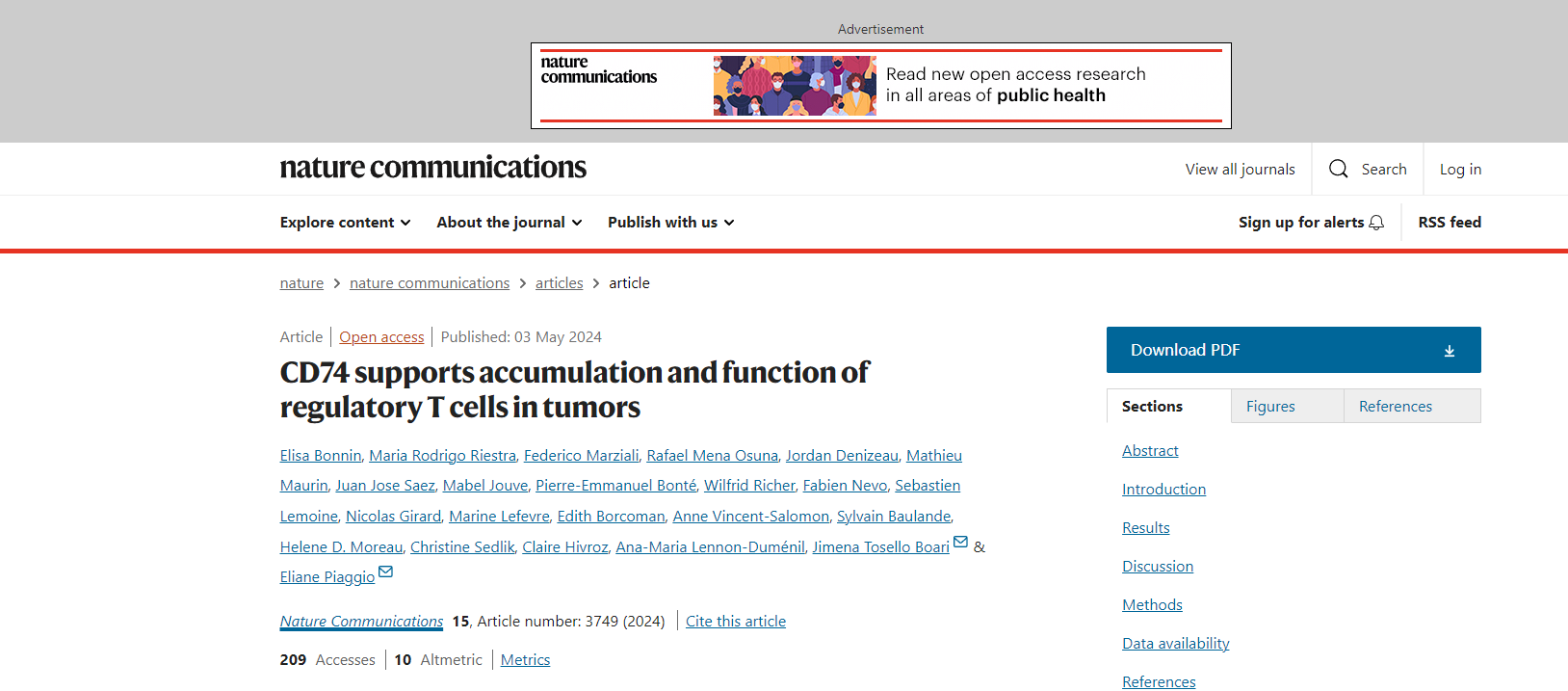
肿瘤相关的Tregs过表达CD74
通过分析来自非小细胞肺癌(NSCLC)患者的CD4+T常规(Tconv)和Treg细胞的单细胞RNA测序(scRNAseq)数据集,研究者发现,与肿瘤Tconvs相比,在肿瘤Treg中差异表达显著较高的基因中,观察到与活化的肿瘤Tregs相关的基因,如CD25、HLA-DR、CTLA-4和CCR8,以及CD74。与血液Tregs和血液和肿瘤Tconvs相比,肿瘤Tregs过表达CD74。通过流式细胞术分析NSCLC患者的血液和肿瘤样本Tregs和Tconvs表面的CD74表达水平,发现很少有血液和肿瘤Tconvs以及血液Tregs在表面表达CD74,而6%至22%的肿瘤表达Tregs。
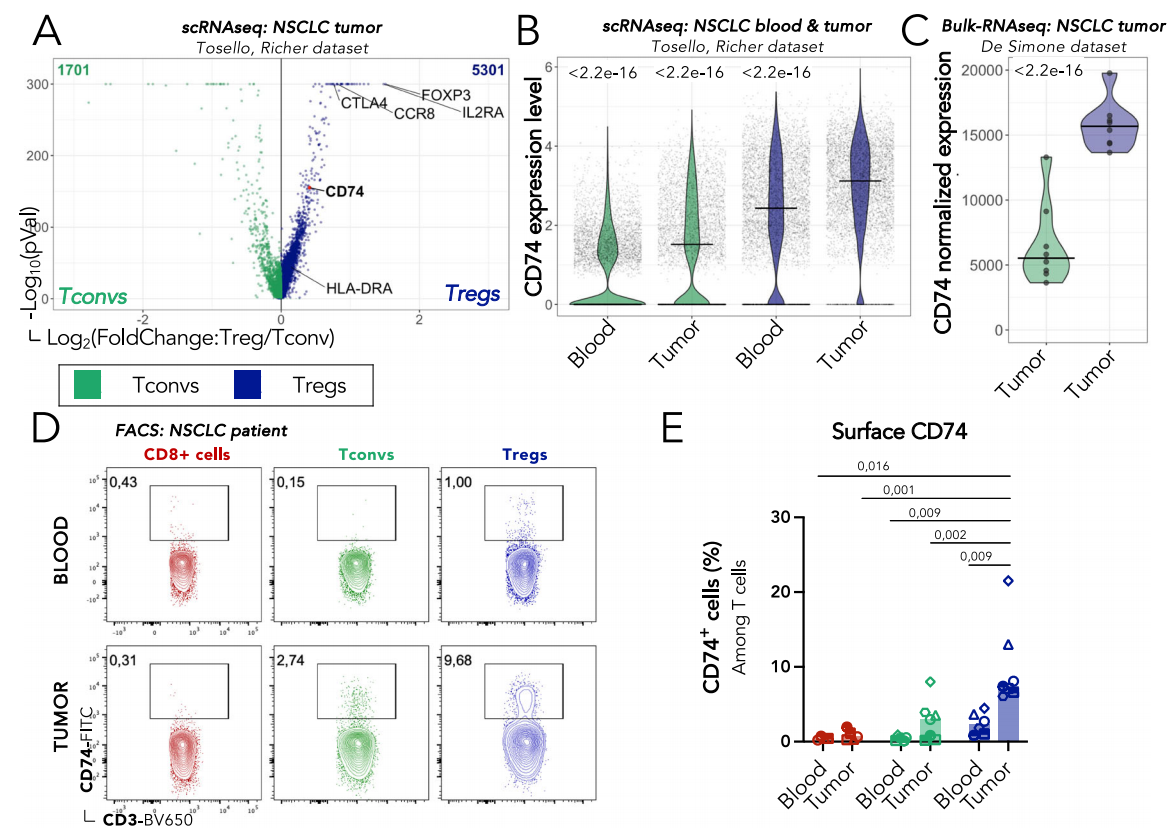
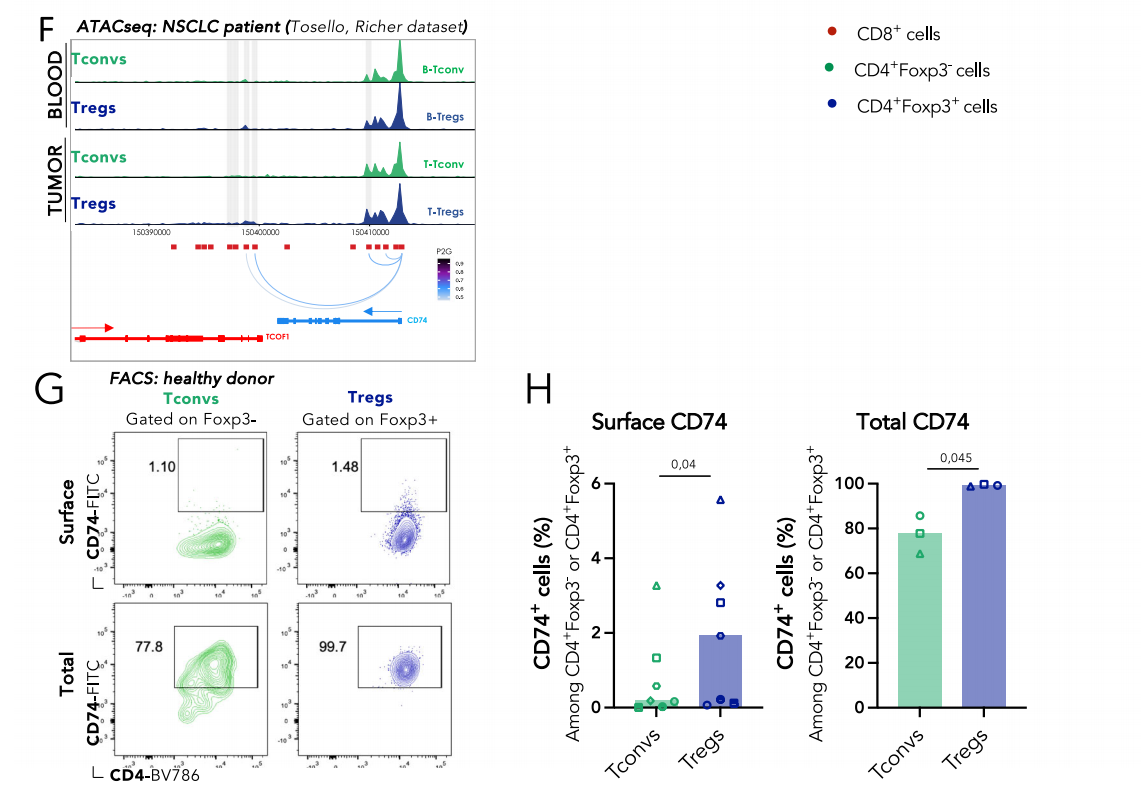
体外CD74缺乏不影响Tregs的存活,表型和抑制能力
通过CRISPR-Cas9技术在Tregs上敲除CD74基因,使用流式细胞术检测CD74缺失后的表达情况,发现70-90%的Tregs在电穿孔后4天失去CD74蛋白表达。CD74的缺失对于体外Treg增殖、激活和抑制功能没有影响。
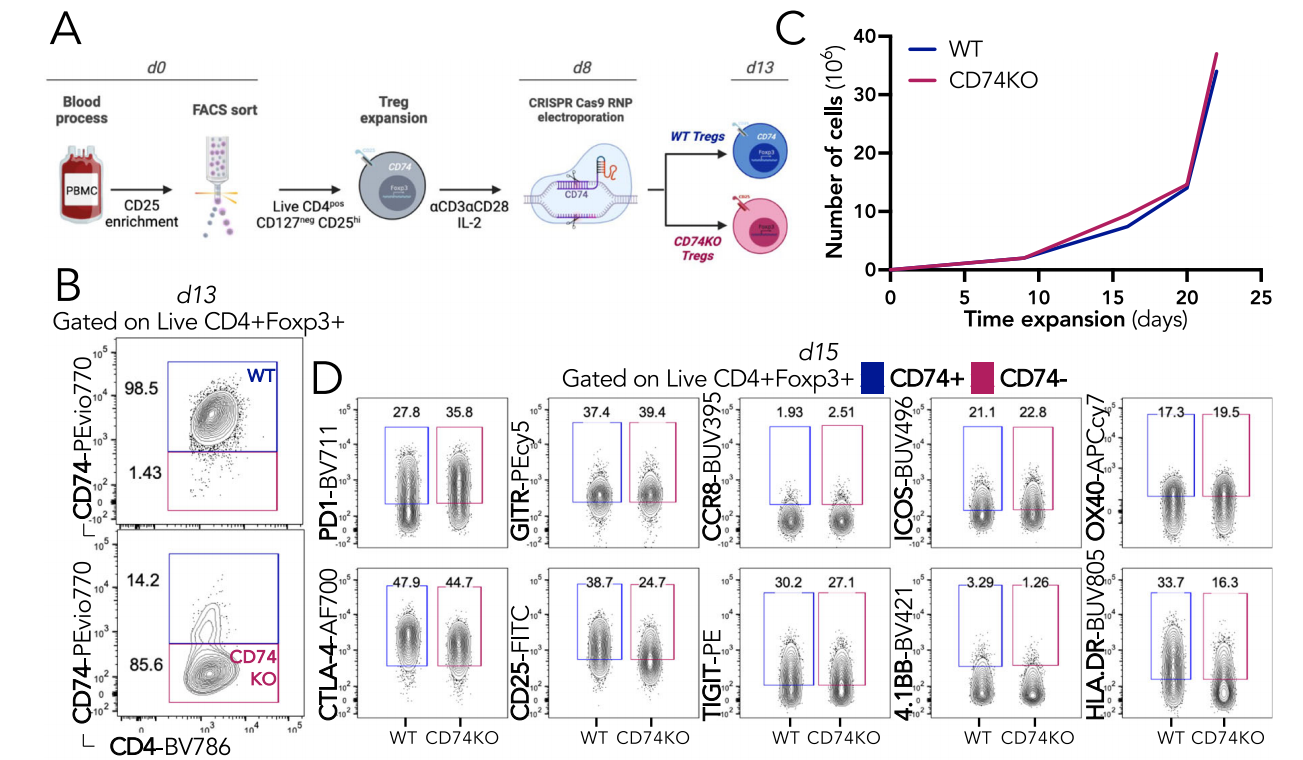
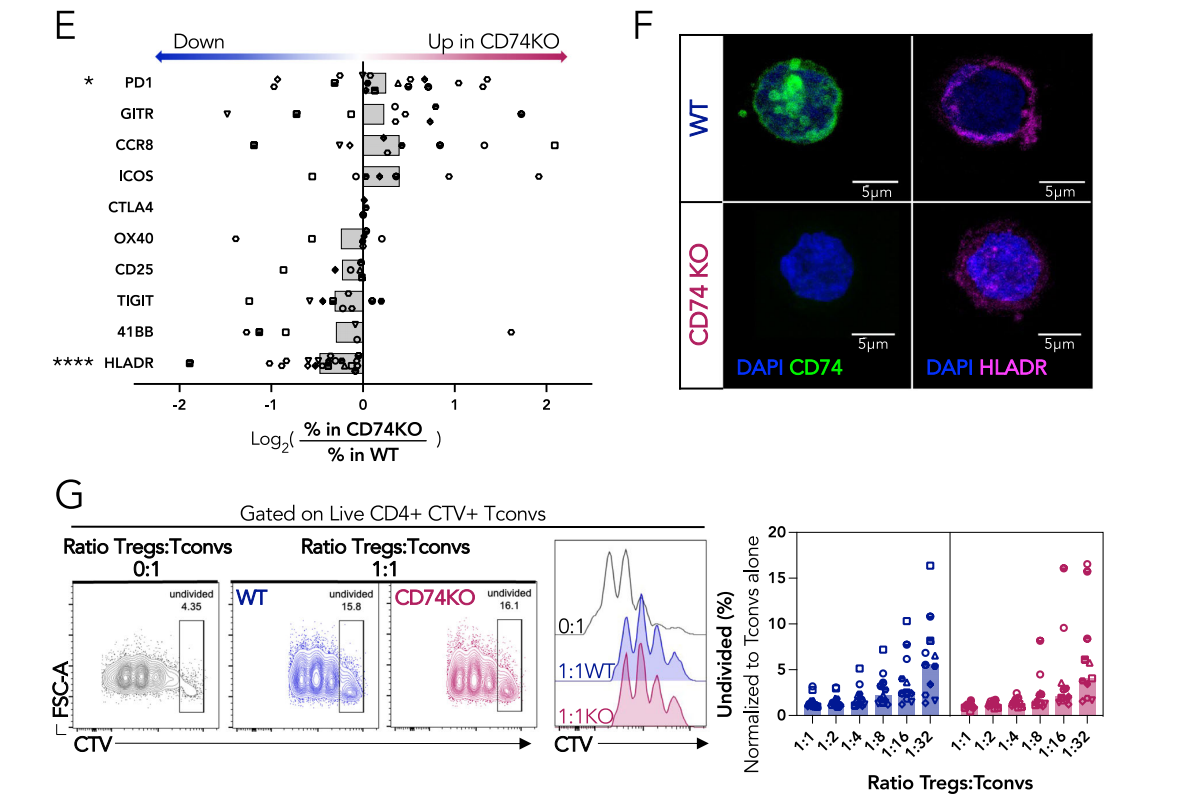
缺乏CD74的Tregs保留了抑制功能
使用异种移植物抗宿主病(GvHD)模型评估CD74对体内Treg抑制活性的需求,在该模型中,GvHD是通过将人PBMC注射到NSG免疫缺陷小鼠中来诱导的,并且共同注射Tregs限制了效应T细胞的激活,从而减轻了该疾病的临床症状。通过跟踪血液中注射的expTreg动力学,发现从注射后第4天到第8天,血液中检测到WT和CD74KO Tregs,并呈现相似的动态。仅接受PBMCs的小鼠从第20天左右开始出现严重的GvHD(体重减轻超过20%),而同时注射WT或CD74KO expTregs延迟了临床症状的出现。缺乏CD74的Tregs对异种GvHD的控制程度与WT Tregs相似,表明CD74对于GvHD模型体内Treg抑制活性是可有可无的。
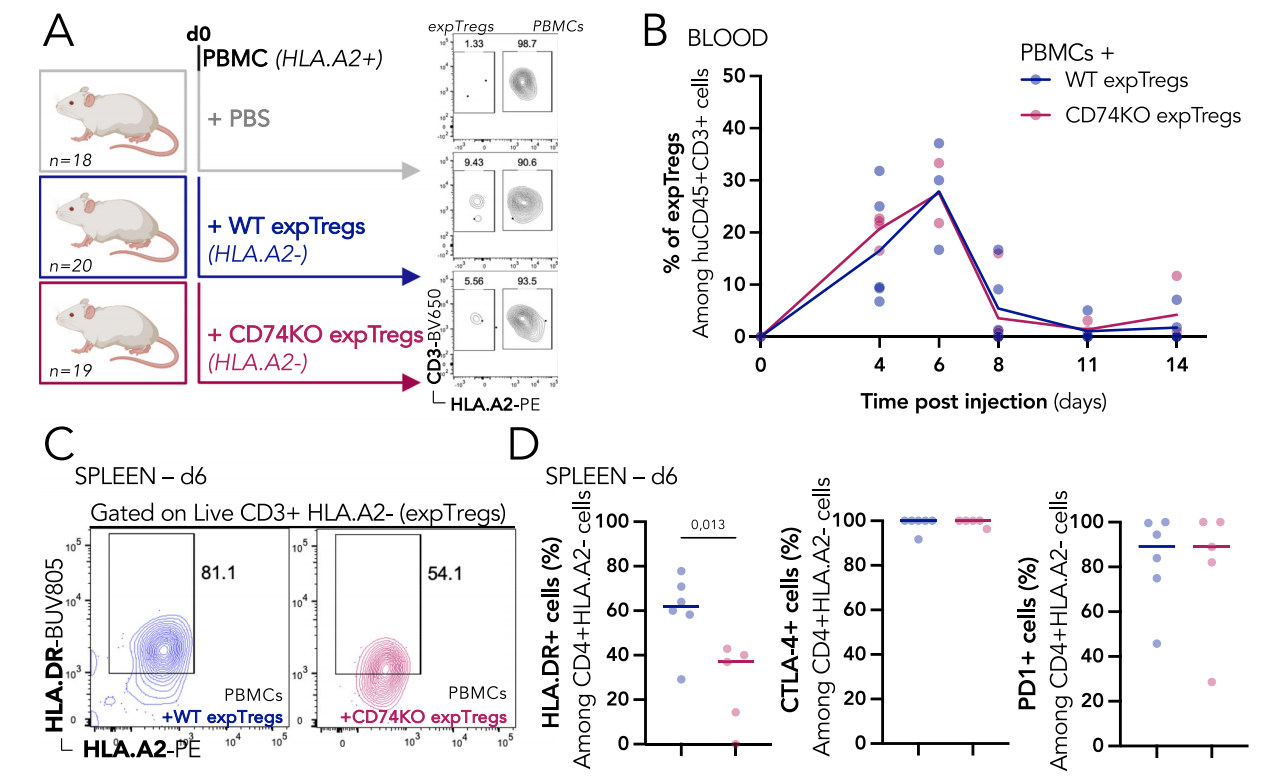
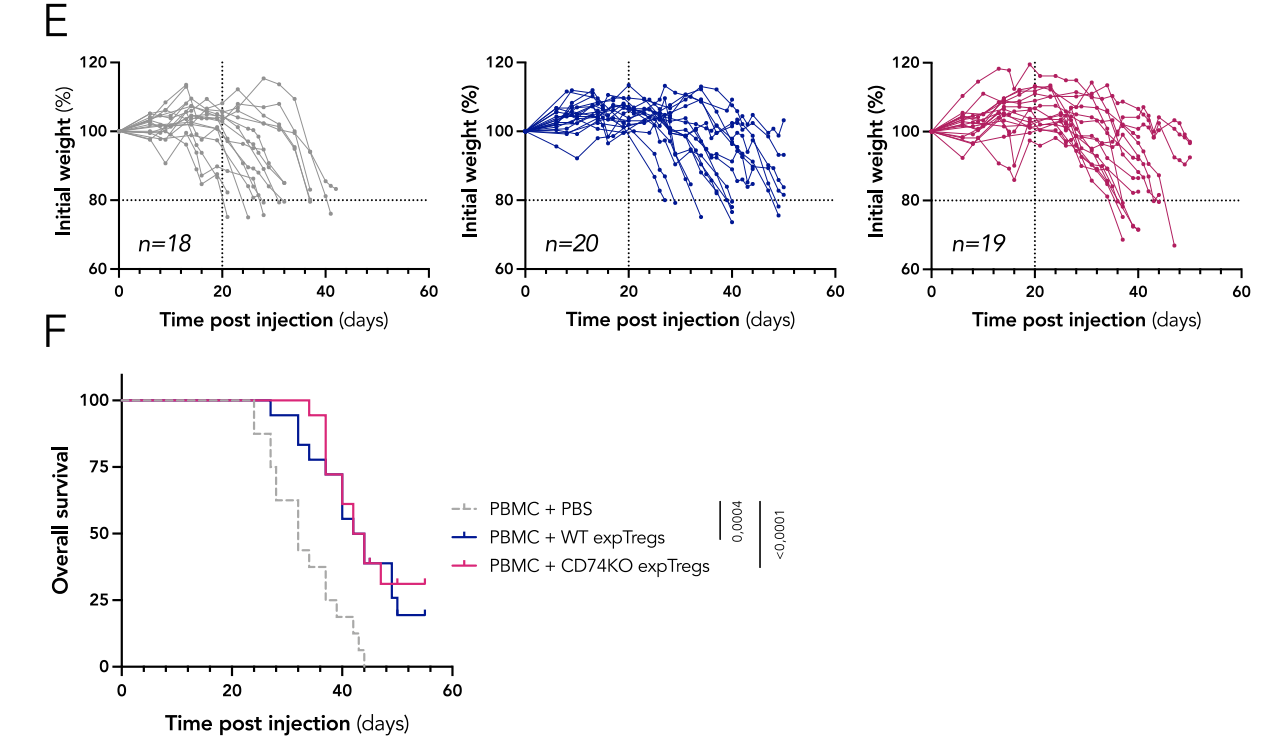
CD74稳定肿瘤内Tregs的抑制性表型
研究者将MDA-MB231三阴性乳腺癌细胞移植到NSG小鼠中,在第10天,当肿瘤可触及时,小鼠不进行治疗(对照组)或单独注射新鲜PBMCs或与体外扩增WT或CD74KO Tregs(expTregs)共同注射。对照小鼠中,肿瘤呈指数增长,注射PBMCs导致肿瘤排斥反应,WT expTregs的加入略微延迟了肿瘤的消除,但是CD74KO expTregs显著加速了肿瘤排斥反应。表明Tregs中CD74的表达是Tregs维持其在肿瘤中的抑制功能所必需的。
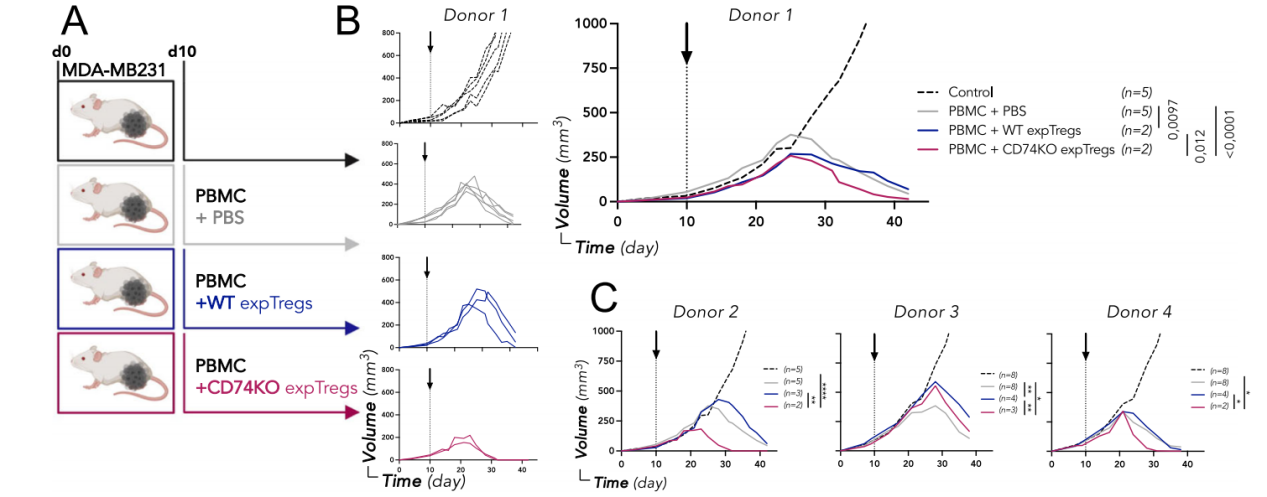
Foxp3在Treg中的表达缺失与Treg表型不稳定有关,分析不同条件下Foxp3的几何平均值,移植后6天脾脏CD74KO Tregs中的几何平均值略低。与脾脏相比,WT Tregs在肿瘤中显示Foxp3水平显著升高,相反肿瘤浸润的CD74KO Tregs显示Foxp3表达显著下降。这些结果表明,在某些炎症条件下,需要CD74来确保Treg的稳定性。在单独的tuSN或与IL-12存在的情况下,Treg的激活诱导CD74KO中的细胞凋亡,但在WT Tregs中则不然,这表明CD74有助于在肿瘤衍生的可溶性因子存在下增加Treg的存活。研究人员发现tuSN与IL-12一起孵育诱导了最高的IFNγ产量,在CD74KO Tregs中观察到最大增加,表明CD74在TME中Treg抑制功能的保存中发挥着至关重要的作用。CD74在保持TSDR去甲基化中起调节作用,并为CD74介导的Tregs中Foxp3稳定性的维持提供了分子基础。
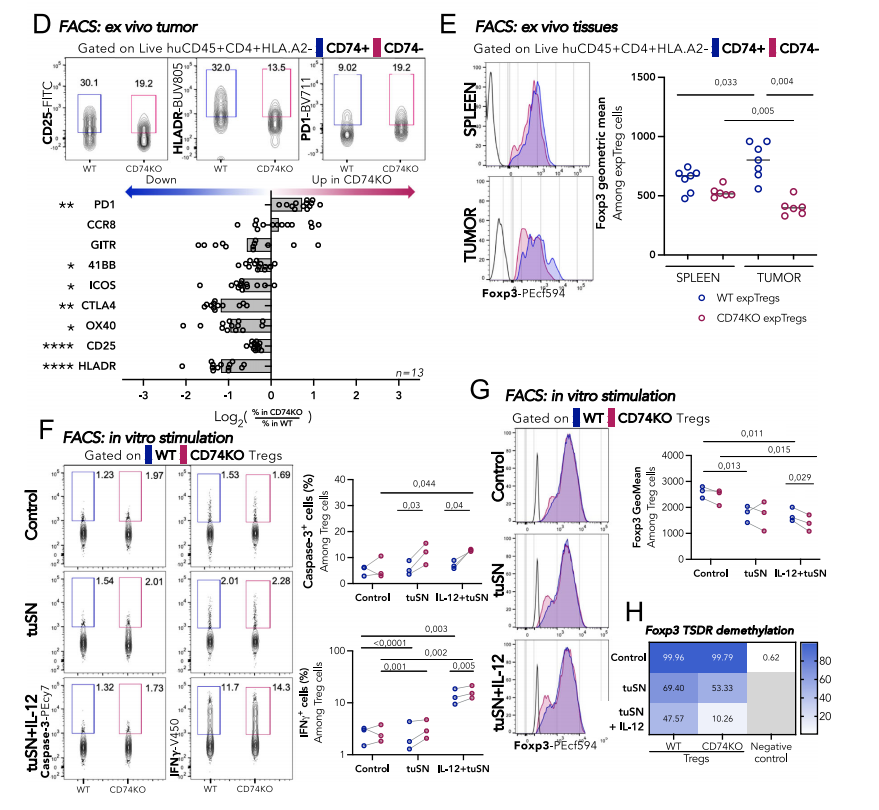
CD74有利肿瘤浸润并维持Foxp3水平
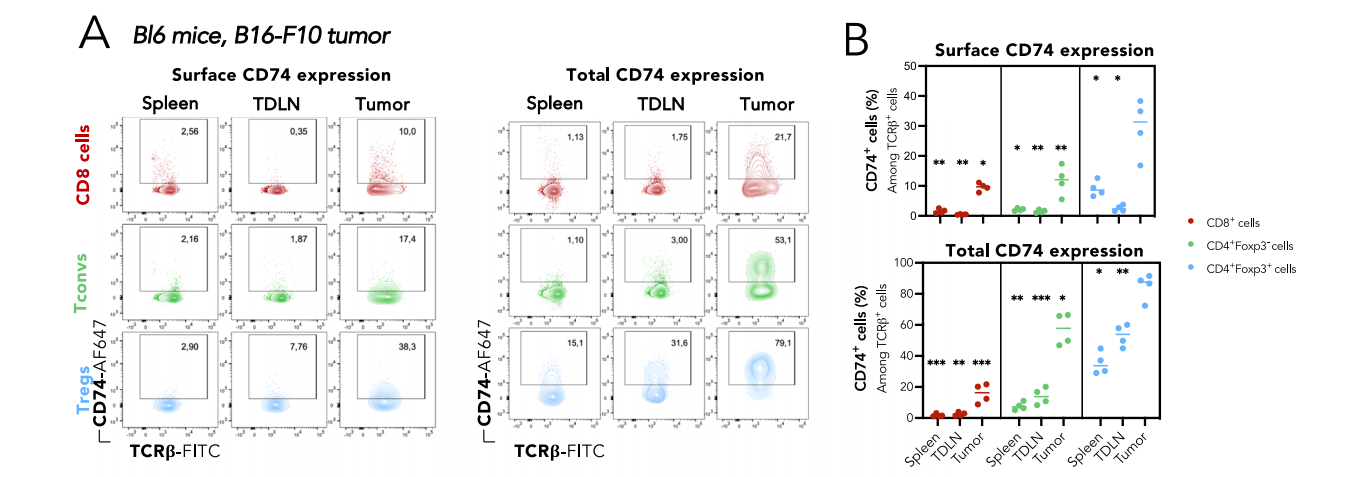
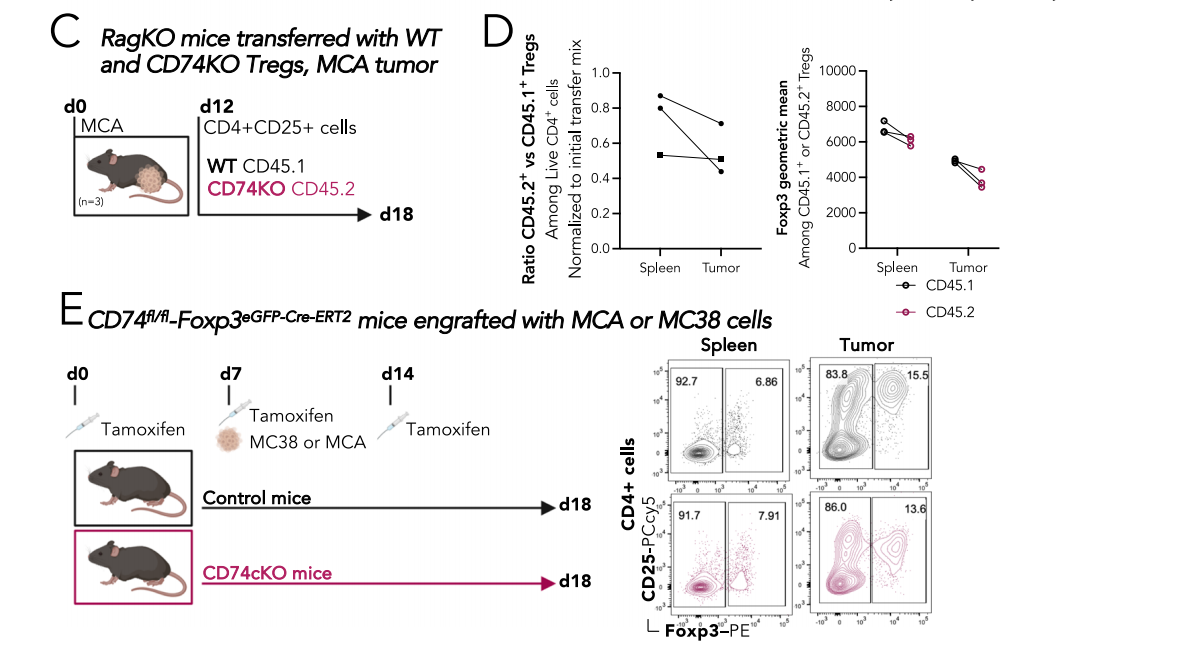
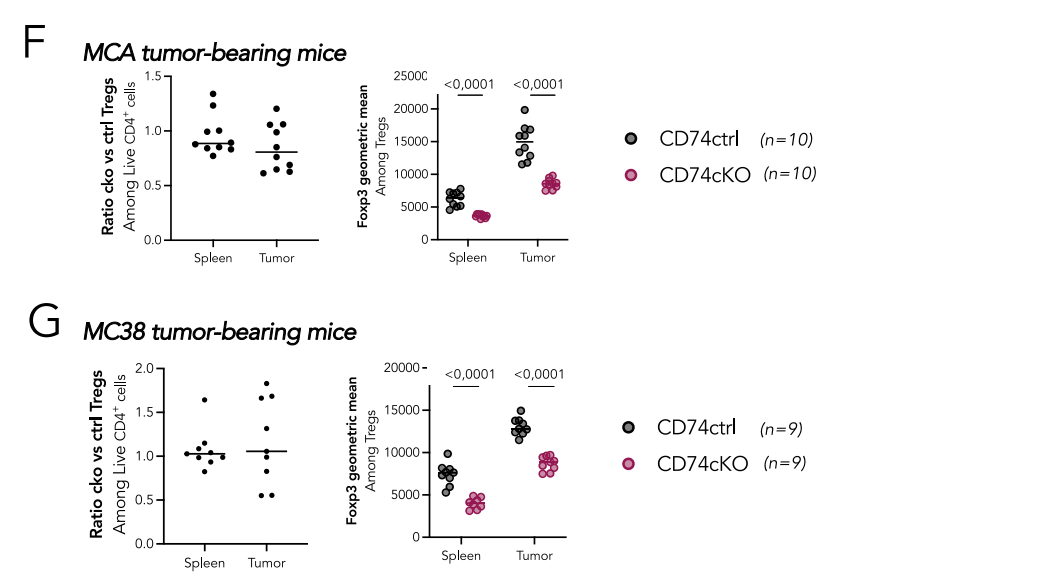
研究发现CD74可以调控Tregs的迁移能力以及Treg的大小和细胞骨架收缩性。使用移植了B16-F10黑色素瘤细胞的免疫活性C57BL/6小鼠,肿瘤Treg中CD74的表面表达高于外周Tregs,也高于肿瘤和外周CD4+Tconvs和CD8+T细胞。将从CD45.1WT或CD45.2CD74完全KO小鼠中分选的CD4+CD25 high Treg共注射到MCA肿瘤荷瘤Rag-KO小鼠中,与脾脏相比,肿瘤中的KO/WT Treg比率略低,并且伴随着Foxp3水平的显著下降,这些结果表明CD74在肿瘤中Tregs积累中具有潜在作用。
总结
Tregs是肿瘤免疫排斥的主要屏障,因为它们诱导肿瘤免疫耐受并促进肿瘤血管生成。选择性地消耗或抑制肿瘤中的Tregs并保留健康组织中的Tregs(维持免疫稳态所需)是消除肿瘤的可行策略,与其他免疫疗法联合使用效果会增强。研究人员发现CD74KO Tregs在肿瘤内的肌动蛋白细胞骨架组织和细胞内细胞器中表现出缺陷,导致激活减少,Foxp3表达降低,肿瘤积累减少。在临床前模型中,CD74KO Tregs与加速肿瘤排斥有关,突出了CD74在肿瘤浸润性Tregs中的特定作用。减少CD74表面表达可以抑制Treg在肿瘤中的积累,CD74可能是调节肿瘤Tregs的潜在治疗靶标。
