CHO细胞,又称中国仓鼠卵巢细胞,是生物制品生产中广泛使用的细胞系,最初来源于中国仓鼠的卵巢,因此得名。几十年来,CHO细胞已被培养和操作用于分子生物学和药物生物技术,它们在重组抗体技术中非常受欢迎。


(CHO转染荧光蛋白显微镜下图像)
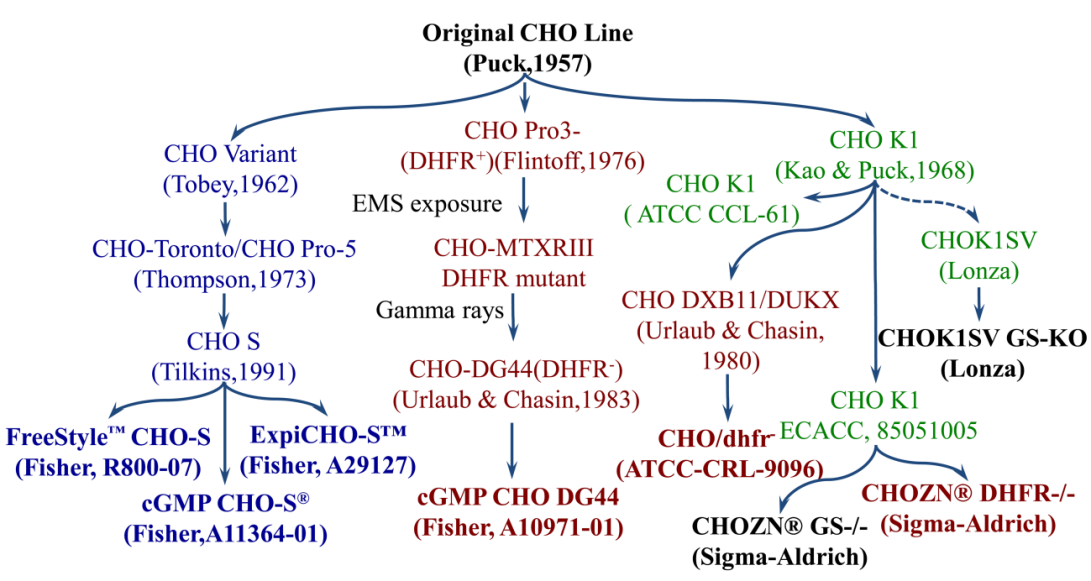
CHO细胞的历史:
1957年,T. Puck为细胞遗传学研究开发了首个中国仓鼠卵巢(CHO)细胞系,20世纪80年代初,CHO作为异源蛋白生产宿主细胞受到越来越多的关注。原始CHO细胞系已被多次亚克隆,最常用的细胞系:CHO-k1、CHO DG44和CHO-S均来自不同的CHO谱系。CHO因遗传和表型不稳定导致高度的多样性,不同的培养条件会导致CHO细胞具有独特的功能属性,如增殖、糖基化能力和重组蛋白表达水平。
(数据来源Xu N, et al. Biochem Eng J. 2017)
CHO细胞系列:
CHO-S:20世纪60年代初,Theodore Puck注意到CHO细胞的亚群可以作为非粘附悬浮培养生长,1973年多伦多大学的Thompso驯化出了一株可用于悬浮培养的CHO细胞,能够在生物反应器中使用该细胞系进行更大规模的培养,之后Gibco公司将此细胞驯化至CD CHO培养基中,建库并以CHO-S名称进行推广。CHO细胞在悬浮培养中生长的适应性标志着动物细胞培养技术的模式变化,并最终为使用搅拌式生物反应器(STRs)大规模生产高达20,000 L的重组蛋白治疗药物铺平了道路。
CHO-DG44:1983年,Urlaub和Chasin构建了一个完全缺失DHFR位点的CHO细胞系CHO-DXB11,DHFR缺陷CHO细胞无法正常生长。当转染的细胞用甲氨蝶呤叶酸(MTX)处理时,MTX通过竞争性结合DHFR酶的催化位点来抑制DHFR活性,防止二氢叶酸转化为DNA合成所需的活性四氢叶酸。随着DHFR缺陷CHO细胞的培养基中MTX浓度逐步增加,稳定转染载体编码感兴趣基因(GOI)和DHFR,进一步增加了细胞的选择压力。这导致DHFR和GOI的基因组扩增,导致转基因副本数量增加,因此存活的细胞池通常表现出重组蛋白的细胞生产力增强。
CHO-K1:未经改造的野生型CHO细胞。1968年存放在ATCC中,即现在的CHO-K1(ATCC CCL-61)。1985年分离出一个亚克隆保存在ECACC (85051005)。最初的CHO-K1细胞培养过程中需要添加血清,并且是贴壁生长的。2002年Lonza公司将CHO-K1细胞驯化至无血清培养基中悬浮培养,建立了CHOK1 SV细胞,主要和GS筛选系统组合使用,在GS筛选系统中,目的基因和单拷贝的GS基因被运送到细胞中。稳定的细胞在不含谷氨酸的培养基中进行筛选,同时可以添加MSX增加筛选强度,最终达到筛选高表达的细胞株的目的。2006年Merck将CHO-K1细胞株经悬浮驯化至化学限定培养基中,得到CHOZN CHO-K1(Merck,2006)细胞株。
CHO优势:
⭕ 可进行许多翻译后修饰以获得生物仿制药,几乎与人类相同的质量产品,这些产品显示出卓越的生物相容性和药物活性;
⭕ 作为贴壁和悬浮培养生长良好,高生产率,是大规模培养和 GMP 程序的理想选择;
⭕ 许多经过充分验证的遗传工具,可用于优化 CHO 细胞。从基因引入到敲除、敲低和翻译后沉默;
⭕ 获批产品数量惊人(用于约 50 种生物治疗药物生产,这些药物已在欧盟和美国获得批准);
⭕ 适用于无蛋白、无动物生产、无血清培养条件,并具有更好的稳定性和安全性;
我们开发了专有的CHO细胞抗体表达平台,以满足制药、生物技术、诊断和学术界对重组抗体技术不断增长的需求。这种无血清CHO细胞中瞬时表达系统提供了更快、更经济的抗体表达生产,同时为稳定细胞系生成提供前期测试支持,可以进一步开发为稳定细胞株。